蓝舌病病毒NS4 基因原核表达载体的构建与表达
马 骥,朱文青,林俊泓,易华山,胡庭俊
(1.广西大学 动物科学技术学院,南宁 530005;2.西南大学 动物医学院,重庆荣昌 402460)
蓝舌病病毒(Bluetounge virus,BTV)通过库蠓传播,感染以绵羊为首的多种反刍动物,引起蓝舌病(Bluetounge,BT),患病动物表现为口唇充血水肿、舌部发绀等[1-2]。BT 的流行对以欧洲为主的世界范围内的畜产品贸易造成严重影响,世界动物卫生组织(World organization for animal health,OIE)将其列为法定报告的动物疫病,中国也将其列为一类动物疫病[3]。对BT 的预防主要通过接种灭活疫苗与弱毒疫苗[4]。BTV 目前已鉴定出至少29个血清型及其他的新型非典型性血清型,而各血清型之间较弱的交叉免疫反应、隐性感染动物和(或)感染动物与疫苗免疫动物的鉴别(Differentiating infected from vaccinated animals,DIVA),仍然是BT 有效防控的巨大挑战[4-7]。
BTV 是呼肠孤病毒科(Reoviridae),环状病毒属(Orbivirus)的双链RNA(Double-stranded RNA,dsRNA)病毒,病毒粒子为二十面体对称的圆形无囊膜颗粒,由10条分节段的dsRNA 编码7种结构蛋白(VP1-VP7)和至少4种非结构蛋白(NS1、NS2、NS3/NS3A、NS4、S10-ORF5)[8-9]。2011年,Belhouchet等[10]在BTV VP6的开放阅读框(Open reading frame,ORF)中发现BTV NS4的ORF。NS4含77到79个氨基酸残基,其氨基酸序列在不同血清型中高度保守[11]。Belhouchet等[10]发现NS4 包裹于胞质内的脂滴周围,还能保护dsDNA 不被脱氧核糖核酸酶Ⅰ降解;Ratinier等[12]发现NS4下调Ⅰ型干扰素与干扰素刺激基因的转录水平以及多种启动子的活性,但不影响mRNA 的剪切;Li等[13]发现NS3与NS4协同作用,靶向Janus酪氨酸激酶-信号转导子和转录活化子(Janus tyrosine kinases-signal transducers and activators of transcription,JAKSTAT)通路中的STAT1,通过抑制其磷酸化,二聚化等抑制宿主天然免疫反应;笔者课题组的研究表明NS4 可能通过抑制干扰素通路上游的RIG-Ⅰ、MDA5、IRF9等基因抑制下游IFN-β以及ISGs等的表达。有鉴于NS4在调控宿主天然免疫信号通路中发挥的重要作用,本研究拟构建BTVNS4基因原核表达载体,以期实现NS4蛋白的高效表达,为进一步研究NS4的免疫拮抗功能及基于NS4的诊断方法研究提供基础。
1 材料与方法
1.1 菌株与质粒
E.coliBL21、蓝舌病毒NS4基因p GEM-TNS4质粒、pET-32a质粒均由西南大学动物医学院兽医科学研究中心保存。
1.2 主要试剂与仪器
ExTaq酶、DL 5000 DNA Marker购自北京宝日医生物有限公司;Axygen quick Gel Extraction Kit、Axy Prep质粒DNA 小量试剂盒购自吴江康宁生命科学有限公司;限制性内切酶BamHⅠ、EcoR Ⅰ、IPTG 购自大连宝生生物有限公司;Trans T1 感受态细胞、氨苄西林(Ampicillin,Amp)购自北京TransGen Biotech 公司;Beyo-ColorTM彩色预染蛋白Marker、考马斯亮蓝快速染色液、辣根过氧化物酶标记山羊抗兔IgG、ECL化学发光试剂盒购自上海碧云天生物技术有限公司;兔抗NS4 多克隆抗体由本实验室自制并保存。其余所用试剂均为进口或国产分析纯。PCR仪、蛋白电泳仪购自美国Bio-Rad公司;超高灵敏度化学发光检测仪FUSION FX-XT 购自法国VILBER 公司。
1.3 BTV NS4 基因的扩增
参照NCBI中Genbank 收录NS4基因序列(AFV68249.1),利用Primer 5.0软件设计并合成引物NS4 F 和NS4 R,在上、下游引物5′端分别添加BamH Ⅰ和EcoR Ⅰ酶切位点(下划线部分)。引 物NS4 F:5′-CGCGGATCCATGGTGAGGGGACACAACAGA-3′,NS4 R:5′-CGGAATTCCTACCCATCCTCCTCTGCTCG-3′,目的基因大小为246 bp,引物由北京华大基因科技有限公司合成。以p GEM-T-NS4质粒为模板,NS4 F与NS4 R 为引物,PCR 扩增NS4基因,反应总体系为20μL。反应程序为:95 ℃预变性5 min;95 ℃变 性45 s,60 ℃退 火45 s,72 ℃延 伸1 min,35 个 循 环;最 后72 ℃延 伸10 min,4 ℃保存。PCR 产物经电泳分析正确后,用Axygen quick Gel Extraction Kit按步骤回收、纯化目的基因片段。
1.4 p ET-32a-NS4 重组质粒的构建
用BamH Ⅰ、EcoR Ⅰ内 切 酶 将p ET-32a双酶切,Solution Ⅰ16 ℃过夜连接,转化至大肠杆菌Trans T1感受态细胞,LB 固体培养基上37℃过夜培养。挑选阳性单克隆菌落接种于含Amp的LB 液体培养基,37 ℃摇床培养。用Axy Prep 质粒DNA 小量试剂盒提取质粒,经双酶切鉴定正确后,送至华大基因重庆公司测序,将测序正确的重组质粒命名为p ET-32a-NS4。
1.5 IPTG 最佳诱导时间的探索
将p ET-32a-NS4接种至含Amp的LB液体培养基,37 ℃摇床过夜培养后,按照1∶1 000的比例接种至含Amp的液体培养基,37 ℃摇床培养,在1 h、2 h、2.5 h、3 h时分别取菌液,以相同培养液为阴性对照,测定OD 值直至0.6~0.8。取OD 值0.6~0.8的菌液1 m L作空白对照,其余加入终浓度为0.6 mmol/L 的IPTG 溶液,37 ℃摇床培养,分别在1 h、2 h、4 h、6 h、8 h、10 h、12 h时采样,样品3 000 r/min离心2 min,弃大部分上清液后加入5×蛋白上样buffer混匀,沸水浴8 min后高速离心。配制12%聚丙烯酰胺凝胶电泳分离胶和5%浓缩胶,上样后60 V跑浓缩胶,120 V 跑分离胶。电泳结束后将胶用清水振荡洗涤两次,每次5 min,再加入考马斯亮蓝染色液染色25 min后,振荡洗涤直至水澄清,凝胶成像系统观察电泳结果。
1.6 IPTG 最佳诱导浓度的探索
按“1.5”所述方法培养细菌,当OD 值为0.6~0.8时,取1 m L菌液作为空白对照,其余分别加入终浓度为0.2、0.4、0.6、0.8、1.0 mmol/L的IPTG 溶液,37℃摇床培养,分别在4、6、8 h时取样,按“1.5”所述方法进行SDS-PAGE。
1.7 重组蛋白表达形式的探索
将OD 值为0.6~0.8 的菌液,以“1.5”与“1.6”测定的最佳诱导浓度与诱导时间加入IPTG,取样。将样品以3 000 r/min离心5 min,去掉上清,沉淀用PBS洗涤两次,3 000 r/min离心2 min,PBS再洗涤沉淀两次,加入适量的PBS混匀后,超声破碎。破碎后12 000 r/min离心10 min,分离上清、沉淀,以PBS稀释沉淀至体积与上清相同,加入5×蛋白上样缓冲液,沸水浴8 min后,进行SDS-PAGE。
1.8 可溶性蛋白表达可能性的探索
活化细菌,接种至含Amp的LB液体培养基中,37 ℃摇床培养2~3 h,当OD 值为0.6~0.8时,加入0.8 mmol/L IPTG,16 ℃摇床诱导过夜后,按“1.7”所述方法处理样品,SDS-PAGE分析。
1.9 重组蛋白的Western-blot鉴定
将表达产物SDS-PAGE 电泳后转至PVDF膜,碎冰中200 m A 恒流转膜40 min,加入封闭液4 ℃封闭过夜。NS4 兔抗多克隆抗体(一抗)1∶1 000稀释,4 ℃孵育过夜,PBST 洗6 次,辣根过氧化物酶标记山羊抗兔IgG(H+L)(二抗)以1∶3 000比例稀释,室温孵育1 h,PBST 洗6次,显影,使用超高灵敏度化学发光检测仪FUSION FX-XT 分析重组蛋白的表达情况。
2 结果与分析
2.1 目的基因的扩增与重组质粒的构建
连接目的基因片段与p ET-32a载体,转化培养,挑取单菌落经PCR 检验,结果如图1所示,提取质粒经酶切检测,结果如图2所示。
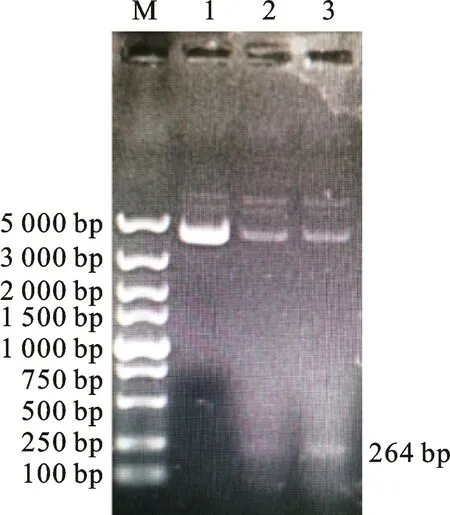
图1 pET-32a-NS4 重组质粒PCR 鉴定图Fig.1 PCR identification of recombinant plasmid pET-32a-NS4

图2 pET-32a-NS4 酶切电泳检测Fig.2 Electrophoretic detection of restriction digestion of plasmid pET-32a-NS4
2.2 IPTG 最佳诱导时间
结果如图3所示,重组蛋白大小为27 ku。在诱导6 h时表达量最大,8 h时无明显增加,10 h、12 h的表达量减少,因此IPTG 的最佳诱导时间为6 h。为减少试验结果的偶然性,后续对IPTG最佳诱导浓度的探索将于4 h、6 h、8 h分别取样。

图3 0.6 mmol/L浓度IPTG 诱导不同时间重组蛋白表达量Fig.3 Expression index of recombined protein in induced by IPTG at different times with concentration of 0.6 mmol/L
2.3 IPTG 最佳诱导浓度
结果如图4所示,IPTG 浓度0.8 mmol/L时表达量最高,浓度1.0 mmol/L表达量减少,因此最佳浓度为0.8 mmol/L。
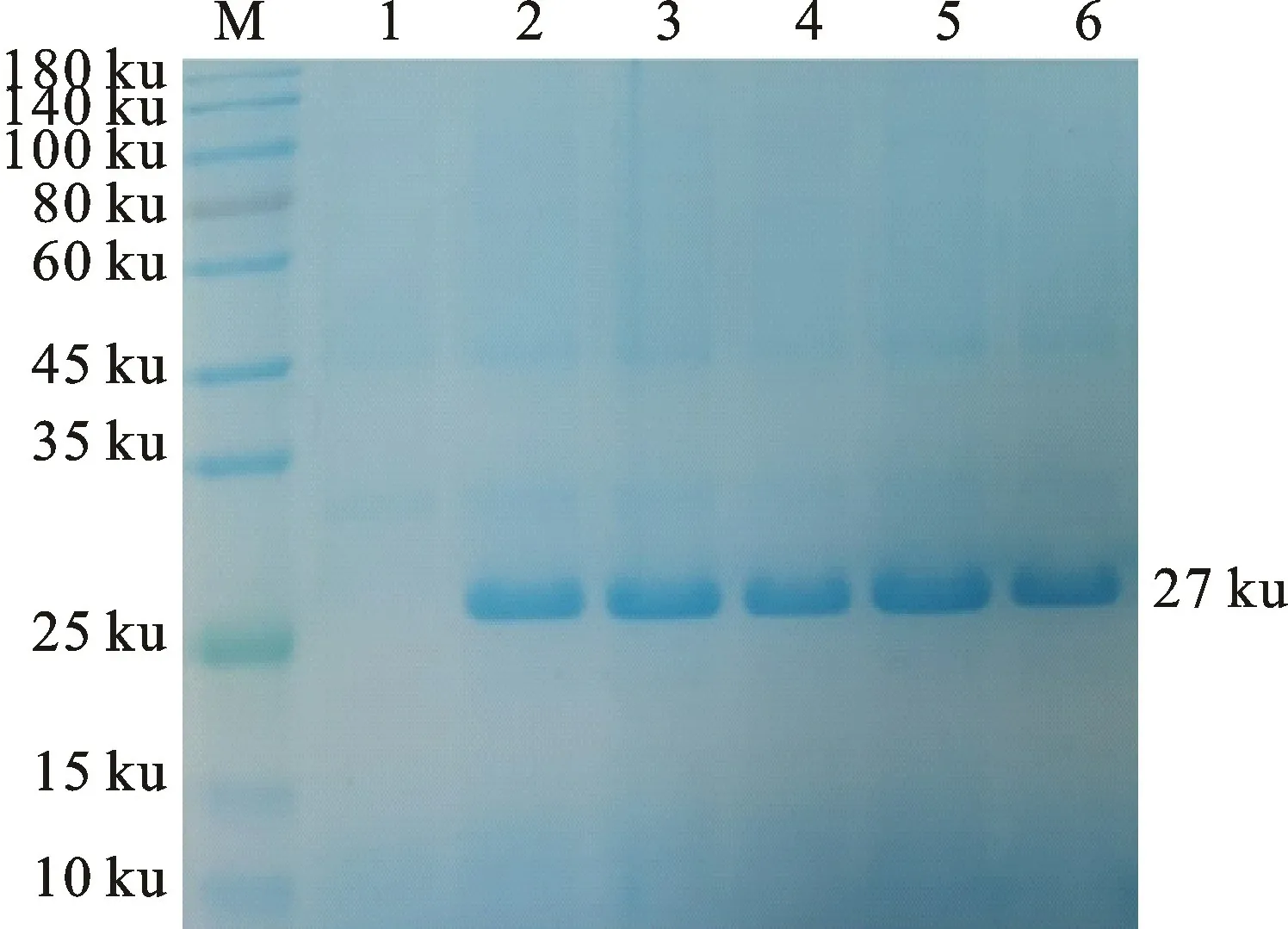
图4 不同IPTG 浓度诱导6 h表达产物分析Fig.4 Analysis of expression products induced by different IPTG concentrations for 6 h
2.4 重组蛋白表达形式与可溶性蛋白表达可能性
结果如图5所示,沉淀组中有明显的条带,而上清液中的条带较弱,说明诱导的蛋白大部分位于沉淀中,以包涵体形式表达。将菌液以最佳诱导条件4℃摇床过夜培养后,结果如图6所示,可溶性蛋白的表达量无明显改变,表明重组蛋白依然以包涵体形式表达。

图5 表达产物的可溶性分析结果Fig.5 Analysis results of solubility in expression products

图6 16 ℃上清中可溶性蛋白表达结果Fig.6 Expression result of soluble protein in supernatant at 16 ℃
2.5 重组蛋白的Western-blot分析
结果如图7所示,在27 ku可见目的条带,与预期大小一致,表明重组蛋白能与NS4多克隆抗体产生特异性反应。

图7 表达产物Western blot分析Fig.7 Western blot analysis of expression products
3 讨论
NS4在BTV 感染后2 h即可在胞质中被检测到,感染后24 h在胞质与胞核内形成小点状聚集,通过核纤维蛋白与核仁标记物B23共定位于核仁,感染后72 h 出现于胞膜[10-11]。此外,NS4能保护dsDNA 不被脱氧核糖核酸酶Ⅰ降解,但缺乏dsRNA 结合域而无法保护dsRNA 被RNAseⅢ降解[10]。研究表明,NS4在IFN 预处理的细胞中可促进BTV-8的CPE 与复制,是胞内干扰素通路的拮抗剂与毒力因子,显著降低IFN-β与ISGs等转录水平以及与天然免疫相关的IRSE等启动子活性;且能与NS3共同作用于STAT1的SH2结构域,抑制其磷酸化、核易位以及与STAT2 的作用从而抑制JAK-STAT 通路下游基因的激活[11-12,13]。综上所述,NS4作为蓝舌病病毒发现的新型非结构蛋白之一,在BTV复制与拮抗宿主天然免疫应答中发挥重要作用,因此,对NS4蛋白的深入研究具有重要意义,可能为阐明BTV 的致病机制提供新的方向。
基于BTV NS4在病毒复制及拮抗宿主天然免疫应答中的重要作用,在本研究中,笔者构建了BTVNS4基因原核表达载体,并对其在大肠杆菌BL21中以IPTG 诱导表达的最佳条件进行了分析与探索。韩珊等[14]对超氧化物歧化酶在大肠杆菌BL21 中诱导的最适IPTG 浓度为0.4 mmol/L;Carmignotto等[15]对重组Cas9 蛋白在大肠杆菌BL21中诱导的最适IPTG 浓度为0.5 mmol/L;荣娜等[16]对重组嗜水气单胞菌外膜蛋白P5在大肠杆菌BL21中诱导的最适IPTG 浓度为0.5 mmol/L;Aghaiypour等[17]对重组破伤风毒素C 蛋白在大肠杆菌BL21 中诱导的最适IPTG 浓度为1.0 mmol/L,有鉴于上述研究,本研究首先在0.6 mmol/L IPTG 诱导,得到最佳诱导时间为6 h;再设置IPTG 诱导浓度梯度为0.2、0.4、0.6、0.8、1.0 mmol/L 组,得到最佳诱导浓度为0.8 mmol/L 后,再次分别进行4 h、6 h、8 h时取样检测以验证,确保结果真实可靠,且保证重组蛋白表达量达到最大的前提下,选择合适的IPTG 诱导浓度与时间。而Belhouchet构建p GEX-BTV NS4重组质粒,使用0.5 mmol/L的IPTG 在37 ℃诱导4 h或在28℃诱导8 h,这可能与所使用的构建载体不同有关[10]。
研究表明,诱导温度有利于蛋白合成的速度,但也增加了无活性蛋白集聚物的疏水作用而使得到的重组蛋白在大肠杆菌中易形成不溶性蛋白聚集体,即包涵体[18]。低温诱导时有利于蛋白质结构折叠,从而形成可溶性蛋白[19]。本研究中,p ET-32a-NS4原核表达载体37 ℃诱导表达的重组蛋白主要以包涵体的形式表达,16 ℃时可溶性蛋白含量较低无法满足试验需求。Belhouchet构建的p GEX-BTV NS4在大肠杆菌BL21中同样以包涵体形式存在,但p MAL-c5x-NS4载体在大肠杆菌中表达可溶性的NS4 重组蛋白[10,20]。本研究构建的p ET-32a-NS4原核表达载体可获得大量的NS4 重组蛋白,Western-blot分析表明,该重组蛋白能与NS4蛋白的兔多克隆抗体发生特异性反应。研究表明,包涵体蛋白经变性、复性等方法重新折叠,得到可溶性的蛋白,以使该蛋白能够得到更高效的应用[21-22]。本研究中表达的NS4重组蛋白为后续BTV 拮抗宿主天然免疫反应中作用机制研究提供基础材料。
4 结论
本研究成功构建蓝舌病病毒NS4基因p ET-32a-NS4原核表达载体;p ET-32a-NS4在大肠杆菌BL21 中IPTG 的最佳诱导浓度为0.8 mmol/L,诱导时间为6 h;重组蛋白主要以包涵体形式表达,为进一步研究NS4功能提供材料。
——一道江苏高考题的奥秘解读和拓展

