肝细胞癌中索拉非尼耐药性机制的研究进展
杜若昕,郭欣燕(综述),张 伟,芦希艳(审校)
(1.中国人民解放军空军军医大学药学系生物制药学教研室,陕西 西安 710032;2.中国人民解放军空军军医大学第二附属医院门诊部,陕西 西安 710038)
肝细胞癌(hepatocellular carcinoma,HCC)是全球癌症相关死亡的第二大原因,通常与病毒感染、过度饮酒或代谢综合征导致的慢性肝炎密切相关。索拉非尼(Sorafenib)是被美国食品药品局批准的用于治疗晚期HCC的一线药物,其作为多靶点酪氨酸激酶抑制剂表现出抗肿瘤细胞增殖和抗血管生成的作用[1]。然而,仅约30%的HCC患者可从索拉非尼治疗中获益,且这部分患者通常在6个月内就出现复发耐药[2]。表观遗传学、细胞转运过程以及调节性细胞死亡均能介导HCC索拉非尼耐药并发挥关键作用。本研究归纳总结了近年在索拉非尼耐药研究方面取得的进展,为探索克服耐药性的新方法奠定了理论基础。
1 表观遗传调控与HCC索拉非尼耐药
表观遗传修饰可以在不改变DNA序列的情况下改变基因的表达状态,并且有些修饰是可遗传的。在某些情况下,表观遗传变化是动态的,会对环境刺激作出反应。表观遗传机制调节生物体内发生的不同生理过程,包括细胞增殖和分化。因此,更深入地了解与HCC相关的表观遗传修饰可以为开发治疗该疾病的创新方法奠定理论基础。在此背景下,将描述不同类型的表观遗传机制及其与HCC索拉非尼耐药的关系。
1.1甲基化 甲基化是指将甲基从活性甲基化合物(如 S-腺苷甲硫氨酸)催化转移到其他化合物的过程,常见的例子包括RNA甲基化、组蛋白甲基化和DNA甲基化。异常甲基化导致基因表达发生改变,从而导致癌变。使用医疗芯片技术在经过索拉非尼处理的HA22T/VGH细胞中发现了1 230个存在甲基化差异的基因[3]。据报道,MORC家族CW型锌指结构蛋白2(microrchidia family CW-type zinc finger 2,MORC2)作为Hippo通路的调节因子对于维持HCC细胞在体外和裸鼠体内的自我更新、索拉非尼耐药性和致癌性至关重要[4]。生理条件下,神经纤维素2(neurofibromin 2,NF2)和肾脏脑蛋白(kidney and brain protein,KIBRA)作为Hippo通路中的上游分子参与抑制细胞生长。病理条件下,MORC2在NF2和KIBRA的启动子处与DNA甲基转移酶3A(DNA methyltransferase 3A,DNMT3A)结合形成复合物,导致两者DNA超甲基化并伴随转录抑制,从而解除Hippo通路对HCC细胞生长的抑制作用并增强HCC细胞索拉非尼耐药性[4]。同时,长链非编码RNA(long non-coding RNA,lncRNA) H19作为肿瘤研究领域的明星分子,其表达明显受到表观遗传的控制,尤其是受到启动子甲基化的调节[5]。在所有六种建立的索拉非尼耐药HCC细胞中,H19的表达均显著下调。过表达H19可以显著提高耐药细胞对索拉非尼的敏感性,表明H19过表达可逆转HCC索拉非尼耐药。然而,也有研究发现,与索拉非尼敏感HCC组织相比,耐药HCC中H19启动子甲基化程度显著降低。虽然降低的启动子甲基化通常被认为与升高的基因表达相关,但此项研究中大量数据表明启动子甲基化的减少与基因表达减少相关。因此,H19作为未来克服HCC索拉非尼耐药性的潜在靶点,其表达与启动子甲基化之间的关系应进行进一步的研究以阐明[5]。总之,这些证据表明索拉非尼可能会影响HCC中癌症相关基因的甲基化水平,这对于追踪索拉非尼耐药性很有价值。
1.2基于非编码RNA的机制 越来越多的证据表明,非编码RNA(noncoding RNA,ncRNA),包括lncRNA和微小RNA(microRNA,miRNA),对于HCC中索拉非尼耐药性的发展至关重要。lncRNA 小核仁RNA宿主基因3(small nucleolar RNA host gene 3,SNHG3)在高转移性HCC细胞中的表达显著高于低转移性HCC细胞,并通过调节miR-128/CD151信号轴,诱导上皮-间充质转化(epithelial-mesenchymal transition,EMT)进而导致HCC索拉非尼耐药。据报道,lncRNA 小核仁RNA宿主基因16(small nucleolar RNA host gene 16,SNHG16)在HepG2索拉非尼耐药细胞中表达上调,并且体外和体内实验都证实敲低SNHG16可增加HepG2索拉非尼耐药细胞对索拉非尼的敏感性,进一步的机制研究表明,在HepG2细胞中,SNHG16可能通过吸附HCC细胞内miR-140-5p导致索拉非尼耐药[6]。miR-591的过表达可抑制远端上游元件结合蛋白2(far upstream elemental binding protein 2,FBP2)所介导的PI3K/AKT/mTOR信号通路激活,从而抑制HCC细胞的耐药性,包括索拉非尼耐药性[7]。另外,miR-622过表达能够特异性抑制鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS)基因表达,导致细胞内Raf/ERK和PI3K/AKT通路受抑制并使索拉非尼耐药细胞重新恢复对索拉非尼的敏感性[8]。这些研究提示,靶向ncRNAs可能代表一种克服HCC中索拉非尼耐药性的一种治疗方法。然而,许多ncRNAs在癌症进展中失调。因此需要进一步的研究来确定ncRNA在肿瘤进展中是驱动因素还是中间媒介物。此外,目前的研究仅关注lncRNAs作为miRNA的内源性互补物在调节靶基因表达和介导HCC索拉非尼耐药性的作用。以往的研究表明,lncRNAs还可通过更多的机制发挥作用,例如与蛋白质结合来调节蛋白质翻译、干扰编码相邻蛋白质的基因表达、与蛋白质形成复合物来调节基因转录等,这些都是需要进一步探索的领域[9-10]。
2 细胞转运过程与HCC索拉非尼耐药
索拉非尼耐药同样与ATP结合盒式(ATP binding cassette,ABC)转运蛋白相关,后者通过将药物从癌细胞中转移出去以降低药物的有效浓度,导致耐药[11]。另一方面,外泌体是细胞间信息交互的载体和肿瘤微环境的调节剂。在正常细胞中,外泌体能够通过运输转移细胞内的生物分子,但这种机制可能在癌细胞中被挟持利用[12-13]。因此,将回顾具体的细胞转运过程与HCC索拉非尼耐药的机制。
2.1ABC转运蛋白 包括索拉非尼在内的几种多靶点酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)与ABC转运蛋白之间的关系已被证实[11]。细胞转运过程中,TKI药物作为ABC转运蛋白的底物从HCC细胞中转移出去,以降低细胞内药物浓度并导致耐药。其转运效率取决于特定的转运蛋白表达、联合治疗的药物类型、TKI对转运蛋白的亲和力及其浓度。研究发现,CRYO(许多精油的天然倍半萜成分)在无毒剂量下可以抑制ABC转运蛋白功能,导致索拉非尼在HCC细胞中蓄积并提高HCC细胞对索拉非尼的敏感度[14];同时CRYO能够抑制索拉非尼的降解,促进其在细胞内积累,最终加强索拉非尼对癌细胞杀伤力。另一项研究报道了COP9信号复合体5(COP9 signalosome 5,CSN5)与HCC索拉非尼耐药性的关系。下调细胞中CSN5表达,导致细胞内几种药物外排蛋白的表达显著下降,索拉非尼在细胞内蓄积,最终逆转索拉非尼耐药。
2.2外泌体 外泌体是一种胞外囊泡(extracellular vesicles,EV),负责细胞间信息交流,现今已成为治疗靶点[15-16]。HCC细胞来源的外泌体将某些关键的miRNA、lncRNA和蛋白质转移至肿瘤微环境的受体细胞,主要包括上皮细胞、巨噬细胞、内皮细胞和成纤维细胞,通过改变受体细胞生物学行为实现炎症细胞浸润、血管生成、获得肿瘤相关细胞表型以及HCC细胞索拉非尼耐药性[12-13]。其中,HCC细胞释放携带miR-221-3p的外泌体(miR-221-3p-exo)并传递至人淋巴管内皮细胞(human lymphatic endothelial cells,HLEC),通过显著降低血管/淋巴管抑制蛋白(vasohibin-1,VASH1)的表达激活ERK/AKT信号通路、促进HCC中淋巴管生成以及介导索拉非尼耐药。同时,HCC细胞释放携带miR-142-3p的外泌体(miR-142-3p-exo)并传递至肝脏内皮细胞,通过抑制内皮细胞中TGFβR1的表达促进血管生成并介导索拉非尼耐药。由于外泌体可有效地实现胞间交流,因此可以将外泌体用作一种治疗策略,比如在外泌体中装载功能蛋白、ncRNA和化疗药物等治疗剂。考虑到miR-122可以抑制HCC细胞的致瘤特性并逆转索拉非尼耐药性,使用载体装载miR-122递送可能代表一种有前景的HCC治疗方法。miR-122转染的脂肪组织间充质干细胞(adipose tissue mesenchymal stem cells,AMSCs)已被证明可以有效地将miR-122包装在其释放的外泌体中。同时,体内实验表明在肿瘤内注射携带miR-122的外泌体(miR-122-exo)可通过显著提高索拉非尼治疗HCC的抗肿瘤性能逆转耐药性。
3 调节性细胞死亡(regulated cell death,RCD)与HCC索拉非尼耐药
RCD用于描述当其他适应性反应无法恢复细胞内稳态时,细胞通过相应分子机制调节死亡。根据其分子机制的不同,RCD可分为不同的类别,包括细胞凋亡、自噬性细胞死亡、细胞坏死和铁死亡等[17]。据报道,RCD,尤其是自噬和铁死亡,与HCC的索拉非尼耐药性有关。
3.1细胞自噬 自噬是真核生物细胞内物质周转的重要过程,这是一种溶酶体降解途径,用于分解细胞内受损的蛋白质和细胞器。自噬在癌细胞中发挥的作用是一把双刃剑。正常情况以及在HCC发展的初期阶段,细胞自噬是维持正常细胞基因组稳定性的癌症抑制因子;而在晚期HCC中,肿瘤细胞通过自噬募集能量,提高在缺氧和低营养环境下的存活能力。同时,自噬也被认为是介导索拉非尼耐药的重要因素,因为可以支持HCC细胞在治疗中和代谢压力下的存活,与细胞自噬相关的信号通路显示,索拉非尼可通过非mTOR依赖和mTOR依赖两种方式激活不同的信号通路实现对自噬的双向调节(图1)。研究表明,多种自噬相关基因与HCC细胞索拉非尼耐药密切相关,如自噬相关基因7(autophagy-related gene-7,ATG7)的表达上调是产生保护性自噬的标志之一,并且在该基因被敲除后HCC细胞对索拉非尼的敏感度得以恢复。进一步的研究表明,索拉非尼可通过非mTOR依赖和mTOR依赖两种方式实现对自噬的双向调节。索拉非尼通过诱导非mTOR依赖的内质网应激激活保护性自噬并介导HCC耐药;然而持续性治疗可激活由FBP2介导的PI3K/AKT/mTOR信号通路,其中mTOR是自噬的负调控因子。因此,特异性抑制AKT可以解除mTOR对自噬的负调控作用,从而通过将保护性自噬转换为自噬性细胞死亡来逆转索拉非尼耐药。以上证据表明,保护性自噬是HCC细胞介导索拉非尼耐药的重要因素,逆转耐药性可以通过抑制自噬使其无法实现细胞保护的目的或者进一步提升自噬水平达到自噬性细胞死亡这2种方法。
3.2铁死亡 铁死亡是最近发现的一种非细胞凋亡的RCD过程,涉及铁离子介导的脂质氧化物的异常累积,造成细胞死亡。在这个过程中,各种诱导剂打破细胞氧化还原平衡,产生大量脂质过氧化产物,从而引发细胞死亡。越来越多的研究表明,索拉非尼可在不同的癌细胞系中诱导铁死亡,同时铁死亡又与索拉非尼耐药机制密切相关,导致铁死亡的关键因素是铁离子介导的脂质氧化物的异常累积,该图显示了调节铁离子和脂质过氧化的相关途径(图2)[18]。最近的一项研究报道称,应用铁螯合剂去铁胺(deferoxamine,DFO)螯合细胞内不稳定铁离子可显著保护HCC细胞免受索拉非尼的细胞毒性作用。同时,研究发现DFO并不会阻止索拉非尼靶向细胞内激酶。相反,螯合细胞内不稳定铁离子进一步阻止了索拉非尼在HCC细胞中诱导氧化应激。另一方面,金属硫蛋白(metallothionein,MT-1G)通过抑制铁死亡促进索拉非尼耐药,是HCC中索拉非尼耐药性的关键调节剂和有希望的治疗靶点。索拉非尼可通过诱发氧化应激促使HCC细胞MT-1G基因高表达,通过对比接受索拉非尼治疗的晚期HCC患者血清中的MT-1G浓度,发现MT-1G高表达的HCC患者接受索拉非尼治疗多预后不良,提示MT-1G也可以作为晚期HCC患者接受索拉非尼治疗的潜在预后指标,敲低MT-1G的表达会增加细胞内谷胱甘肽消耗和脂质过氧化,有助于增强索拉非尼诱导的铁死亡。总之,索拉非尼介导的HCC细胞铁死亡是不依赖于其介导激酶的抑制作用,甚至是其发挥抗肿瘤作用的主要方式。
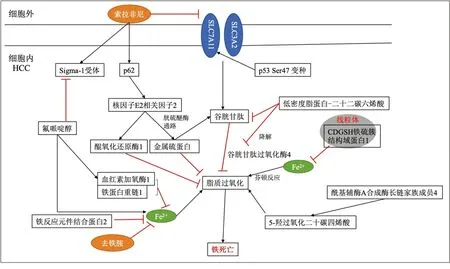
图2 铁死亡与索拉非尼耐药的机制
4 总结与展望
HCC在早期即可表现出对系统性索拉非尼治疗的耐药性。为了增强索拉非尼诱导的抗肿瘤作用,迫切需要了解其潜在机制并确定治疗靶点。本研究全面归纳了可能共同促进HCC对索拉非尼耐药的分子及细胞机制。表观遗传学、细胞转运过程以及调节性细胞死亡均能介导HCC索拉非尼耐药,并在其中发挥关键作用。为了保持索拉非尼对HCC的疗效,需要进一步研究针对初始或获得性耐药性的治疗方法。
——外泌体与老年慢性疾病相关性的研究进展

