Smad3通过p38/MAPK信号通路调控细胞自噬及凋亡促进胰腺癌进程
张旭东,刘浩昂,王志浩,兰 凯,陈 蕊,李 凯,刘树义,Rajiv Kumar JHA 700 西安,西安医学院临床医学院中尼友好拉吉姆医学实验室;70077 西安,西安医学院第一附属医院妇产科
胰腺癌(pancreatic cancer)发病率逐年增加,位列所有癌症致死原因第5位,是一种恶性程度极高的消化系统肿瘤。由于早期无明显症状、疾病进展快及化疗有效率低,患者预后极差,总体5年生存率仅有8%,又将其称为“癌中之王”[1]。胰腺癌治疗目前主要采取手术为主,并辅助放、化疗的综合治疗手段,但90%的胰腺癌患者经指南推荐的治疗后效果欠佳[2]。因此,深入阐明胰腺癌的发生机制结合分子靶向干预和放化疗,是提高胰腺癌疗效的重要手段[3]。Smad3是重要的细胞内分子,负责将细胞质膜受体信号传至细胞核[4-5]。Smad3作为重要的转录因子,是转移生长因子β(transforming growth factor β, TGF-β)下游的重要靶点。在细胞增殖[6]、损伤修复[7]、纤维化[8]、癌症发展等方面发挥着重要作用[9-10]。在肝癌后期Smad3通过诱导上皮-间质转化促进肿瘤转移[11],然而Smad3在胰腺癌发生、发展中的作用目前仍不清楚。
分裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)可将细胞外信息传递至细胞核中,在生理及病理过程中发挥重要的作用。其中p38是重要的应激激酶,能对外界刺激迅速做出反应[12]。p38在体内有α、β、γ 和 δ 4种亚型,且胰腺癌细胞均表达p38的4种亚型。研究发现降低胰腺癌细胞中p38 α和p38 β的表达能够抑制胰腺癌细胞的体外生长,同时发现p38 α能促进胰腺癌的迁移,而p38 β对胰腺癌的迁移无明显调控作用,由此可见p38/MAPK在胰腺癌中发挥亚型特异性功能[13]。此外,胰腺癌细胞分泌外泌体被T淋巴细胞摄取后激活p38/MAPK信号通路,进而诱导内质网应激介导细胞凋亡,促进胰腺癌发生、发展[14]。
自噬在生物体高度保守是维持机体稳态的重要机制[15-16],依赖溶酶体对细胞组分的降解以维持逆境条件下机体的代谢平衡。自噬异常与胰腺癌等众多肿瘤的发生、发展密切相关[17]。早期研究表明,利用遗传和药理抑制自噬会导致活性氧(reactive oxygen species, ROS)产生,增加DNA损伤和代谢功能障碍,最终抑制胰腺癌的发展[18]。此外,自噬还可以通过降解MHC-I促进胰腺癌的免疫逃避,表明自噬增加有助于胰腺癌的进展[19]。
p38/MAPK信号通路不仅对自噬具有促进和抑制的双重性调控[20],而且也是细胞凋亡的主要调控通路之一。胰腺癌细胞对细胞凋亡有抵抗力,从而促进其侵袭性和对常规治疗方式的抵抗力[21]。因此,靶向细胞凋亡途径是胰腺癌治疗的新思路。在生物体内细胞自噬与凋亡过程存在十分复杂的相互作用关系,过度自噬会诱导细胞凋亡。本研究通过干预Smad3的表达初步探讨Smad3对胰腺癌细胞Panc-1、BxPC-3自噬和凋亡的影响机制,进而初步验证Smad3表达水平在人胰腺癌诊断和进展中的价值;同时探究Smad3对胰腺癌细胞自噬的调控能力,以期为胰腺癌的治疗提供新的靶点和理论依据。
1 材料与方法
1.1 细胞、标本及试剂
人的胰腺癌细胞系Panc-1、AsPC-1、BxPC-3购自美国ATCC细胞库(American Type Culture Collection);胰腺正常导管上皮细胞HPDE购自武汉普诺赛公司。对照和胰腺癌患者组织标本来自2015-2020年西安医学院第一附属医院和咸阳人民医院。标本获取经捐赠者或亲属的书面知情同意,研究获得西安医学院第一附属医院伦理委员会的批准(XYL2022122)。主要试剂:胎牛血清、DMEM细胞培养基、胰蛋白酶购自HyClone公司;LipofectamineTM2000购自美国英杰生命技术有限公司;总蛋白提取试剂盒、PI-Annexin-V试剂盒购自碧云天生物技术有限公司;抗体Smad3、p-Smad3购自爱博泰克生物有限公司;GAPDH购自康成生物技术有限公司;p-p38、p38、LC3、p62购自美国Cell Signaling Technology公司;SB203580购自北京索莱宝科技有限公司;辣根过氧化物酶标记的山羊抗小鼠二抗购自美国Sigma公司;DAB检测试剂盒购自中杉金桥公司。对照组(Sh-Scramble)病毒及Smad3敲减序列(Sh-Smad3、CRISPR/Cas9-Smad3)由擎科生物公司合成,见表1。

表1 shSmad3、CRISPR/Cas9-Smad3与shScramble序列
1.2 生物信息学分析
利用GEPIA2数据库(http: //gepia.cancer - pku.cn/)对Smad3在胰腺正常组织(n=171)及癌组织(n=179)中的表达差异和存活相关性进行统计学分析。
1.3 免疫组化
将临床标本组织切片放置60 ℃ 烘箱烘片1 h,将切片放入环保透明剂中脱蜡2次,每次20 min。之后依次放入100%、95%、70%、50%乙醇中各水化5 min,去离子水中浸泡5~10 min后置于10 mmol/L pH 6.0 柠檬酸-柠檬酸钠缓冲溶液中抗原修复3.5 min,室温自然冷却。PBS中浸泡5~10 min,3% H2O2室温放置10 min,0.1% TX-100室温孵育10 min,PBS洗2~3次,每次5 min,3% BSA室温封闭1 h。一抗Smad3(1∶500)溶于 1% BSA,4 ℃ 过夜。1×PBS 洗4次,每次5 min,二抗室温孵育1 h。PBS 洗4次,每次5 min,DAB显色后,苏木精复染3~5 min后自来水充分冲洗显色。1% HCl(75% 乙醇中)水化5 s,自来水冲洗3~5 min,95%、100%乙醇各脱水5 min,最后用中性树胶封片保存。
1.4 细胞培养及分组
胰腺癌细胞株Panc-1、BxPC-3生长于37 ℃、5% CO2以及饱和湿度的恒温培养箱中。细胞培养使用含10% FBS、1%双抗(链霉素、青霉素)的完全培养基,2 d进行一次传代。敲减实验分为对照组(Scr)和Smad3敲减组(ShSmad3-1、ShSmad3-2组:细胞分别转染ShSmad3-1、ShSmad3-2慢病毒);敲除实验分为空白对照组(WT)和Smad3敲除组(Smad3 KO-1、Smad3 KO-2组:Panc-1细胞分别转入CRISPR/Cas9-Smad3质粒,经嘌呤霉素筛选后的单克隆细胞系1#、2#)。回复实验在敲减实验3组基础上再加入25、50 μmol/L羟氯喹(HCQ);过表达实验在敲减实验3组基础上再加入外源过表达Smad3(pLVX- Smad3);抑制实验在敲减实验3组基础上再加入p38抑制剂SB203580 20 μmol/L(SB203580)。处理细胞48 h后,收集各组细胞进行相关检测。
1.5 病毒包装
当293T细胞生长至60%~70%时进行转染。将PMD2.G、PSPAX2、pLKO.1 sh-Smad3 按1∶1∶1各8 μg及60 μL转染试剂PEI加入750 μL DMEM培养基(不含血清、双抗),混合均匀,室温放置20 min后加入293T细胞转染4~6 h,换新鲜完全培养基,继续培养48 h可收集培养基上清,1 500×g离心10 min,取上清,再用0.45 μm 滤膜过滤,所得液体即为包装后病毒。
1.6 慢病毒感染
BxPC-3细胞在6孔板中长到融合度为50%~60%时,按培养基与病毒液体积比1∶1进行加液,同时加入1 μL (2 000×) polybrene混匀。2 d后,加入1.5 μg/mL嘌呤霉素筛选2 d,收样进行检测。
1.7 CRISPR/Cas9、ShSmad3质粒构建及CRISPR/Cas9-Smad3敲除细胞的筛选
将合成的gRNA及ShRNA正义链与反义链进行退火,退火产物与经过双酶切的pLKO.1(EcoRⅠ、AgeⅠ)、PX459(BbsⅠ)载体进行连接,小提质粒,并经测序验证。
将构建好的针对Smad3基因的CRISPR/Cas9敲除质粒纯化后转入胰腺癌细胞(Panc-1)中。经过稳定筛选挑单克隆,并通过提取基因组DNA和Western blot确定其表达情况。经过鉴定筛选2个独立的细胞系用于后续实验。基因组PCR上游引物序列:5′-GCCTTC-AATATGAAGAAGGAC-3′,下游引物序列:5′-CATTCG-GGTCAACTGGTA-3′。
1.8 细胞计数
将生长良好的105个细胞铺在6孔板上,分别在生长0、3、5 d用血球计数板进行细胞计数,并用结晶紫进行染色。
1.9 蛋白提取及Western blot 检测
收好的细胞加入含有蛋白酶抑制剂的裂解溶液Lysis Buffer (DTT、mG132、Cocktail、DTT、PhosSTOP)置于冰上,每隔5 min剧烈涡旋1次,共裂解20 min后,12 500×g、4 ℃离心5 min,取上清进行BCA蛋白定量,加入对应体积的蛋白上样缓冲液(5×Loading buffer),95 ℃加热 5 min后进行蛋白电泳。10% SDS-PAGE电泳分离,转移至PVDF膜(使用前用甲醇浸泡激活30 s),用含5%脱脂奶粉的PBST摇床封闭1 h。加入一抗p-p38、p38、LC3、p62(1∶1 000)、Smad、p-Smad3(1∶1 000)、GAPDH(1∶10 000),4 ℃孵育过夜,PBST洗膜4次,每次5 min,室温孵育二抗1 h,PBST洗膜4次,每次5 min,用ECL法发光后胶片曝光。
1.10 PI-Annexin V染色
BxPC3、Panc-1胰腺癌细胞用PBS洗涤2次,用不含EDTA的胰酶进行完全消化,1 000×g离心5 min,弃上清收集细胞,并用PBS轻轻重悬细胞计数,然后再1 000×g离心5 min,加入195 μL Annexin V-FITC结合液轻轻重悬细胞,加入5 μL Annexin V-FITC轻轻混匀,加入10 μL碘化丙啶染色液(PI),然后在室温下避光孵育15 min,最后通过流式细胞仪检测分析。
1.11 统计学分析
2 结果
2.1 Smad3蛋白表达与胰腺癌的关系
GEPIA2数据库分析结果显示,与正常胰腺组织相比,Smad3在胰腺癌组织中高表达(P<0.05,图1A),同时在胰腺癌不同分期Smad3的表达差异有统计学意义(P=0.003 22,图1B)。进一步将胰腺癌患者分为Smad3高表达组(n=45)和Smad3低表达组(n=45),通过生存分析发现Smad3的表达与胰腺癌患者的生存率呈负相关(P=0.006 1,图1C)。利用临床病理标本进行免疫组化染色,发现Smad3在胰腺癌组织中高表达(图1D)。

A:GEPIA2数据库分析胰腺癌组织与正常组织中Smad3的表达 a:P<0.05;B:GEPIA2数据库分析胰腺癌不同分期中Smad3的表达差异;C:Smad3表达与患者生存的相关性;D:免疫组化检测Smad3在胰腺病理切片中的表达
2.2 胰腺癌细胞系中Smad3的表达
收集胰腺正常导管上皮细胞HPDE、胰腺癌细胞BxPC-3、AsPC-1、Panc-1。通过Western blot检测Smad3的表达情况。与胰腺正常导管上皮细胞相比,Smad3在胰腺癌细胞BxPC-3、Panc-1中表达较高(图2)。因此,后续实验选择这2个细胞系进行。
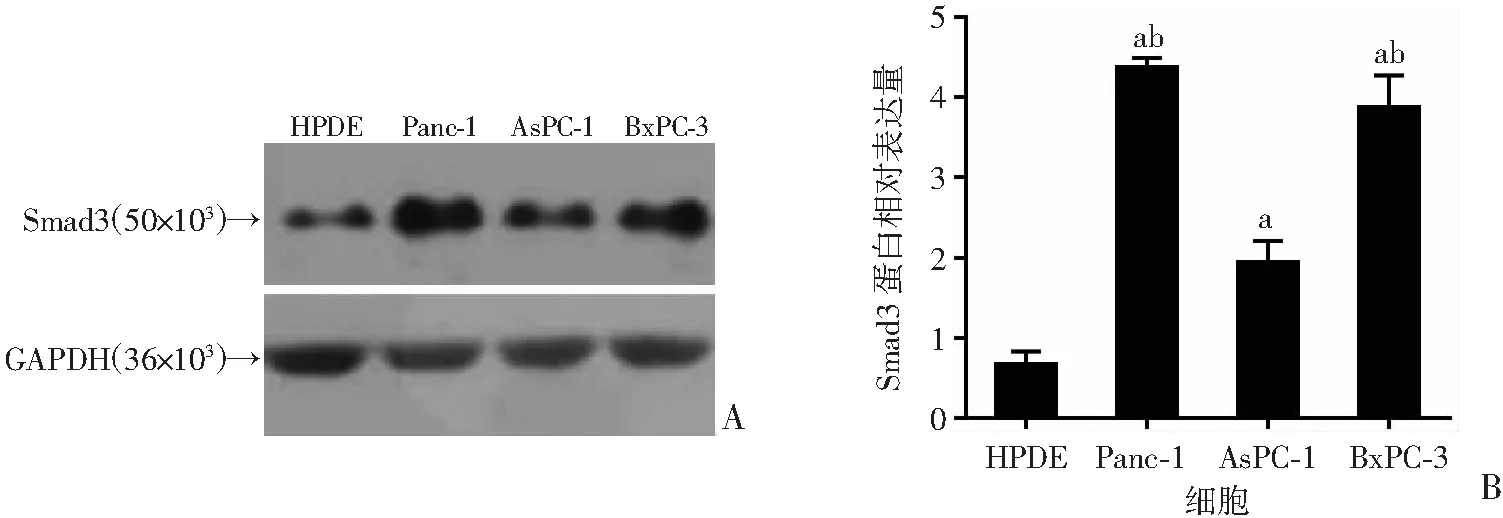
A:Western blot检测Smad3的表达;B:半定量分析 a:P<0.05,与HPDE比较;b:P<0.05,与AsPC -1比较
2.3 胰腺癌细胞系BxPC-3、Panc-1中敲除(敲减)Smad3
分别利用ShRNA以及CRISPR/Cas9两种不同的体系干预Smad3的表达。BxPC-3细胞中转入ShSmad3-1、ShSmad3-2慢病毒72 h后,qPCR检测结果显示Smad3 mRNA水平下调明显(P<0.05,图3A),同时利用Western blot从蛋白水平进行验证,发现2个ShRNA的敲减效果较好(图3B)。进一步在Panc-1细胞中转入CRISPR/Cas9-Smad3质粒经嘌呤霉素筛选后挑取单克隆。利用Western blot和测序进行验证,发现单克隆细胞系1#、2#敲除较好(图3C、D),可以用于后续实验。
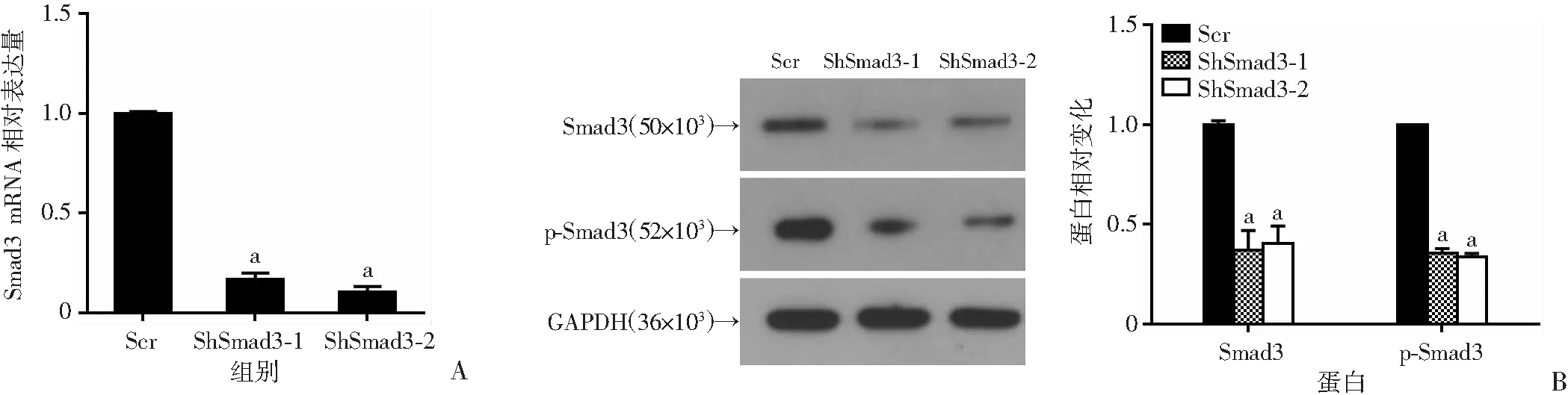
Scr:对照组;ShSmad3-1、ShSmad3-2:Smad3敲减组;a:P<0.05,与对照组(Scr)比较
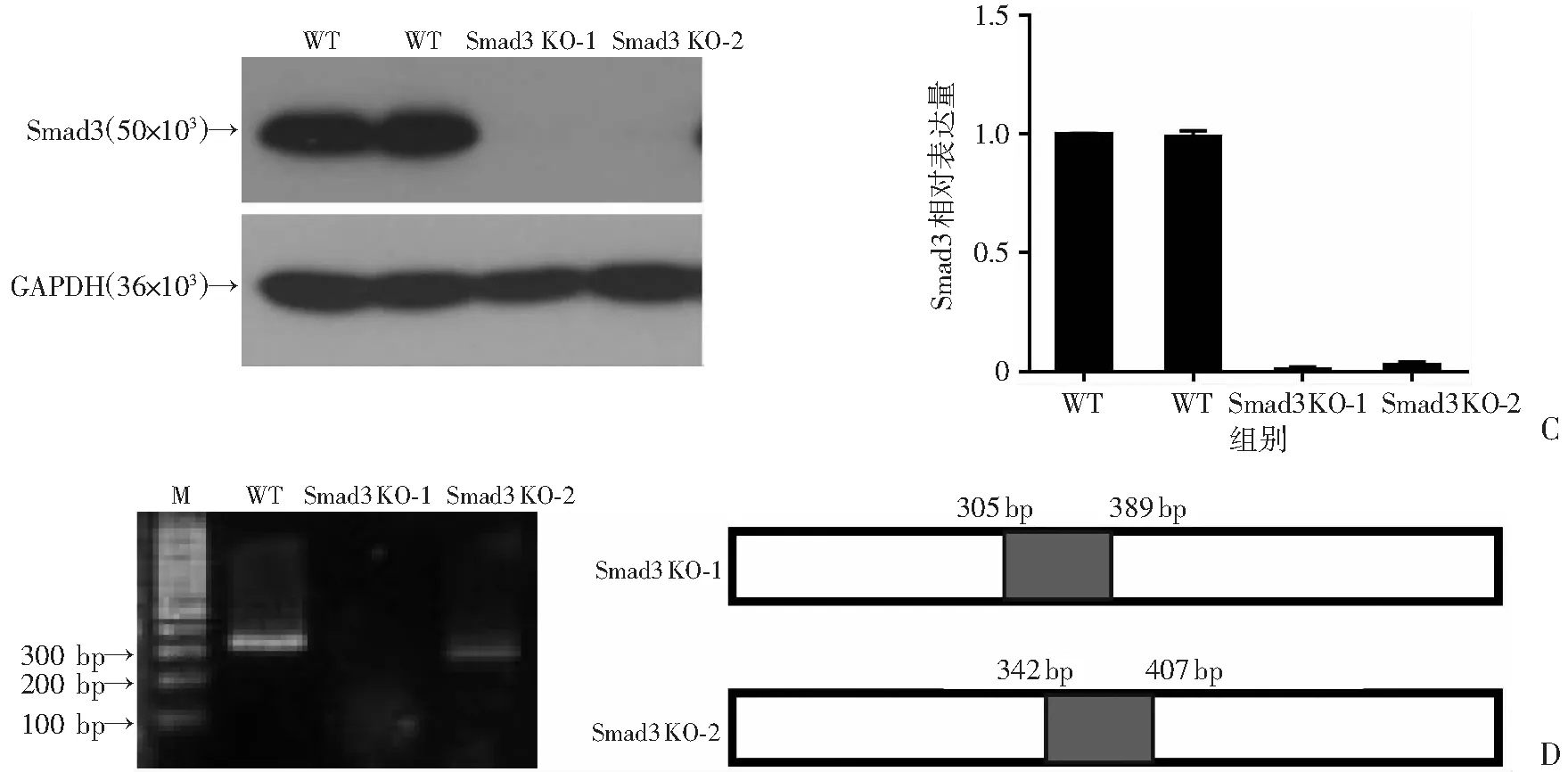
WT:空白对照组;Smad3-KO:Smad3敲除组;M:标准
2.4 在胰腺癌细胞中敲减Smad3影响细胞凋亡
利用构建好的Smad3敲减BxPC-3稳转细胞系铺板(105个细胞)绘制细胞的生长曲线(图4A),并进行结晶紫染色(图4B)。敲减Smad3后,胰腺癌细胞BxPC-3、Panc-1的数目均显著减少。同时利用Smad3敲减的Panc-1、BxPC-3细胞进行PI-Annexin V标记并进行流式分析,发现敲减Smad3后凋亡细胞显著增加(P<0.05,图4C),提示Smad3对胰腺癌的发生发展至关重要。
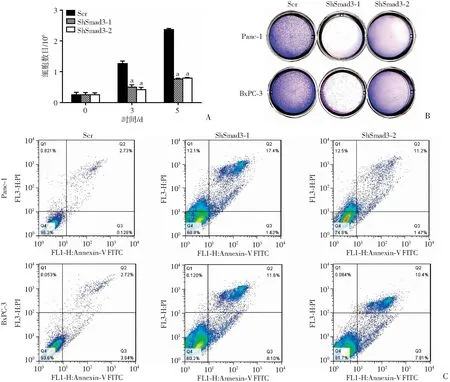
A:敲减Smad3后各组胰腺癌细胞计数分析 a:P<0.05,与对照组(Scr)比较;B:结晶紫染色观察敲减Smad3后各组胰腺癌细胞生长情况;C:流式细胞仪检测敲减Smad3后胰腺癌细胞的凋亡情况
2.5 敲除(敲减)Smad3后自噬蛋白LC3、p62蛋白水平降低
在敲除、敲减Smad3的Panc-1细胞中,LC3、p62均显著下调(图5A、B)。同时在BxPC-3细胞中利用shRNA敲减Smad3后加入25、50 μmol/L羟氯喹(HCQ),利用Western blot检测发现LC3、p62蛋白水平能回复(图5C)。进一步说明降低Smad3的表达影响胰腺癌细胞的自噬过程。
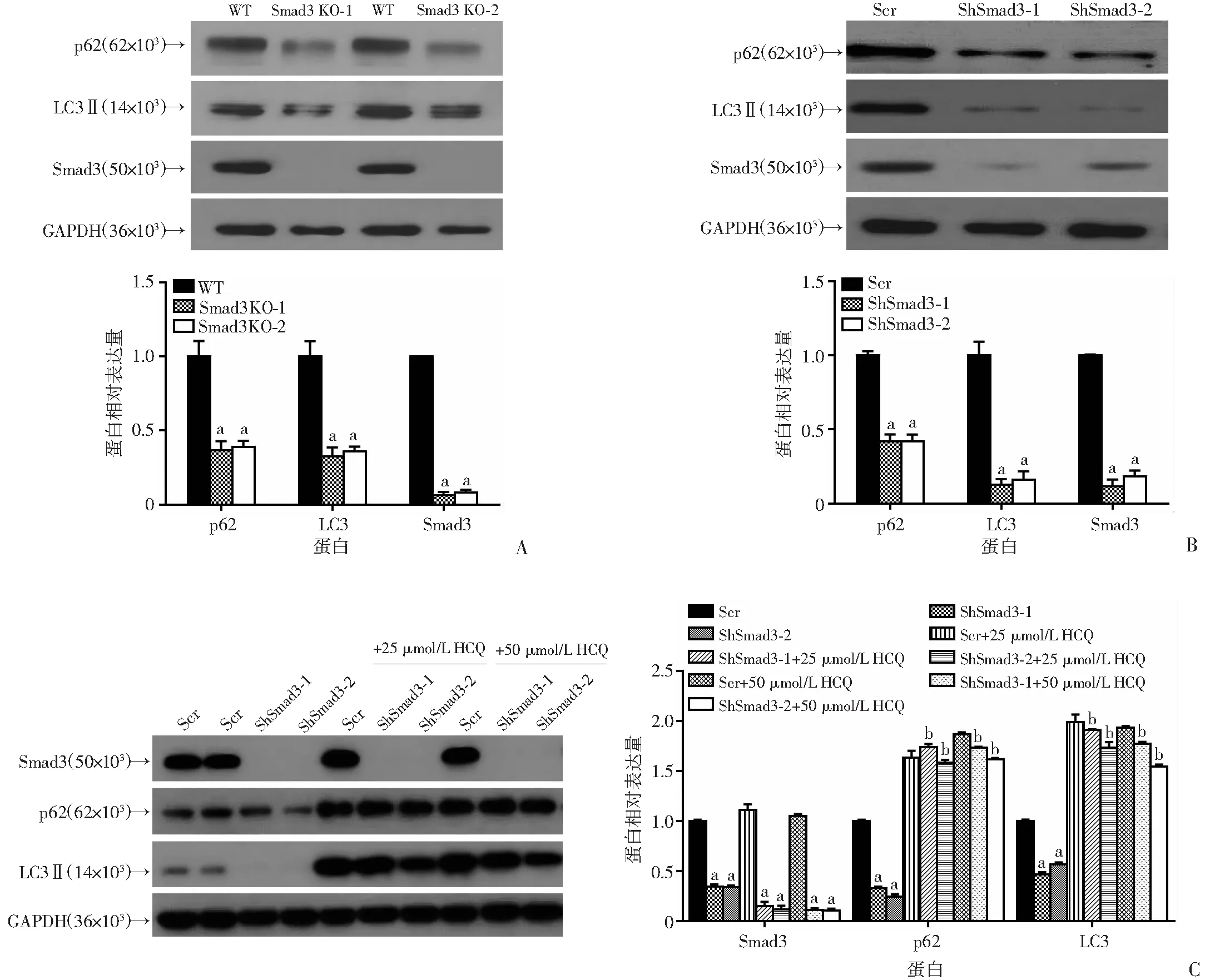
WT:空白对照组;Scr:对照组;Smad3 KO-1、Smad3 KO-2:Smad3敲除组;ShSmad3-1、ShSmad3-2:Smad3敲减组;a:P<0.01,与对照组比较;b:P<0.01,与Smad3敲减组比较
2.6 敲除(敲减)Smad3后通过p38/MAPK通路影响细胞凋亡
Western blot检测结果显示,与对照组相比,在敲减Smad3的BxPC-3细胞中p-p38显著上调(P<0.05,图6A),同时在敲除Smad3的胰腺癌细胞中p-p38蛋白水平也升高(P<0.05,图6B)。为了进一步证明Smad3通过p38通路调控自噬诱导细胞凋亡进行了回补实验。外源过表达Smad3后发现LC3、p62蛋白水平能够回复(P<0.01,图6C),同时利用p38抑制剂SB203580处理胰腺癌细胞同样发现LC3、p62蛋白水平增加(P<0.01,图6D)。提示下调Smad3后胰腺癌细胞生物学过程的改变,很有可能是通过p38/MAPK信号通路。
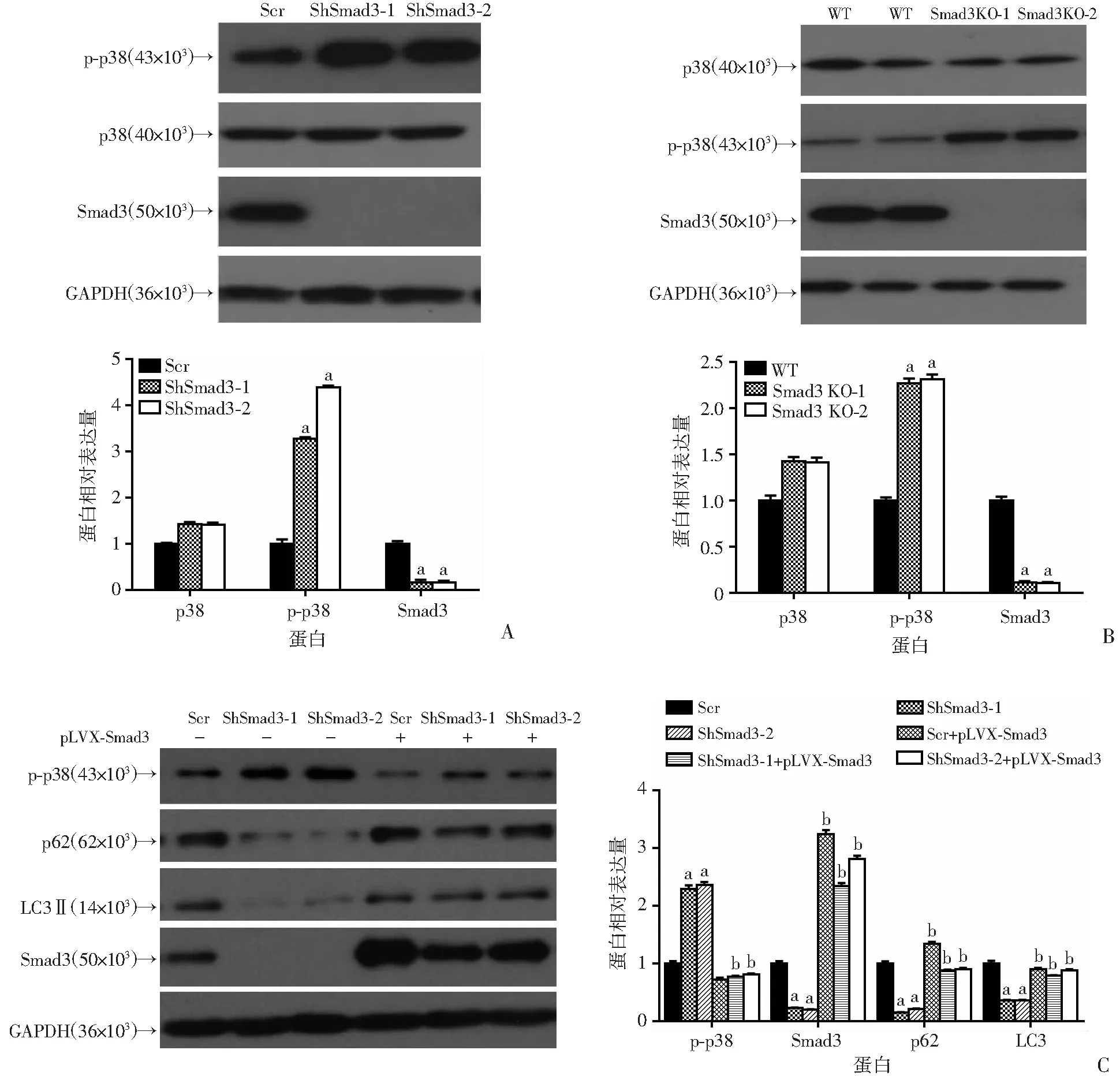
a:P<0.05,与对照组(Scr)比较;b:P<0.01,与Smad3敲减组比较
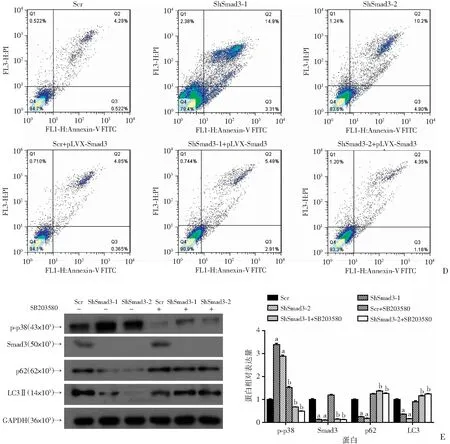
a:P<0.05,与对照组(Scr)比较;b:P<0.01,与Smad3敲减组比较
3 讨论
胰腺癌是一种恶性消化道肿瘤。由于早期没有特别有效的诊断标志物,一经发现就已进入中晚期,5年存活率极低。因此,相关的靶向治疗研究亟待开展[22-23]。本研究发现Smad3在胰腺癌中高表达且与患者的生存呈负相关,同时敲减Smad3后导致胰腺癌细胞凋亡增加。结果提示Smad3对胰腺癌发生、发展有重要的调控作用。研究表明植物类黄酮化合物影响TGF-β1/Smad3和TGF-β1/p38 MAPK信号通路调控自噬,可以减轻肝脏纤维化[24-25],同时发现Smad3能促进自噬失调调控细胞溶酶体缺失[26],然而Smad3在胰腺癌中调控自噬与凋亡的机制尚不明确。本研究发现干扰Smad3通过激活p38/MAPK信号通路诱导细胞过度自噬,从而导致其凋亡增加。
自噬是维持细胞稳态的关键机制,也是一种高度保守的生物学过程。通过对自身蛋白质和细胞器的降解使细胞能够在极端环境下存活[27]。因此,自噬调控受阻将会导致许多疾病的发生[28]。随着研究的深入,发现自噬蛋白Beclin 1基因在小鼠和人体中具有肿瘤抑制作用,进一步说明自噬具有肿瘤抑制功能[29]。由于自噬在肿瘤的形成过程中具有双重作用,因此抑制或诱导自噬途径对肿瘤的预防和治疗具有很大优势。本研究发现Smad3能够增加自噬相关蛋白LC3、p62的表达,具有自噬抑制作用,进而促进胰腺癌的发生、发展。因此,针对Smad3的靶向研究将为胰腺癌治疗提供新的思路。
细胞自噬与凋亡存在复杂的作用关系。自噬是细胞凋亡所需的过程,然而过度自噬能够诱导细胞凋亡[30]。p38/MAPK是调控细胞自噬及凋亡过程的重要信号通路。本研究发现干预Smad3的表达,p-p38蛋白水平显著增加,而自噬蛋白LC3、p62下调,同时胰腺癌细胞凋亡也显著增加。结果提示靶向干预Smad3后,导致胰腺癌细胞过度自噬,进而诱导胰腺癌细胞凋亡。用p38抑制剂SB203580处理Smad3敲减胰腺癌细胞相关蛋白的变化又能回复,进一步提示可能通过p38/MAPK信号通路进行调节。
综上所述,本研究探讨了Smad3表达水平与胰腺癌发生、发展以及患者生存的关系,结果表明Smad3高表达与胰腺癌的发生、发展正相关,与患者生存负相关。此外,Smad3在胰腺癌细胞系中高表达,敲减(敲除)Smad3可明显促进胰腺癌细胞凋亡,且能上调p-p38蛋白的表达,同时下调LC3、p62的表达。提示Smad3在胰腺癌发生、发展中发挥重要的促进作用,为临床治疗胰腺癌提供新的靶点。Smad3可作为胰腺癌一个潜在的临床诊疗的生物标记物。

