聚多巴胺基纳米材料的结构和抗氧化性能调控及其应用研究进展
叶自强,毛峥伟
(1. 教育部高分子合成与功能构造重点实验室,浙江 杭州 310027) (2. 浙江大学高分子科学与工程系,浙江 杭州 310027)
1 前 言
活性氧(reactive oxygen species, ROS)是一个分子家族,包括过氧化氢(H2O2)、羟基自由基(OH·)、单线态氧(1O2)、超氧化物(O2·-)等氧化剂分子。作为有氧代谢的副产物,ROS在所有生物体中不断产生、转化和消耗[1-3]。在特定范围内,ROS的产生对生物体内的代谢平衡至关重要。但是ROS在过度产生时会诱发一系列炎症反应,从而导致一系列急性和慢性疾病[4]。当炎症性疾病发生时,人体自身的ROS清除系统无法防止ROS的过度产生。因此,开发具有抗氧化活性的外源性ROS清除剂对炎症性疾病的治疗具有重要意义。
到目前为止,已经有一些基于生物酶和纳米酶的抗氧化纳米材料被相继开发,如负载超氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)的金属-有机框架(metal-organic frameworks, MOFs)纳米粒子、CeO2纳米粒子、普鲁士蓝纳米粒子等[5-8]。得益于它们优秀的抗氧化活性,这些纳米材料能有效维持细胞内氧化还原平衡并保护细胞免受氧化损伤,且比小分子抗炎药物有更长的保留时间。但是这些人工合成的外源性纳米材料往往引起潜在长期毒性方面的担忧,限制了它们的临床使用[9]。因此,天然来源的或具有优秀生物相容性的抗氧化材料在过去的几年中受到越来越多的关注。
黑色素是一种存在于动植物体内的生物聚合物,具有良好的生物相容性、生物降解性和出色的自由基清除能力,能有效地保护皮肤免受紫外线诱导的损伤[10-12],也可用于治疗炎症性疾病[13, 14]。受黑色素启发,有着类似结构的聚多巴胺(polydopamine, PDA)基纳米材料被制备出来,并在生物成像、光热治疗(photothermal therapy, PTT)、药物递送、智能水凝胶等方面受到广泛关注[15-18]。尤其是PDA基纳米材料可清除细胞和组织中的多种自由基,因而有望应用在各种炎症疾病的治疗中[14, 19, 20]。
本综述将介绍PDA基纳米材料作为抗氧化剂的最新研究进展和挑战。在第一部分,介绍PDA基纳米材料的合成过程以及可能的抗氧化机制;第二部分,讨论对PDA基纳米材料抗氧化性能在物化参数范围内的一些调节,方便为其功能的拓展提供指导;最后,总结近些年利用PDA基纳米材料抗氧化性能在生物医学领域的应用研究。希望本文能为PDA基纳米材料在抗氧化方面的研究起到积极的推动作用,启发更多基于PDA的抗氧化新材料的开发和应用。
2 聚多巴胺(PDA)的抗氧化机制
2.1 PDA的合成
材料的性质与其结构密切相关,对PDA抗氧化机理的探究通常涉及到多巴胺的聚合机理。尽管PDA被广泛使用,但PDA形成背后的分子机制尚未得到充分研究。有报道提出,PDA的形成与黑色素的生物合成途径有许多共同特征,主要是通过共价聚合来实现的[21]。如图1所示,在聚合过程中,通过光照射等外部刺激,多巴胺的邻苯二酚基团首先失去一个电子而变成多巴胺-半醌结构,之后,多巴胺-半醌自由基在分子间引发二聚化,形成儿茶酚-儿茶酚二聚体[22-24],儿茶酚偶联的机制已经被证实并应用到基于PDA的表面改性领域[25, 26]。或者,多巴胺-半醌结构进一步氧化形成多巴胺-醌,然后通过1,4-迈克尔加成进行分子内环化,形成5,6-二羟基吲哚(DHI)。PDA中存在DHI的直接证据是过氧化氢降解PDA时产生的吡咯衍生物(吡咯-2,3-二羧酸和吡咯-2,3,5-三羧酸)[27]。最后,这些儿茶酚二聚体和DHI中间体相互发生交联反应,形成稳定的PDA共价主链结构,其中包含一组稳定的四聚体[28]。除了共价聚合,整个聚合过程还包括许多非共价的分子间相互作用,包括离子相互作用、π-π相互作用、氢键等[29, 30]。聚合过程中的中间体能通过这些相互作用稳定地结合在共价主链周围,并最终和主链一同形成PDA。

图1 聚多巴胺(PDA)的合成过程及分子间相互作用[24]Fig.1 Synthesis process and intermolecular interactions of polydopamine(PDA)[24]
2.2 PDA抗氧化的机制
2013年,D′Ischia课题组首次从构效关系角度探索了5,6-二羟基吲哚(DHI)黑色素和5,6-二羟基吲哚-2-羧酸(DHICA)黑色素的结构和自由基清除性能之间的关系[31]。他们发现后者相较于前者具有更好的自由基清除活性,这是因为DHICA黑色素额外的羧酸根能够扭曲环间低聚角,导致低聚物堆叠困难,π电子发生离域,并诱导形成具有弱聚集相互作用的非平面微结构。与DHI黑色素相比,DHICA黑色素这种微弱的分子间聚集会使自由基更好地与之接触。因此,PDA等黑色素类似物的自由基清除性质可能受其微结构内低聚物平面内电子离域程度的显著影响[32]。另一方面,儿茶酚的氧化还原特性赋予了PDA清除各种自由基的能力,因为它既可以作为电子供体,也可以作为受体[33-35]。Gu等认为,PDA等多酚聚合物的ROS清除可分为2种途径[36]:一种是基于H原子转移的方法,其中儿茶酚(ROH)通过提供H原子来淬灭自由基(X·);另一种方法基于电子转移过程,儿茶酚通过电子转移还原X·,产生的苯氧自由基继续与第二个X·反应后形成稳定的醌结构(如图2a和2b)。此外,Shi课题组观察到O2·-与PDA溶液混合时会产生大量气泡,他们将其归因于PDA中存在自由基,其可以作为去除超氧化物电子的催化中心。电子顺磁共振(EPR)分析进一步证明了PDA的强自由基信号。之后,通过测量O2·-歧化反应中产生的OH-,他们推测PDA等黑色素类似物对O2·-的催化反应原理如图2c所示[13]。值得注意的是,虽然PDA材料有效清除多种自由基的能力已经通过实验得到证实,但由于其复杂的结构,全面而确切的清除机制仍然有待进一步阐明。
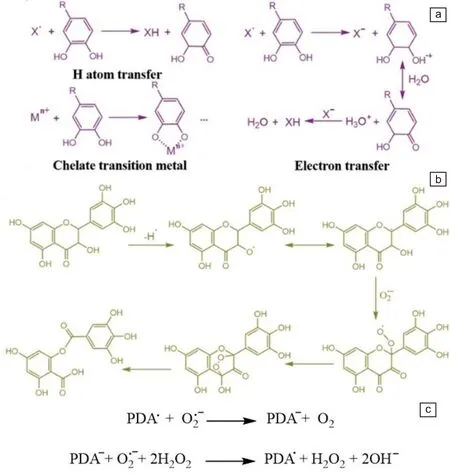
图2 多酚的自由基清除机制(a, b)[36]和PDA对O2·-可能的催化反应机理(c)[13]Fig.2 Radical scavenging mechanism of polyphenols (a, b)[36] and possible catalytic reaction mechanism of PDA for O2·- (c)[13]
3 PDA抗氧化性能的调控
PDA的抗氧化性能与其物理化学参数密切相关。过去几年里,关于PDA抗氧化性能调控的研究取得了较大的进展,本节将简要总结这些团队研究的调控策略。
3.1 粒径调控
据报道,PDA的粒径是影响其抗氧化活性的主要原因之一[12]。PDA的抗氧化活性归因于其儿茶酚基团部分的电子转移,而且PDA的表面改性并没有影响其自由基清除活性。同时,PDA的抗氧化活性呈现出粒径大小的依赖性,即随着PDA尺寸的减小,其抗氧化活性显著提高,这可能是由于粒子尺寸减小导致PDA的比表面积更大,儿茶酚基团的密度更高。因此,可以合理推测超小粒径的PDA纳米粒子会有优秀的抗氧化性能。
到目前为止,PDA的粒径已经可以通过调节实验参数进行调控。例如,多巴胺单体浓度、水和醇的比例可以通过影响多巴胺的聚合速率,从而控制PDA的粒径大小以及形态;温度、搅拌速率和氧气供应也可能通过影响聚合速率和相分离过程,控制PDA球体的粒径分布和形貌[37];溶剂的极性或混合溶剂中的有机组分含量,可通过影响多巴胺聚合过程中单体的扩散过程来间接影响PDA的最终粒径;此外,碱的浓度对PDA粒子的形态和产量没有明显影响,但对PDA粒径大小有显著影响[38]。值得注意的是,PDA聚合过程中的不同添加剂也会显著影响PDA的粒径。多巴胺的去质子化是多巴胺氧化的速率决定步骤,金属离子的加入会加速聚合过程,最终形成更大尺寸的PDA金属螯合纳米粒子[39]。Wang等通过在多巴胺聚合过程中加入自由基清除剂或者是稳定的自由基来控制自由基活性种的浓度,旨在通过在种子形成和纳米粒子生长阶段调整自由基来控制和调整PDA粒径的分布。需要注意的是,这种调控会进一步影响PDA粒子的光热活性或其它物理特性[40]。
3.2 微观结构调控
PDA的多功能特性与其微观结构高度相关[32, 41]。因此,调控PDA聚合的微观结构也是一种控制PDA抗氧化和自由基清除活性的重要方法。2020年,Li课题组报道了一种通过在多巴胺聚合过程中掺杂碱性氨基酸(如精氨酸)来调节PDA抗氧化活性的简单策略[41]。如图3a和3b所示,掺杂的精氨酸可以通过迈克尔加成反应或席夫碱反应在多巴胺聚合过程中与许多中间体轻松反应,破坏PDA纳米粒子致密的π-堆积微结构并形成弱聚集结构。这种微结构会让PDA更容易接触到自由基,从而产生更强的自由基清除作用。此外,实验结果也证明,氨基酸掺杂的PDA纳米粒子在体外和体内均表现出比常规PDA纳米粒子更优异的自由基清除能力和抗氧化作用。该项研究启发我们,合理的结构改造可以调控聚合物的功能。随着人们对PDA微观结构了解得越来越深入,结构调控策略也会变得越来越重要。

图3 PDA微观结构层面抗氧化性能调控的策略[41]:(a) 传统的PDA合成,(b) 氨基酸掺杂后的PDA合成Fig.3 Strategies for the regulation of antioxidant properties within the PDA microstructure[41]: (a) conventional PDA synthesis, (b) amino acid doped PDA synthesis
3.3 氧化还原程度调控
如前所述,PDA合成涉及诸如多巴胺单体向多巴胺-醌的氧化、分子内环化、吲哚衍生物形成以及儿茶酚之间的交联反应等一系列复杂的氧化还原反应[22]。因此,PDA富含丰富的氧化还原基团。PDA的抗氧化能力在一定程度上也取决于聚合过程中氧化还原的程度。Liu课题组使用电化学逆向工程的方法证明了PDA具有氧化还原活性并且可以反复接受和提供电子(图4)[35],他们将PDA与还原剂(例如抗坏血酸、NADPH或GSH)孵育以制备还原态的PDA(PDA-red),将PDA与空气饱和的水孵育以制备氧化态的PDA(PDA-ox)。X射线光电子能谱(XPS)分析证明PDA-red拥有更多的儿茶酚部分,而PDA-ox则拥有更多儿茶酚氧化的醌部分。在1,1-二苯基-2-三硝基苯肼(DPPH)评估实验中,PDA-red也被证明具有更高的自由基清除活性。大鼠皮下植入模型也证明PDA-red组比对照组和PDA-ox组有更好的抗炎效果。这项工作为研究和调控PDA抗氧化活性提供了新的思路。

图4 PDA氧化还原程度的调控示意图[35]Fig.4 Schematic diagram of the regulation of PDA redox degree[35]
4 PDA抗氧化性能的应用
炎症是机体保护自身免受伤害的自然反应,在保护组织免受感染、创伤或其它原因对身体的进一步伤害方面起着至关重要的作用[36]。然而,过量的炎症反应也会引起免疫系统攻击机体自身的细胞或组织,进而导致炎症性疾病。而ROS的局部过度产生往往是这类炎症性疾病发生的关键标志[42]。PDA基纳米材料因其良好的生物相容性和优异的抗氧化活性,在治疗这类炎症性疾病方面有着天然的优势。表1总结了近几年PDA基纳米材料在炎症性疾病治疗领域的最新进展。

表1 PDA基纳米材料的生物医学应用Table 1 Biomedical applications of PDA-based nanomaterials
4.1 急性腹膜炎/急性肺损伤
急性腹膜炎/急性肺损伤(acute peritonitis/acute lung injury)是临床上的常见事件,其特征是失调的中性粒细胞大量流入组织器官中并释放蛋白酶、阳离子肽和ROS以加重组织损伤[46-48]。因此,通过清除ROS来预防组织损伤是临床治疗急性炎症损伤的重要手段。Zhao等首次将PDA纳米粒子用于治疗急性炎症诱导的损伤[19]。如图5所示,他们通过一步法合成了均匀且单分散的PDA纳米粒子。体外抗氧化活性测试证明PDA对H2O2的清除能力呈浓度依赖性。在体内实验中,他们发现PDA纳米粒子可以有效清除H2O2或脂多糖(LPS)诱导细胞产生的ROS,且能抑制LPS诱导的急性腹膜炎模型中的体内炎症过程。在急性肺损伤(ALI)的小鼠模型中,PDA纳米粒子可有效改善肺损伤,显著减少肺中性粒细胞和淋巴细胞的滞留,并下调促炎细胞因子的水平。最后,他们强调,PDA纳米粒子不仅可用于保护组织免受ROS损伤,还可用于改善失调的中性粒细胞引起的急性炎症。

图5 PDA纳米粒子的合成及其抗氧化和抗炎性质[19]Fig.5 Synthesis of PDA nanoparticles and their antioxidant and anti-inflammatory properties[19]
4.2 牙周炎
牙周炎的发病机制是免疫细胞过度产生ROS,通过脂质过氧化、蛋白质变性或DNA损伤对牙周细胞造成不可逆的损伤[49]。如图6所示,Bao等尝试使用PDA纳米粒子作为ROS清除剂,用于改变牙周微环境并减轻炎症引起的病理过程[43]。他们利用光谱表征证明PDA纳米粒子对多种ROS(H2O2、OH·、O2·-)均具有清除活性。体外实验表明,PDA纳米粒子可以保护人的牙龈上皮细胞免受氧化应激和炎症反应,小鼠体内的牙周炎模型进一步证明龈下注射PDA纳米粒子可以有效清除体内ROS并减少局部牙周炎症。此外,他们重点研究了PDA在体内给药后的长期毒性,结果表明,对照组和实验组的动物行为和体重没有发现明显差异。在注射PDA纳米粒子后24 h、30 d和60 d内,血清细胞因子(TNF-α、IFN-γ和IL-1β)水平均在正常值范围内;同时也没有改变丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)或碱性磷酸酶(ALP)的血清水平。最后,主要器官(心、肝、脾、肺、肾)的苏木精和伊红(H&E)染色分析表明,PDA纳米粒子龈下注射后小鼠器官没有发生形态学变化或炎症迹象。所有的这些结果都表明,PDA纳米粒子具有极低的全身毒性。

图6 PDA纳米粒子清除牙周炎示意图[43]Fig.6 Schematic diagram of PDA nanoparticles for eradication of periodontitis[43]
4.3 骨关节炎(OA)
骨关节炎(osteoarthritis, OA)的发病机制是软骨细胞中抗氧化机制失调而导致氧化应激增强[50]。最新的研究表明,活性氧(ROS)和活性氮(RNS)在OA的发展过程中起到关键作用,抑制软骨细胞中ROS和RNS的方法有望治疗OA。Zhao课题组首次尝试使用PDA纳米粒子作为OA治疗的新型自由基清除剂[20]。其研究分别证明了PDA对过氧亚硝酸盐、超氧化物和羟基自由基的清除活性。体外细胞实验结果证明,PDA纳米粒子通过激活自噬发挥抗炎和软骨保护作用。自噬是OA发病机制的保护过程,消耗软骨细胞中过多的ROS可增强自噬[51]。PDA纳米粒子显著提高了自噬标志物(包括LC3-II/LC3-I、ATG7和Beclin-1)在软骨细胞中的表达,透射电镜照片也显示在PDA处理后的软骨细胞中有大量自噬体。小鼠OA模型实验中,PDA组的OA标志物MMP-13明显比阳性染色组要少,ROS检测探针结果也显示PDA治疗组的ROS和RNS水平较对照组显著降低。这些结果都表明PDA纳米粒子可以有效清除关节软骨中的氧化应激,缓解OA的病理进展。
4.4 脊髓损伤(SCI)
中性粒细胞和单核细胞对受损脊髓细胞的浸润是脊髓损伤(spinal cord injury, SCI)及其引起的继发性损伤的主要特点[52-54]。激活的中性粒细胞、单核细胞、小胶质细胞和星形胶质细胞产生大量活性氧和活性氮(RONS),在受损脊髓中引起氧化应激,导致神经元死亡和脊髓损伤[55-58]。因此,调节脊髓的氧化微环境可以有效治疗SCI。Wang课题组提出了一种纳米诱饵策略,通过将减少中性粒细胞的早期浸润和抗氧化治疗结合来改善SCI后的功能恢复[45]。具体来说,他们将PDA作为中粒细胞膜囊泡(NMVs)包裹的核心,制备了中性粒细胞膜包覆的PDA纳米粒子(NDs),如图7所示。利用NMVs作为细胞因子诱饵,中和多种类型的趋化因子和炎症因子,从而中断中性粒细胞的浸润和活化。同时,PDA清除了神经元的细胞内RONS,保护神经元免受氧化损伤。在体外吸附炎症因子和趋化因子的实验中,对细胞活化状态的分析结果显示,活化因子(如TNF-α、IL-1β和IL-6)在细胞内的表达水平比预期低,表明NDs能有效吸附TNF-α、IL-1β和IL-6。此外,细胞内一氧化氮合酶(iNOS)在活化的单核细胞和小胶质细胞中的高表达在NDs治疗组中也被显著抑制。这些数据表明,NDs可以通过吸附炎症介质来减少炎症微环境中单核细胞、小胶质细胞和星形胶质细胞的活化。电子自旋共振(electron spin-resonance spectroscopy, ESR)光谱和2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS·+)测试进一步证明NDs保留了很强的自由基清除活性。之后,他们在体内实验中评估了NDs对SCI后的早期阶段和晚期组织损伤修复的能力,结果表明,NDs在SCI后的早期阶段有效防止了炎症和氧化微环境的恶化,晚期则抑制了胶质瘢痕的形成并促进了神经轴突再生。最后他们指出,通过调节炎症和氧化环境,将NDs与细胞移植疗法等治疗方式相结合的策略在治疗SCI方面具有广阔的前景。

图7 中性粒细胞膜包覆的PDA纳米粒子(NDs)的制备示意图[45]Fig.7 Schematic diagram of the preparation of neutrophil membrane-coated PDA nanoparticles (NDs)[45]
4.5 创面修复
糖尿病创面主要是由4个因素造成的:有缺陷的细胞迁移、功能低下的胶原蛋白沉积、长期的炎症和不受调节的氧化应激[59-61]。巨噬细胞由于其多功能性而成为这一过程的关键调节剂[62]。巨噬细胞向M2表型极化的免疫调节促进了糖尿病创面从炎症到增殖阶段的转变,已被证明是改善糖尿病伤口愈合的有效方法。例如,Mao课题组将PDA修饰的氧化石墨烯(GD)通过氢键和亲疏水相互作用引入F127-EPL溶液中来合成GDFE(GO-PDA-F127-EPL)可注射水凝胶,所得水凝胶通过调节巨噬细胞的活化状态来调节炎症微环境,增强细胞增殖、肉芽组织形成、胶原蛋白沉积并促进糖尿病伤口的修复(图8)[63]。GDFE水凝胶可以有效清除自由基并表现出较强的抗氧化性能,Mao等将其归因于PDA中的儿茶酚容易被氧化成醌类,使得GDFE水凝胶具有很强的ROS捕获能力。此外,他们研究了小鼠体外诱导Raw 264.7巨噬细胞极化为M2表型的能力。与对照组(M0巨噬细胞)相比,GDFE组巨噬细胞出现明显的形态变化。免疫荧光染色进一步证明在GDFE组观察到M2巨噬细胞表面标志物CD206的阳性染色。这些证据表明GDFE水凝胶可以有效激活巨噬细胞极化到M2表型。体内的糖尿病全层伤口模型中,GDFE组具有最低的M1标志物INOS2表达和最高的M2标志物ARG表达,证明巨噬细胞成功被GDFE水凝胶诱导为M2表型。最后他们强调,GDFE水凝胶通过抗炎、抗氧化、M2巨噬细胞极化和血管生成,在促进糖尿病伤口愈合方面表现出强大的能力,并在免疫调节相关的伤口治疗中具有出色的潜力。

图8 PDA修饰的氧化石墨烯水凝胶(GDFE)合成示意图,可用于糖尿病伤口愈合和皮肤重建[63]:(a)PDA修饰的氧化石墨烯(GD)合成示意图,(b)F127-EPL凝胶的合成示意图,(c)GDFE水凝胶的制备、多功能特性和应用Fig.8 Schematic diagram of the synthesis of PDA-modified graphene oxide hydrogel (GDFE) for diabetic wound healing and skin reconstruction[63]: (a) schematic diagram of GD(GO-PDA) synthesis, (b) schematic diagram of the synthesis of the FE(F127-EPL) hydrogel, (c) preparation, multifunctional properties and applications of GDFE hydrogels
4.6 新型仿生氧载体
由于传统输血血源不足的问题和临床使用的巨大需求,安全有效的人工氧载体成为人们关注的话题。血红蛋白(Hb)是红细胞内运输氧的特殊蛋白质,被认为是理想的携氧单位[64]。基于血红蛋白的氧载体,在过去几十年里作为血液的替代品而广为人知。然而,未修饰的血红蛋白纳米粒子作为氧载体的性能尚不能令人满意,因为它循环时间短、稳定性差,而且容易被氧化[65]。交联、表面改性和封装等方法已经用于血红蛋白氧载体的改性[66-69]。遗憾的是,在临床II期和III期实验中还是发生了严重的不良反应[70, 71]。Zhou课题组利用PDA的粘附性和优异的自由基清除能力和抗氧化活性,通过一步组装合成了PDA包覆的血红蛋白纳米颗粒(Hb-PDA)[72]。体外自由基清除实验中,Hb-PDA的自由基清除率达89%。血小板聚集和溶血实验也进一步证明Hb-PDA纳米颗粒对血液成分和细胞活性的影响很小。这些优异的特性表明,PDA包覆的血红蛋白在新型氧载体的发展中具有代表性和前景。
这类新型氧载体被Liu课题组进一步拓展并应用于肿瘤治疗领域[73]。如图9所示,他们设计了一种仿生红细胞,并利用光动力疗法(photodynamic therapy, PDT)来治疗乏氧的肿瘤。具体来说,血红蛋白(Hb)、PDA和光敏剂亚甲基蓝(methylene blue, MB)被封装在红细胞膜囊泡中,以制备出这种具有攻击性的红细胞(AmmRBCs)。其中,PDA用来代替红细胞内的天然抗氧化系统(如SOD和CAT)以防止血红蛋白氧化。外层的红细胞膜囊泡则可以提高生物相容性和实现体内长循环。体外氧化环境的耐受性实验中,H2O2预处理后材料的溶解氧含量并未出现明显变化,且与单独的Hb组相比明显提高。作者解释为PDA作为抗氧化剂实现对H2O2清除,使Hb携氧能力不受影响。体内实验中,AmmRBC能够在肿瘤部位富集,改善肿瘤部位乏氧状况,提高PDT效果,从而杀死肿瘤。这项研究可以为生产浓缩红细胞的人工替代品提供新的思路,以解决临床中红细胞短缺的问题。

图9 AmmRBCs用于肿瘤治疗的示意图[73]:(a)AmmRBC的制备,(b)AmmRBCs在肿瘤部位积累并促进1O2生成以增强PDT,(c)AmmRBC中的PDA功能类似于RBC中的CAT和SOD,以保护Hb在循环过程中免受氧化损伤Fig.9 Schematic representation of AmmRBCs for tumor therapy[73]: (a) preparation of AmmRBCs, (b) AmmRBCs accumulate at tumor sites and promote 1O2 generation to enhance PDT, (c) PDA in AmmRBCs functions similarly to CAT and SOD in RBCs to protect Hb during circulation protection from oxidative damage
5 结 语
本综述主要对近年来聚多巴胺(polydopamine, PDA)基纳米材料在抗氧化方面的研究进展和应用方面进行了总结。近年来,PDA基纳米材料自身良好的生物相容性以及优异的自由基清除活性和抗氧化特性在越来越多的领域受到重视,比如在炎症治疗、伤口修复和仿生材料制造等领域。尽管这些成果令人兴奋,但目前仍有许多挑战需要克服。
首先,PDA较为复杂的合成过程及分子间的相互作用使其抗氧化机制不明确,受限于当前的科技水平,只能通过调节PDA合成过程中的部分物理化学参数来调控其抗氧化性能。其次,据报道,PDA在某些特定条件(如近红外光照射)下能产生自由基[35],但是,PDA清除还是产生自由基的决定性因素尚不清楚,自由基能否被PDA自身中和还有待进一步研究。此外,PDA虽然具有广谱的抗氧化活性,但目前其抗氧化效率还比不上生物酶和纳米酶[74]。因此在现阶段对PDA抗氧化性能的调控还处于探索阶段,需要更加有效的调控策略来增强PDA的抗氧化活性。
希望通过对PDA抗氧化的机制、抗氧化性能的调控和应用的介绍和总结,能给该领域的研究人员在设计下一代PDA抗氧化材料及探索相关应用时提供参考。