基于TLR4/NF-κB信号通路研究清开灵口服液防治肺炎的作用机制
陈红英,李 新,许 浚,张铁军,李 卿,欧阳冬生,徐 旭*
基于TLR4/NF-κB信号通路研究清开灵口服液防治肺炎的作用机制
陈红英1, 2,李 新3,许 浚3,张铁军3,李 卿3,欧阳冬生1*,徐 旭3*
1. 中南大学湘雅医院 临床药理研究所,湖南 长沙 410008 2. 广州白云山明兴制药有限公司,广东 广州 510250 3. 天津药物研究院,天津市中药质量标志物重点实验室,天津 300301
基于Toll样受体4(Toll-like receptor 4,TLR4)/核因子-κB(nuclear factor-κB,NF-κB)信号通路研究清开灵口服液防治肺部炎症的作用及机制。SD大鼠随机分为对照组、模型组及清开灵口服液低、中、高剂量(4、8、16 mL/kg)组和头孢氨苄(175 mg/kg)组,各给药组ig相应药物,1次/d,连续6 d。给药同时进行造模,肺部注射肺炎克雷伯菌菌液造模3 d,对照组肺部注射生理盐水。给药结束后采集大鼠血液、肺泡组织灌洗液(bronchoalveolar lavage fluid,BALF),进行菌落培养和计数;采用全自动血液细胞分析仪检测白细胞数量及中性粒细胞、单核细胞比例;采用ELISA法检测血清中白细胞介素-1(interleukin-1,IL-1)、IL-2、IL-6、IL-10、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、缓激肽(bradykinin,BK)、单核细胞趋化因子(monocyte chemotactic protein-1,MCP-1)水平及环氧化酶-1(cyclooxygenase-1,COX-1)、COX-2活性;采用苏木素-伊红(HE)染色观察大鼠肺组织病理变化;采用免疫组化法检测肺组织TLR4蛋白表达;采用Western blotting法检测肺组织磷酸化p65(phosphorylated p65,p-p65)、p65、磷酸化NF-κB抑制因子(phosphorylated inhibitor of NF-κB,p-IκB)和IκB表达。与模型组比较,清开灵口服液组大鼠全血及BALF中经培养后的菌落数显著降低(<0.05);全血中白细胞数目及中性粒细胞、单核细胞比例均显著降低(<0.05、0.01);血清中IL-1、IL-2、IL-6、IL-10、TNF-α、BK、MCP-1水平及COX-1、COX-2活性均显著降低(<0.05、0.01);肺实质中炎性细胞浸润、红细胞渗出及肺泡上皮细胞脱落等现象明显减少;肺组织中TLR4蛋白阳性表达明显减少,p-p65/p65和p-IκB/IκB蛋白表达水平显著下降(<0.05、0.01)。清开灵口服液具有抑制肺炎克雷伯菌所致肺炎的作用,其机制可能与调控TLR4/NF-κB信号通路有关。
肺炎克雷伯菌;肺炎;清开灵口服液;炎症;Toll样受体4/核因子-κB信号通路
肺炎克雷伯菌肺炎是由肺炎克雷伯菌引起一种常见的肺炎类型,通常表现为支气管肺炎和支气管炎。肺炎克雷伯菌属于革兰氏阴性菌,是医院内感染的主要致病菌,患者多以老人、婴幼儿、慢性病人、免疫功能低下者为主。由于肺炎克雷伯菌致病性强,且越来越具多重耐药性[1],即使采用抗菌治疗,也会导致高并发症和高死亡率[2]。
清开灵口服液由板蓝根、金银花、栀子、水牛角、珍珠母、黄芩苷、胆酸、猪去氧胆酸8种中药材提取而成,处方来源于古代著名方剂安宫牛黄丸,具有清热解毒、镇静安神的作用,用于外感风热、火毒内盛所致的发热、烦躁不安、咽喉肿痛、舌质红绛、苔黄、脉数者;上呼吸道感染、病毒性感冒、急性化脓性扁桃体炎、急性咽炎、急性气管炎、高热见上述证候者,并记载于《中国药典》2020年版一部[3]。同处方品种清开灵注射液已被用于中医治疗新型冠状病毒(Corona Virus Disease 2019,COVID-19)[4]。本研究旨在探讨清开灵口服液对肺炎克雷伯菌所致肺炎大鼠的抗菌、消炎作用及其作用机制,为其临床应用提供参考依据。
1 材料
1.1 动物
SPF级雄性SD大鼠,5~6周龄,体质量180~200 g,购自北京斯贝福生物技术有限公司,许可证号SCXK(京)2019-0010。动物饲养在天津药物研究院新药评价有限公司实验动物屏障系统SYXK(津)2011-0005,温度维持在20~26 ℃,相对湿度维持在40%~70%,通风次数为10~15次/h全新风,光照为12 h/12 h明暗交替,自由进食饮水。动物实验获得天津药物研究院新药评价有限公司实验动物伦理委员会批准(批准号No.2020072801)。
1.2 菌株
肺炎克雷伯菌(ATCC9997)购自北京北纳创联生物技术有限公司。
1.3 药品与试剂
清开灵口服液(批号1200205,10 mL/支)购自广州白云山明兴制药有限公司;头孢氨苄片(批号191001,0.25 g/片)购自天津市中央药业公司;大鼠白细胞介素-1(interleukin-1,IL-1)ELISA试剂盒(批号2004061)、IL-2 ELISA试剂盒(批号2003251)、IL-6 ELISA试剂盒(批号2003271)、IL-10 ELISA试剂盒(批号2004283)、环氧化酶-1(cyclooxygenase-1,COX-1)ELISA试剂盒(批号2004121)、COX-2 ELISA试剂盒(批号2004122)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号2003281)、缓激肽(bradykinin,BK)ELISA试剂盒(批号2004051)、单核细胞趋化因子-1(monocyte chemotactic protein-1,MCP-1)ELISA试剂盒(批号2004061)均购自上海西唐生物科技有限公司;BCA蛋白定量试剂盒(批号15E13B46)、SDS-PAGE凝胶制备试剂盒(批号15I01A38)均购自博士德生物公司;0.22 μm PVDF膜(批号ISEQ00010)购自美国Millipore公司;超敏ECL化学发光检测试剂盒(批号KF005)、β-actin抗体(批号AF7018)、p65抗体(批号AF5006)、磷酸化p65(phosphorylated p65,p-p65)抗体(批号AF2006)、核因子-κB抑制因子(inhibitor of NF-κB,IκB)抗体(批号AF5002)、p-IκB抗体(批号AF2002)、HRP标记的山羊抗兔IgG抗体(批号S0001)均购自美国Affinity公司;Toll样受体4(Toll-like receptor 4,TLR4)抗体(批号ab32536)购自英国Abcam公司。
1.4 仪器
BC-2800Vet型全自动血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司);DENLEY DRAGON Wellscan MK 3型酶标仪、Wellwash 4 MK2型洗板机、MAXQ2000型水平摇床、Sorvall ST 8R型高速冷冻离心机(美国Thermo Fisher Scientific公司);PowerPac HC型电泳仪、Trans-Blot SD Cell转印仪、ChemiDoc XRS型全自动多功能化学发光分析系统(美国Bio-Rad公司);CHR-100型恒温金属浴(上海巴玖实业有限公司);ASP200S型全自动组织脱水机、G1150H+C型包埋机、ARM2235型切片机、DM4000B型正置荧光显微镜(德国Leica公司)。
2 方法
2.1 动物分组及给药
60只雄性SD大鼠随机分为对照组、模型组及清开灵口服液低、中、高剂量(4、8、16 mL/kg)组和头孢氨苄(175 mg/kg)组,每组10只。动物适应性饲养7 d后,各给药组ig相应药物,对照组和模型组ig生理盐水(2 mL/只),1次/d,连续6 d。给药同时进行造模,除对照组外,其余各组大鼠于给药后肺内注射0.2 mL肺炎克雷伯菌菌液(1×107CFU/mL),对照组给予生理盐水,1次/d,连续3 d。
2.2 外周血及支气管肺泡组织灌洗液(bronchoalveolar lavage fluid,BALF)分析
末次给药后1 h,大鼠麻醉后腹主动脉取血,采用全自动血液细胞分析仪测定外周血白细胞总数和中性粒细胞、单核细胞百分比;无菌操作将全血接种至血琼脂平板中,培养24 h后,于倒置显微镜下进行菌落计数。收集肺泡冲洗液,于孵育箱中培养24 h后,进行菌落计数。
2.3 各组大鼠血清中炎症因子检测
取各组大鼠全血,4 ℃、3000 r/min离心10 min,取血清,按照试剂盒说明书测定IL-1、IL-2、IL-6、IL-10、MCP-1、TNF-α、BK水平和COX-1、COX-2活性。
2.4 肺组织病理观察
取各组大鼠部分肺组织,于4%多聚甲醛中固定72 h后,石蜡包埋并切片成4 μm厚的薄片,进行苏木素-伊红(HE)染色,于光学显微镜下观察肺组织损伤情况(包括肺泡充血、出血、浸润或血管壁上的中性粒细胞聚集)。
2.5 免疫组化法检测肺组织TLR4蛋白表达
取各组大鼠部分肺组织,于10%甲醛溶液中固定,常规脱水、石蜡包埋、切片后,经柠檬酸盐抗原修复、内源性过氧化物酶阻断、TLR4抗体孵育、DAB显色、梯度乙醇脱水、二甲苯透明、中性树胶封片后,于光学显微镜下观察并拍照,并对其阳性细胞进行计数。
2.6 Western blotting检测肺组织NF-κB通路相关蛋白表达
取各组大鼠部分肺组织,加入含有蛋白酶抑制剂和磷酸酶抑制剂的蛋白质裂解液,冰上裂解30 min,离心后取上清进行蛋白定量及变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%脱脂牛奶中封闭1~2 h,分别加入p-IκB、IκB、p-p65、p65和β-actin抗体,4 ℃孵育过夜;TBST洗膜5次,加入HRP标记的山羊抗兔IgG抗体,室温孵育1 h,TBST洗膜5次后,用ECL化学发光试剂盒显色,并在凝胶成像系统中拍照,采用Image J软件进行分析。
2.7 统计分析
3 结果
3.1 清开灵口服液对肺炎模型大鼠外周血及BALF菌落数的影响
如表1所示,与对照组比较,模型组大鼠外周血及BALF中菌落数显著增加(<0.05);与模型组比较,清开灵口服液中、高剂量组和头孢氨苄组大鼠外周血中菌落数显著减少(<0.05),各给药组大鼠BALF中菌落数均显著减少(<0.05)。
3.2 清开灵口服液对肺炎模型大鼠外周血白细胞总数和中性粒细胞、单核细胞百分比的影响
如表2所示,与对照组比较,模型组大鼠外周血白细胞数量和中性粒细胞、单核细胞比例均显著增加(<0.01);与模型组比较,各给药组外周血白细胞数量和单核细胞比例均显著降低(<0.05、0.01),清开灵口服液中、高剂量组和头孢氨苄组大鼠外周血中性粒细胞比例显著降低(<0.05、0.01)。
表1 清开灵口服液对肺炎模型大鼠外周血及BALF菌落数的影响(, n = 6)
Table 1 Effect of Qingkailing Oral Liquid on number of colonies in peripheral blood and BALF of pneumonia model rats(, n = 6)
组别剂量外周血菌落数BALF菌落数 对照—00 模型—7.00±5.51#44.00±34.34# 清开灵口服液4 mL/kg2.83±3.495.83±6.15* 8 mL/kg1.00±2.45*3.33±3.88* 16 mL/kg0.00±0.00*2.50±3.89* 头孢氨苄175 mg/kg0.50±0.84*2.67±3.20*
与对照组比较:#<0.05##<0.01;与模型组比较:*<0.05**<0.01,下表同
#< 0.05##< 0.05control group;*< 0.05**< 0.05model group, same as below tables
3.3 清开灵口服液对肺炎模型大鼠血清中炎症因子水平的影响
如图1所示,与对照组比较,模型组大鼠血清中IL-1、IL-2、IL-6、IL-10、TNF-α、BK、MCP-1水平及COX-1、COX-2活性均显著升高(<0.05、0.01);与模型组比较,各给药组大鼠血清中IL-1、IL-2、IL-6、IL-10、BK、MCP-1水平及COX-1、COX-2活性均显著降低(<0.05、0.01),清开灵口服液中、高剂量组和头孢氨苄组大鼠血清中TNF-α水平显著降低(<0.05、0.01)。
表2 清开灵口服液对肺炎模型大鼠外周血白细胞数和中性粒细胞、单核细胞比例的影响(, n = 6)
Table 2 Effect of Qingkailing Oral Liquid on peripheral blood leukocytes and percentages of neutrophils and monocytes in pneumonia model rats (, n = 6)
组别剂量白细胞数/(×109·L−1)中性粒细胞占比/%单核细胞占比/% 对照—7.93±1.4918.52±4.732.23±0.64 模型—25.30±8.57##50.98±4.77##4.78±0.76## 清开灵口服液4 mL/kg17.68±4.05*50.15±7.003.32±0.12** 8 mL/kg14.43±3.31*42.97±6.31**3.23±0.15** 16 mL/kg13.75±3.51*41.52±5.59*3.10±0.20** 头孢氨苄175 mg/kg14.47±5.11*37.32±4.44**2.97±0.16**
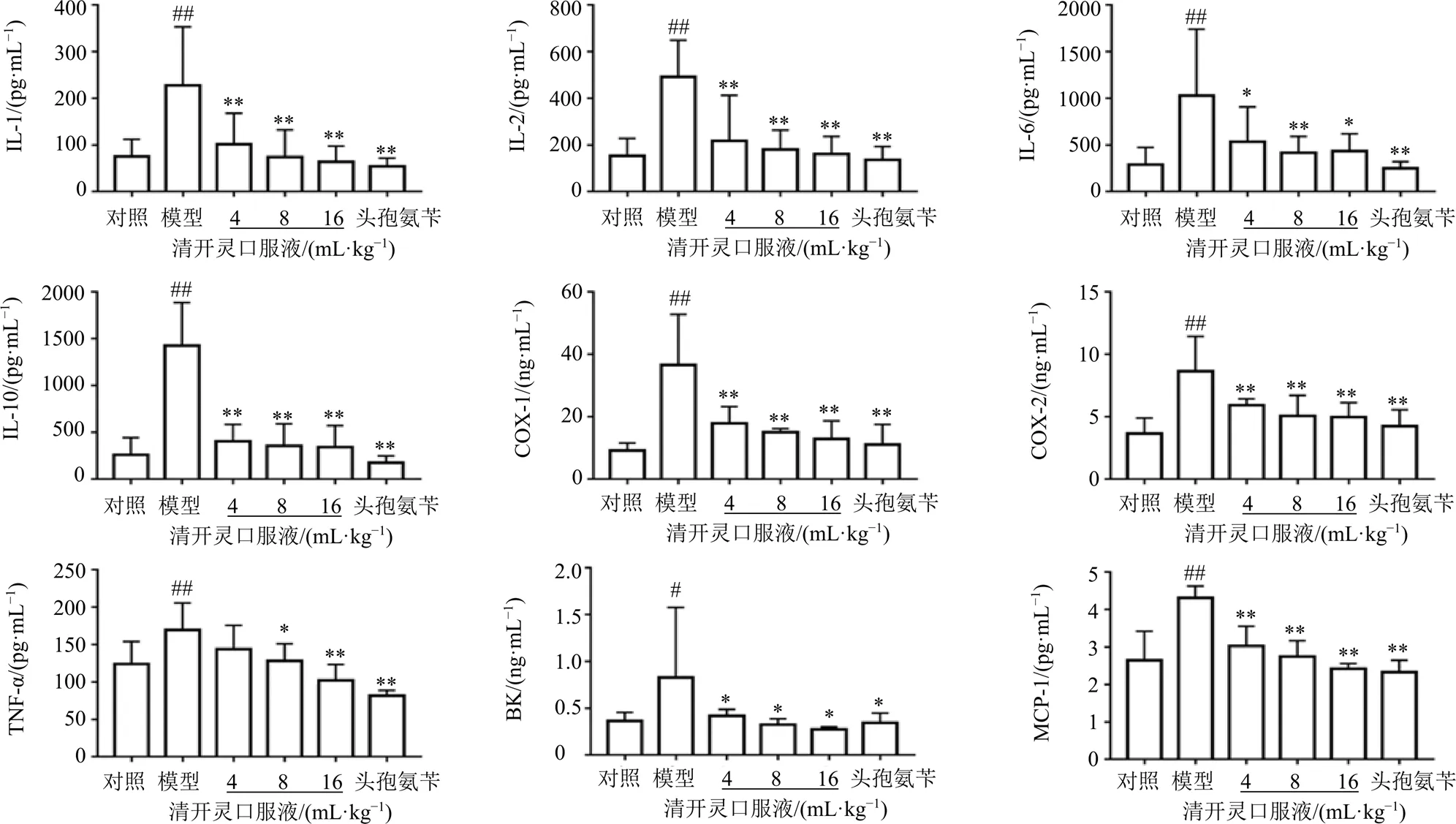
与对照组比较:#P<0.05 ##P<0.01;与模型组比较:*P<0.05 **P<0.01,图4同
3.4 清开灵口服液对肺炎模型大鼠肺组织病理变化的影响
如图2所示,对照组大鼠肺泡结构完整,肺泡腔内无渗出物,肺泡间隔无增厚,肺泡间隔内毛细血管无明显充血、扩张及炎症细胞浸润。模型组大鼠肺泡腔内充满渗出的纤维素,相邻肺泡纤维素丝经肺泡间孔相连接现象多见,肺泡结构破坏,肺泡间隔增厚及毛细血管扩张明显,肺间质见大量炎性细胞浸润及红细胞渗出。清开灵口服液低、中剂量组可见肺泡腔内纤维素渗出较少,相邻肺泡纤维素丝经肺泡间孔相连接现象较模型组少见,部分肺泡结构破坏融合,部分肺泡间隔增厚,肺间质有少量炎症细胞浸润。清开灵口服液高剂量组肺组织肺泡结构完整,肺泡腔内仅有极少量炎症细胞浸润。头孢氨苄组大鼠肺组织可见肺泡腔内纤维素渗出较模型组少,相邻肺泡纤维素丝经肺泡间孔相连接现象较模型组少见,部分肺泡结构破坏,肺泡间隔增厚,肺泡腔及肺间质有少量渗出液。
3.5 清开灵口服液对肺炎模型大鼠肺组织中TLR4蛋白表达的影响
如图3所示,对照组大鼠肺组织中仅检测到少量TLR4蛋白阳性表达,模型组肺组织中TLR4蛋白阳性表达增加,各给药组肺组织TLR4蛋白阳性表达明显减少。
3.6 清开灵口服液对肺炎模型大鼠肺组织中p-p65/p65和p-IκB/IκB蛋白表达的影响
如图4所示,与对照组比较,模型组大鼠肺组织中p-p65/p65和p-IκB/IκB蛋白表达水平均显著升高(<0.01);与模型组比较,清开灵口服液中、高剂量组和头孢氨苄组大鼠肺组织中p-p65/p65和p-IκB/IκB蛋白表达水平均显著降低(<0.05、0.01)。

图2 各组大鼠肺组织病理变化(HE, ×200)
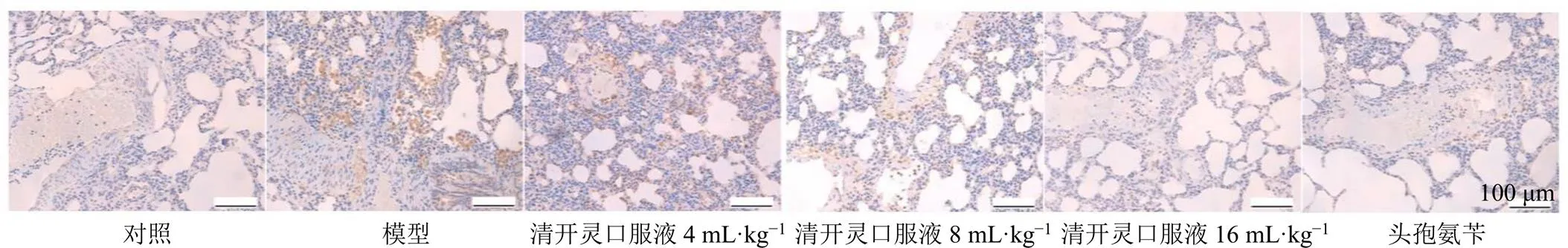
图3 各组大鼠肺组织TLR4蛋白表达(×200)
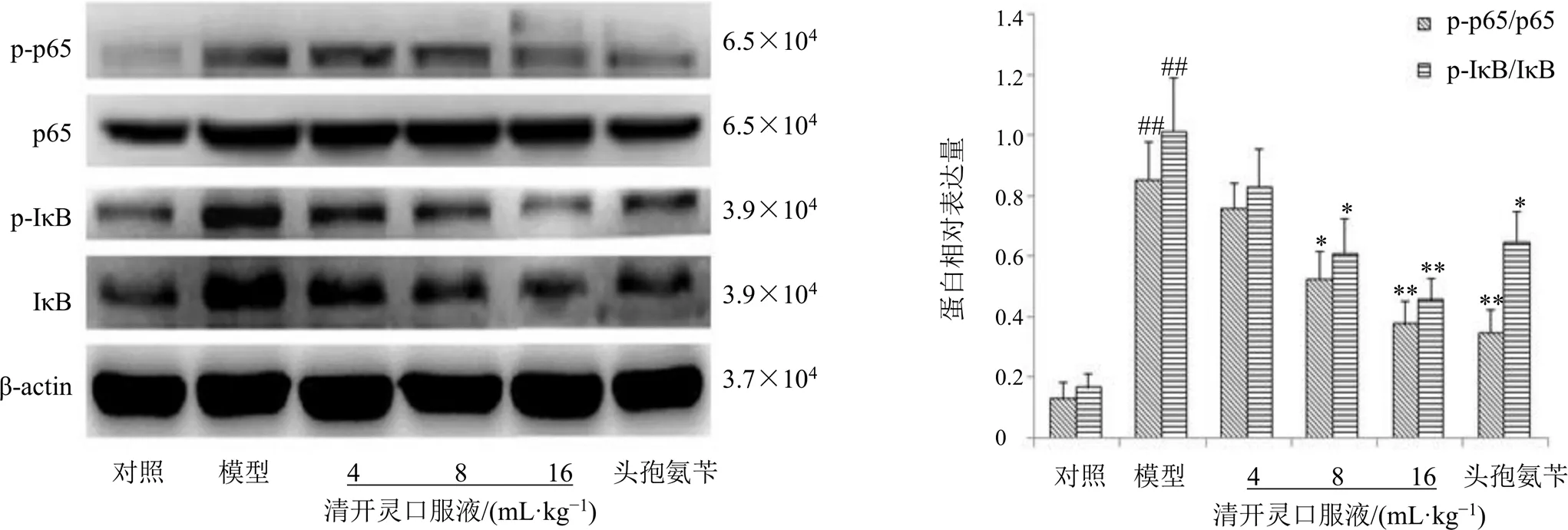
图4 各组大鼠肺组织p-p65/p65和p-IκB/IκB变化(, n = 3)
4 讨论
肺炎克雷伯菌于1882年在肺炎患者的肺中分离得到。该菌在环境中无处不在,经常在医疗设备中被发现。近年来,临床中应用抗生素的种类及范围不断扩大,使得肺炎克雷伯菌对于各类抗生素产生耐药性,并且耐药性日趋严重。耐药菌株所引发的院内感染的发生率也呈现逐年递增趋势,有报道指出地中海周边的27家医院发生的院内感染,约有10%为肺炎克雷伯菌引起[5]。而在我国,肺炎克雷伯菌是引发院内感染的第二大致病菌群[6]。
抗菌中药在我国应用历史悠久,具有低耐药性、多作用靶点的抗菌效果。中成药清开灵口服液具有清热解毒、镇静安神的作用,临床上对呼吸道疾病具有较好的治疗作用。本研究结果显示,清开灵口服液能明显抑制肺炎克雷伯菌在大鼠体内的繁殖,降低肺炎大鼠外周血白细胞数量及中性粒细胞和单核细胞比例。中性粒细胞和单核细胞在宿主防御、对抗肺炎克雷伯菌方面至关重要,其中,中性粒细胞(包括TNF-α、IL-1β、IL-6、IL-10等)被认为是细胞因子的重要来源,可作为关键调节剂对病菌感染引起的炎症进行调控[6]。单核细胞产生至少2组炎症蛋白介质(IL-1β和TNF-α)[8]。
细胞因子释放综合征(cytokine release syndrome,CRS)是指机体对病毒、细菌等外界刺激所产生的一种过度免疫应答,易导致后续炎性细胞因子急剧升高,致使机体免疫系统失调,出现全身炎症反应、多器官功能衰竭等临床表现的综合征[9]。CRS也被认为是COVID-19的主要作用机制[10-11]。CRS发生时,体液中多种细胞因子如TNF-α、IL-1、IL-6、MCP-1等迅速大量产生,趋化中性粒细胞、单核细胞等致炎症部位,对病菌进行高效杀伤的同时也对宿主正常器官组织造成严重损伤。本研究结果显示,清开灵口服液可显著降低肺炎大鼠外周血中的细胞因子(IL-1、IL-2、IL-6、IL-10、COX-1、COX-2、BK、MCP-1)的大量释放,避免大量细胞因子的聚集对器官造成大面积的损伤。
一般而言,肺部对颗粒物可启动机械防御,即咳嗽和黏液纤毛运动;对于机械防御未能阻拦的颗粒物及病原体可启动第二道防御即病原体相关分子模式(pathogen-associated molecular patterns,PAMPs)。TLRs是主要的上皮PAMPs受体,在受到外界病原体的侵袭后,TLRs的激活诱导了TLR4/NF-κB信号通路的激活,刺激肺部炎症的细胞因子和趋化因子的大量释放。当TLR4受到脂多糖(lipopolysaccharide,LPS)刺激时,IκB作为NF-κB复合体中的一部分,形成p-IκB,随后被泛素化,最后从复合体中分离,激活NF-κB,导致LPS信号向下游传导,因此IκB对TLR4/NF-κB信号通路的传导具有重要作用。NF-κB是一个众所周知的核转录因子,磷酸化的NF-κB可移位至细胞核,与1个特定的DNA序列相结合,导致炎症级联反应的发生[12-13]。
研究发现,COVID-19在肺、肝、肾、中枢神经系统、胃肠系统和心血管系统等多种细胞中激活转录因子NF-κB,导致IL-1、IL-2、IL-6、TNF-α和各种趋化因子的产生。老年人和代谢综合征患者中NF-κB的敏感使这组人群易感染COVID-19,并导致更严重的并发症,包括高死亡率。调节NF-κB的活化水平,抑制IκB磷酸化,抑制TNF-α释放可减少CRS的发生,减轻COVID-19的严重程度。抑制NF-κB通路在缓解COVID-19重症中具有潜在的治疗作用[14]。
肺炎克雷伯菌的主要毒力因子LPS是革兰氏阴性细菌细胞壁外壁的组成成分,能保护细菌逃避宿主免疫[15]。在LPS诱导的肺炎发生发展中,TLR4作为LPS的受体,控制着LPS炎症信号的细胞内转导以及NF-κB的激活和大量炎症介质的释放[16]。TLR4可能参与识别S蛋白并通过MyD88依赖性信号通路导致促炎性细胞因子的激活,也会导致大量趋化因子和细胞因子(IL-1、IL-6、MCP-1)的大量释放,参与募集吸引白细胞和淋巴细胞到病灶部位,并持续扩增,此时在释放炎性介质消灭病毒的同时也损伤了自身的免疫系统稳态和正常细胞的功能[17]。当肺组织炎症发展到一定疾病阶段,会阻塞肺泡和毛细血管间的气体交换,肺泡出现代偿性的变大,出现肺间质增生等。本研究发现清开灵口服液能够显著降低肺组织中TLR4的表达,抑制下游TLR4/NF-κB信号通路p-IκB、p-p65的激活,降低细胞因子风暴对自身器官带来的损伤。
综上所述,清开灵口服液可明显改善肺炎克雷伯菌诱导的大鼠肺炎病理变化,抑制病原微生物内繁殖,抑制免疫亢进,减轻炎症引起的CRS,其机制可能与抑制TLR4/NF-κB信号通路有关。
利益冲突 所有作者均声明不存在利益冲突
[1] Li X F, Zhou X K, Ye Y,. Lyn regulates inflammatory responses ininfection via the p38/NF-κB pathway [J]., 2014, 44(3): 763-773.
[2] Mei X, Wang H X, Li J S,. Dusuqing Granules (DSQ) suppress inflammation inrat via NF-κB/MAPK signaling [J]., 2017, 17(1): 216.
[3] 中国药典[S]. 一部. 2020.
[4] 张英睿, 干志强, 刘紫轩, 等. 基于网络药理学和分子对接的清开灵注射液治疗新型冠状病毒肺炎(COVID-19) 的作用机制探寻 [J]. 中草药, 2020, 51(12): 3201-3210.
[5] Nahid F, Zahra R, Sandegren L. A blaOXA-181-harbouring multi-resistant ST147isolate from Pakistan that represent an intermediate stage towards pan-drug resistance [J]., 2017, 12(12): e0189438.
[6] 朱小奎. 广泛耐药高毒力肺炎克雷伯菌XJ-K1与XJ-K2全基因组测序分析及5种中药单体对其抗菌活性的研究初探[D]. 遵义: 遵义医科大学, 2020.
[7] Qu S Q, Dai C C, Yang F F,. Cefquinome-loaded microsphere formulations in protection against pneumonia withinfection and inflammatory response in rats [J]., 2019, 36(5): 74.
[8] Han S, Sung K H, Yim D,. The effect of linarin on LPS-induced cytokine production and nitric oxide inhibition in murine macrophages cell line RAW264.7 [J]., 2002, 25(2): 170-177.
[9] 刘亮, 孟圆, 高全立. 细胞因子风暴综合征和细胞因子释放综合征的研究进展[J]. 中国肿瘤临床, 2022, 49(12): 607-611.
[10] Merad M, Martin J C. Pathological inflammation in patients with COVID-19: A key role for monocytes and macrophages [J]., 2020, 20(6): 355-362.
[11] Wang J, Jiang M M, Chen X,. Cytokine storm and leukocyte changes in mild versus severe SARS-CoV-2 infection: Review of 3939 COVID-19 patients in China and emerging pathogenesis and therapy concepts [J]., 2020, 108(1): 17-41.
[12] Noreen M, Shah M A A, Mall S M,. TLR4 polymorphisms and disease susceptibility [J]., 2012, 61(3): 177-188.
[13] Yang J, Wang H X, Zhang Y J,. Astragaloside IV attenuates inflammatory cytokines by inhibiting TLR4/NF-кB signaling pathway in isoproterenol-induced myocardial hypertrophy [J]., 2013, 150(3): 1062-1070.
[14] Hariharan A, Hakeem A R, Radhakrishnan S,. The role and therapeutic potential of NF-kappa-B pathway in severe COVID-19 patients [J]., 2021, 29(1): 91-100.
[15] 陈聪, 史伟峰. 肺炎克雷伯菌毒力因子相关研究 [J]. 临床医药文献电子杂志, 2019, 6(82): 190-191.
[16] Fan Y Y, Wang J, Feng Z H,. Pinitol attenuates LPS-induced pneumonia in experimental animals: Possible role via inhibition of the TLR-4 and NF-κB/IκBα signaling cascade pathway [J]., 2021, 35(1): e22622.
[17] Regueiro V, Moranta D, Campos M A,.increases the levels of Toll-like receptors 2 and 4 in human airway epithelial cells [J]., 2009, 77(2): 714-724.
Mechanism of Qingkailing Oral Liquid in preventing and treatment of pneumonia based on TLR4/NF-κB signaling pathway
CHEN Hong-ying1, 2, LI Xin3, XU Jun3, ZHANG Tie-jun3, LI Qing3, OUYANG Dong-sheng1, XU Xu3
1. Department of Clinical Pharmacology, Xiangya Hospital, Central South University, Changsha 410008, China 2. Guangzhou Baiyunshan Mingxing Pharmaceutical Co., Ltd., Guangzhou 510250, China 3. Tianjin Key Laboratory of Quality Markers of Traditional Chinese Medicine, Tianjin Institute of Pharmaceutical Research, Tianjin 300301, China
To study the effect and mechanism of Qingkailing Oral Liquid (清开灵口服液, QKL) on pulmonary inflammation based on Toll-like receptor 4 (TLR4)/nuclear factor-κB (NF-κB) signaling pathway.SD rats were randomly divided into control group, model group, QKL low-, medium-and high-dose (4, 8, 16 mL/kg) groups and cephalexin (175 mg/kg) group. Each administration group was ig corresponding drugs for 6 d. Models were established at the same time of administration, and models were established by pulmonary injection ofsolution for 3 d, control group was injected with normal saline. After the administration, blood and bronchoalveolar lavage fluid (BALF) of rats were collected for colony culture and counting; Automatic blood cell analyzer was used to detect the number of white blood cells (WBC) and ratio of neutrophils and monocytes; ELISA was used to detect interleukin-1 (IL-1), IL-2, IL-6, IL-10, tumor necrosis factor-α (TNF-α), bradykinin (BK), monocyte chemotactic protein-1 (MCP-1) levels and cyclooxygenase-1 (COX-1), COX-2 activities in serum; Hematoxylin-eosin (HE) staining was used to observe the pathological changes of lung tissue in rats; Immunohistochemical staining was used to detect protein expression of TLR4 in lung tissue; Western blotting was used to detect protein expressions of phosphorylated p65 (p-p65), p65, phosphorylated inhibitor of NF-κB (p-IκB) and IκB in lung tissue.Compared with model group, number of colonies in whole blood and BALF after culture were significantly decreased in QKL group (< 0.05), number of WBCs and percentage of neutrophils and monocytes in whole blood were significantly decreased (< 0.05, 0.01), IL-1, IL-2, IL-6, IL-10, TNF-α, BK, MCP-1 levels and COX-1, COX-2 activities in serum were significantly reduced (< 0.05, 0.01); Inflammatory cell infiltration, erythrocyte exudation, and alveolar epithelial cell detachment in lung parenchyma were significantly reduced; TLR4 protein positive expression in lung tissue were significantly reduced, p-p65/p65 and p-IκB/IκB protein expressions were significantly decreased (< 0.05, 0.01).QKL has an inhibitory effect on pneumonia caused by, and its mechanism may be related to regulating TLR4/NF-κB signaling pathway.
; pneumonia; Qingkailing Oral Liquid; inflammation; Toll-like receptor 4/nuclear factor-κB signaling pathway
R285.5
A
0253 - 2670(2022)19 - 6101 - 07
10.7501/j.issn.0253-2670.2022.19.016
2022-06-24
国家重点研发计划项目(2019YFC1711304);国家自然科学基金资助项目(81830111)
陈红英,女,高级工程师,研究方向为中药新药研究。E-mail: 2215183393@qq.com
欧阳冬生,男,博士,博士生导师,研究方向为临床药理学。E-mail: 801940@csu.edu.cn
徐 旭,男,研究员,研究方向为中药产品开发与中药药理。Tel: (022)23006846 E-mail: xux@tipr.com.cn
[责任编辑 李亚楠]

