苦参碱通过调控HMGB1/NLRP3信号途径抑制慢性鼻-鼻窦炎小鼠炎症反应
李特,宋天喜,秦喜昕,王建
(1.重庆北部宽仁医院耳鼻咽喉科,重庆 401120;2.九江市第三人民医院耳鼻咽喉科,江西 九江 332000;3.陆军军医大学第三附属医院耳鼻咽喉头颈外科,重庆 400042)
慢性鼻-鼻窦炎(chronic rhinosinusitis,CRS)是一种慢性炎症性疾病,以慢性鼻塞、嗅觉减退和面部疼痛为特征[1]。CRS被认为是由遗传和环境因素共同驱动的复杂炎症过程的结果[2]。通常,CRS治疗策略主要通过减轻黏膜炎症、预防感染和清除鼻窦内黏液。CRS有多种治疗选择,包括生理盐水冲洗、局部鼻腔皮质类固醇喷雾、口服抗组胺药物和抗生素等[3]。即使在药物和手术治疗之后,CRS也会复发[4]。因此,迫切需要开发更有效、副作用最小、能够降低CRS复发率的治疗方法。研究显示,外界刺激通过NOD样受体家族包含pyrin结构域蛋白3(nod like receptor family pyrin domain containing 3,NLRP3)和Caspase-1亚基诱导活性氧的产生激活NLRP3炎性小体,导致鼻上皮细胞IL-1β的成熟和分泌,从而加重鼻部炎症反应[5]。高迁移率族蛋白-1(high mobility group box protein-1,HMGB1)是一种炎症分子,可介导NLRP3炎性小体的激活以促进IL-1β的产生,从而加重炎症反应[6]。目前,CRS的发病机制尚不明确,而关于HMGB1/NLRP3信号途径在CRS中的作用也尚未可知,需进一步探究。苦参碱是一种小分子化合物(相对分子质量:248),属于羽扇豆碱,具有抗癌、抗炎、抗氧化、抗病毒、抗菌、抗纤维化、抗过敏、抗伤害、保肝、护心和神经保护等多种药理作用[7]。已有证据显示,苦参碱可通过抑制HMGB1信号通路,抑制促炎细胞因子(如IL-6、TNF-α和TGF-β1)的释放,从而发挥抗癌作用[8]。目前,关于苦参碱在CRS中的作用及其可能的作用机制尚不明确。因此,本研究通过建立CRS小鼠模型,旨在探究苦参碱是否通过调控HMGB1/NLRP3信号途径在CRS中发挥作用,以期为明确苦参碱对CRS的作用机制及开发新的CRS治疗策略提供新的实验依据。
1 材料与方法
1.1 实验动物
SPF级雄性C57BL/6J小鼠42只,购自陆军军医大学动物实验中心,生产许可证号:SCXK(渝)20170002,体质量(20±2)g,6~8周龄。小鼠饲养于室温(24±2)℃,相对湿度40%~60%,12 h/12 h明暗交替环境下,自由饮水及进食。待小鼠适应环境1周后,进行后续实验操作。
1.2 主要材料
苦参碱(质量分数≥98%)购自成都曼思特生物技术有限公司;重组HMGB1蛋白(rHMGB1)购自北京百普赛斯生物科技股份有限公司;天狼星红染色液和甲苯胺蓝溶液(1%水溶液)购自北京索莱宝科技有限公司;IL-1β、IL-4、IL-6、TNF-αELISA检测试剂盒购自南京建成生物工程研究所;MUC5B和MUC5AC抗体购自英国Abcam公司;E-cadherin、N-cadherin、Vimentin、HMGB1和GAPDH抗体购自北京义翘神州科技股份有限公司;NLRP3抗体购自武汉三鹰生物技术有限公司;ASC和Cleaved caspase-1抗体购自Cell Signaling Technology。
1.3 模型建立与分组给药
将42只小鼠随机分为对照组、模型组、苦参碱低、中、高剂量组、苦参碱高剂量+rHMGB1组,每组7只。参考文献[9]建立CRS小鼠模型。麻醉小鼠后,于小鼠鼻背正中处做一横行约3 mm切口,钝性分离皮下组织,暴露上颌窦腔,于上颌窦左右两侧开口处磨一个直径约为1 mm的小孔。将含1 μL肺炎链球菌菌液(6×108CFU/mL)的膨胀海绵(海绵体积为1 mm3)植入窦腔内。随后逐层缝合皮肤切口。对照组小鼠行相同手术操作但不植入含肺炎链球菌菌液的膨胀海绵。造模后第8周,参考文献[10],记录造模组小鼠打喷嚏和挠鼻次数并按照表1所示进行评分,得分超过5分,则表示造模成功。随后,苦参碱低剂量组小鼠腹腔注射苦参碱7.5 mg/kg,苦参碱中剂量组小鼠腹腔注射苦参碱15 mg/kg,苦参碱高剂量组小鼠腹腔注射苦参碱30 mg/kg[11],苦参碱高剂量+rHMGB1组小鼠腹腔注射苦参碱30 mg/kg和20 μg rHMGB1[12],对照组小鼠腹腔注射等量溶剂。每天给药1次,连续给药2周。
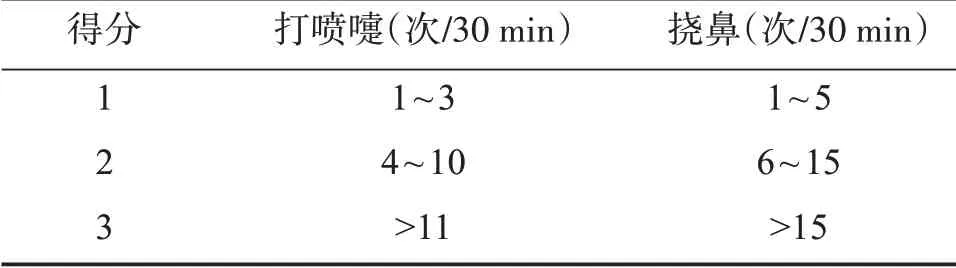
表1 小鼠打喷嚏和挠鼻评分标准Table 1 Scoring criteria of sneezing and nose scratching in mice
1.4 打喷嚏和挠鼻症状评分
末次给药24 h后,观察各组小鼠鼻部症状和一般情况。参考文献[10]和表1,对各组小鼠打喷嚏和挠鼻症状进行评分。
1.5 HE染色检测小鼠黏膜病理学变化
末次给药24 h后,小鼠经麻醉后处死。取小鼠鼻窦黏膜组织,4%(φ)多聚甲醛固定组织,梯度酒精脱水,二甲苯透明。组织块石蜡包埋,切片机切片。石蜡切片常规脱蜡至水,苏木素染色液染色15 min,切片流水冲洗1 min,1%盐酸乙醇分化3 s后,氨水返蓝,伊红染色液染色10 s后,流水冲洗。切片经脱水透明,中性树胶封固,显微镜下观察并拍照。对各组小鼠上皮增生进行评分,上皮增生评分标准[13]:无增生计0分;轻微几乎检测不到计1分;轻微可检测计2分;中度计3分;重度计4分。应用CellSens Standard 1.7图像分析系统测定鼻组织中嗅觉和呼吸上皮过渡区的最大黏膜厚度。
1.6 天狼星红染色检测小鼠黏膜嗜酸性粒细胞的产生
鼻窦黏膜石蜡切片脱蜡至水,蒸馏水清洗3次后,天狼星红染色液滴染1 h,流水冲洗后,无水乙醇快速冲洗切片,常规脱水透明,中性树胶封固。Image J软件对阳性细胞数进行计数。
1.7 甲苯胺蓝染色检测小鼠肥大细胞浸润
鼻窦黏膜石蜡切片脱蜡至水,蒸馏水清洗3次后,添加甲苯胺蓝染液染色30 min。流水冲洗后,95%(φ)乙醇分色,常规脱水透明,中性树胶封固。Image J软件分析阳性面积。
1.8 ELISA试剂盒检测小鼠血清中IL-1β、IL-4、IL-6和TNF-α含量
末次给药24 h后,小鼠腹主动脉采血。将血液于室温条件下静置1 h后,3 000 r/min离心10 min收集上清液,即为血清。血清置于-80℃条件下保存。
1.9 Western blot检测小鼠MUC5B、MUC5AC、E-cadherin、N-cadherin、Vimentin、HMGB1、NLRP3、ASC和Cleaved caspase-1蛋白表达
取小鼠鼻窦黏膜组织,加入RIPA裂解液,冰上反应30 min后,离心收集上清液并通过BCA法测定其蛋白浓度。取30 μg蛋白上样,进行SDS-PAGE凝胶电泳和转膜操作。5%脱脂奶粉室温条件下孵育3 h。向细胞中添加MUC5B(1∶1 000)、MUC5AC(1∶1 000)、E-cadherin(1∶2 000)、N-cadherin(1∶1 000)、Vimentin(1∶1 000)、HMGB1(1∶2 000)、NLRP3(1∶1 000)、ASC(1∶1 000)、Cleaved caspase-1(1∶1 000)和GAPDH(1∶5 000)抗体稀释液,4℃条件下孵育过夜。添加特异性二抗(1∶5 000),室温条件下孵育1 h。滴加ECL发光液,凝胶成像系统检测蛋白条带,Image J软件分析各蛋白条带的灰度值。
1.10 统计学分析
采用SPSS 21.0软件进行数据统计分析,实验数据以表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 苦参碱对CRS小鼠临床症状的影响
造模前,各组小鼠精神状态良好,皮毛光滑,饮食规律。造模后,对照组小鼠无明显异常,其余组小鼠少量进食、饮水,可见流涕、频繁挠鼻、打喷嚏,鼻腔内有少量分泌物。经药物干预2周后,苦参碱低、中、高剂量组和苦参碱高剂量组+rHMGB1组小鼠上述症状有明显改善,而苦参碱高剂量+rHMGB1组小鼠较苦参碱高剂量组症状更为明显。与对照组相比,模型组小鼠症状评分明显升高(P<0.05);与模型组相比,苦参碱低、中、高剂量组和苦参碱高剂量+rHMGB1组小鼠症状评分明显降低(P<0.05),且苦参碱的作用呈剂量依赖性;与苦参碱高剂量组相比,苦参碱高剂量+rHMGB1组小鼠症状评分明显升高(P<0.05)。结果见图1。
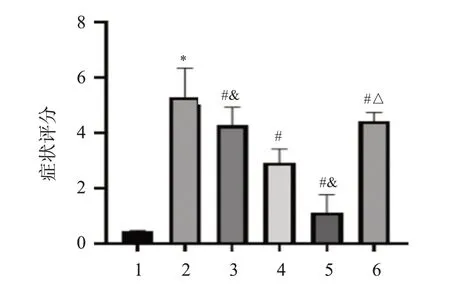
图1 各组小鼠症状评分的比较Figure 1 Comparison of symptom scores of mice in each group
2.2 苦参碱对CRS小鼠鼻窦黏膜病理学变化的影响
对照组小鼠鼻窦黏膜上皮组织结构无明显异常,排列整齐,无明显炎性细胞浸润和腺体增生。与对照组相比,模型组小鼠鼻窦黏膜出现明显病变,黏膜上皮排列紊乱,有明显炎性细胞浸润,上皮增生评分、最大黏膜厚度、嗜酸性粒细胞数和甲苯胺蓝面积均明显升高(P<0.05);与模型组相比,苦参碱低、中、高剂量组和苦参碱高剂量+rHMGB1组小鼠鼻窦黏膜病理学变化得到明显改善,上皮增生评分、最大黏膜厚度、嗜酸性粒细胞数和甲苯胺蓝面积均明显降低(P<0.05),且苦参碱的作用呈剂量依赖性;与苦参碱高剂量组相比,苦参碱高剂量+rHMGB1组小鼠鼻窦黏膜病变加深,上皮增生评分、最大黏膜厚度、嗜酸性粒细胞数和甲苯胺蓝面积均明显升高(P<0.05)。结果见图2-5。
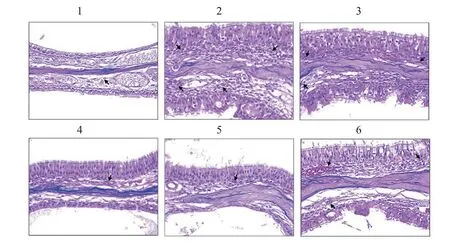
图2 HE染色检测各组小鼠黏膜病理学变化(200×)Figure 2 Mucosal pathological changes in mice of each group by HE staining(200×)
2.3 苦参碱对CRS小鼠炎症反应的影响
与对照组相比,模型组小鼠血清中IL-1β、IL-4、IL-6和TNF-α含量明显升高(P<0.05);与模型组相比,苦参碱低、中、高剂量组和苦参碱高剂量+rHMGB1组小鼠血清中IL-1β、IL-4、IL-6和TNF-α含量明显降低(P<0.05),且苦参碱的作用呈剂量依赖性;与苦参碱高剂量组相比,苦参碱高剂量+rHMGB1组小鼠血清中IL-1β、IL-4、IL-6和TNF-α含量明显升高(P<0.05)。结果见图6。
2.4 苦参碱对CRS小鼠杯状细胞黏蛋白分泌的影响
与对照组相比,模型组小鼠黏膜组织中MUC5B和MUC5AC蛋白表达明显升高(P<0.05);与模型组相比,苦参碱低、中、高剂量组和苦参碱高剂量+rHMGB1组小鼠黏膜组织中MUC5B和MUC5AC蛋白表达明显降低(P<0.05),且苦参碱的作用呈剂量依赖性;与苦参碱高剂量组相比,苦参碱高剂量+rHMGB1组小鼠黏膜组织中MUC5B和MUC5AC蛋白表达明显升高(P<0.05)。结果见图7-8。
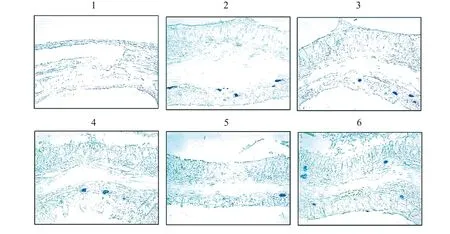
图4 甲苯胺蓝染色检测各组小鼠肥大细胞浸润(200×)Figure 4 Mast cell infiltration of mice in each group detected by toluidine blue staining(200×)

图5 各组小鼠鼻窦黏膜病理学变化的比较Figure 5 Comparison of pathological changes of sinus mucosa in mice of each group
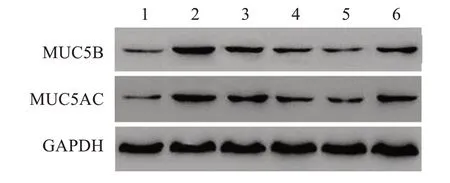
图7 Western blot检测各组小鼠MUC5B和MUC5AC蛋白表达Figure 7 Expressions of MUC5B and MUC5AC protein in mice of each group by Western blot
2.5 苦参碱对CRS小鼠EMT的影响
与对照组相比,模型组小鼠黏膜组织中E-cadherin蛋白表达明显降低(P<0.05),N-cadherin和Vimentin蛋白表达明显升高(P<0.05);与模型组相比,苦参碱低、中、高剂量组和苦参碱高剂量+rHMGB1组小鼠黏膜组织中E-cadherin蛋白表达明显升高(P<0.05),N-cadherin和Vimentin蛋白表达明显降低(P<0.05),且苦参碱的作用呈剂量依赖性;与苦参碱高剂量组相比,苦参碱高剂量+rHMGB1组小鼠黏膜组织中E-cadherin蛋白表达明显降低(P<0.05),N-cadherin和Vimentin蛋白表达明显升高(P<0.05)。结果见图9-10。
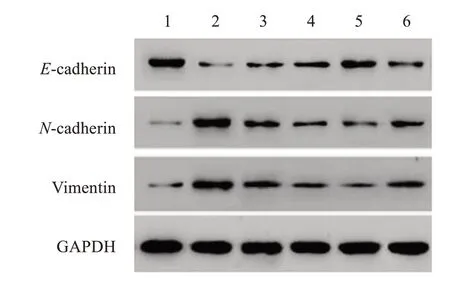
图9 Western blot检测 各 组 小鼠E-cadherin、N-cadherin和Vimentin蛋白表达Figure 9 Expressions of E-cadherin,N-cadherin and Vimentin proteins in each group by Western blot
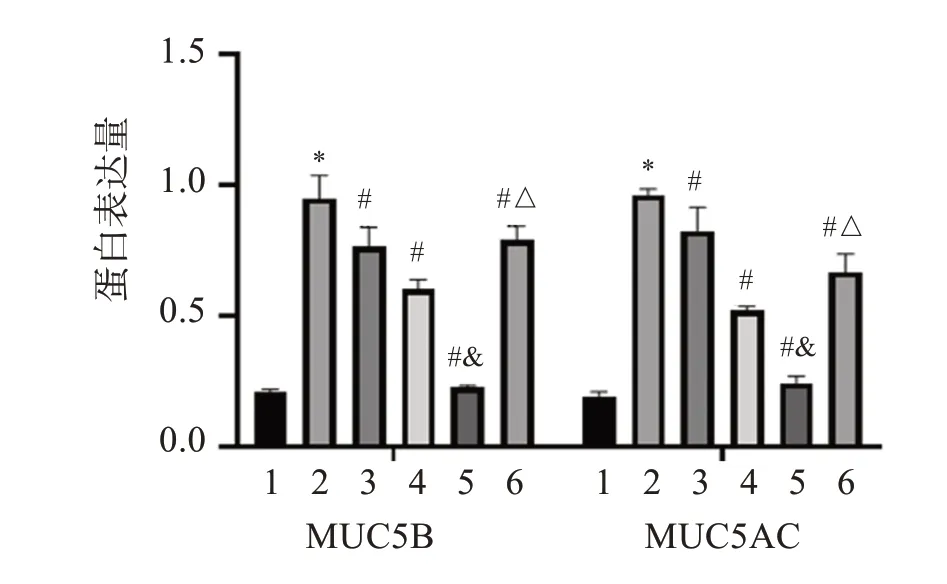
图8 各组小鼠MUC5B和MUC5AC蛋白表达的比较Figure 8 Comparisons of MUC5B and MUC5AC protein expressions in mice of each group(±s,n=7)
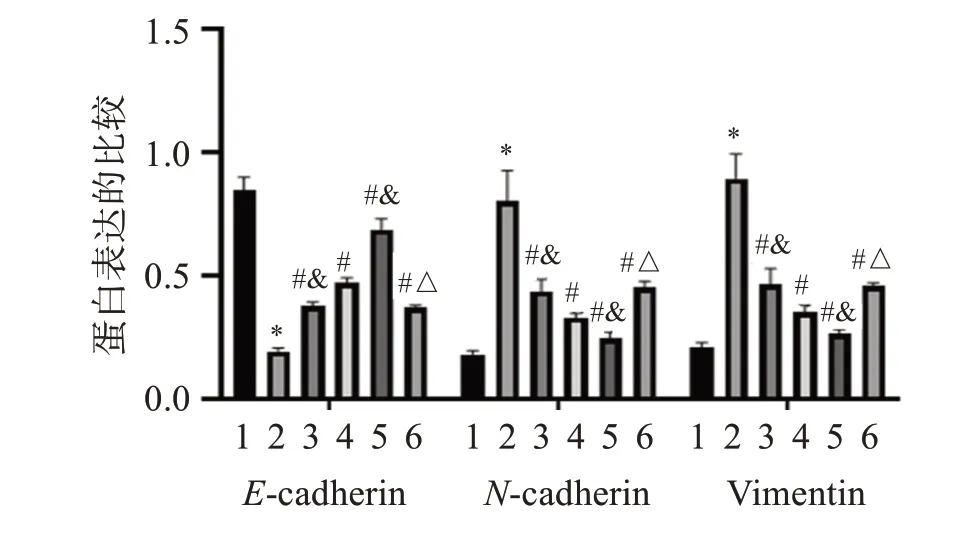
图10 各组小鼠E-cadherin、N-cadherin和Vimentin蛋白表达的比较Figure 10 Comparison of E-cadherin,N-Cadherin and Vimentin proteins expressions in mice of each group
2.6 苦参碱对CRS小鼠HMGB1/NLRP3信号通路的影响
与对照组相比,模型组小鼠黏膜组织中HMGB1、NLRP3、ASC和Cleaved caspase-1蛋白表达明显升高(P<0.05);与模型组相比,苦参碱低、中、高剂量组和苦参碱高剂量+rHMGB1组小鼠黏膜组织中HMGB1、NLRP3、ASC和Cleaved caspase-1蛋白表达明显降低(P<0.05),且苦参碱的作用呈剂量依赖性;与苦参碱高剂量组相比,苦参碱高剂量+rHMGB1组小鼠黏膜组织中HMGB1、NLRP3、ASC和Cleaved caspase-1蛋白表达明显升高(P<0.05)。结果见图11-12。
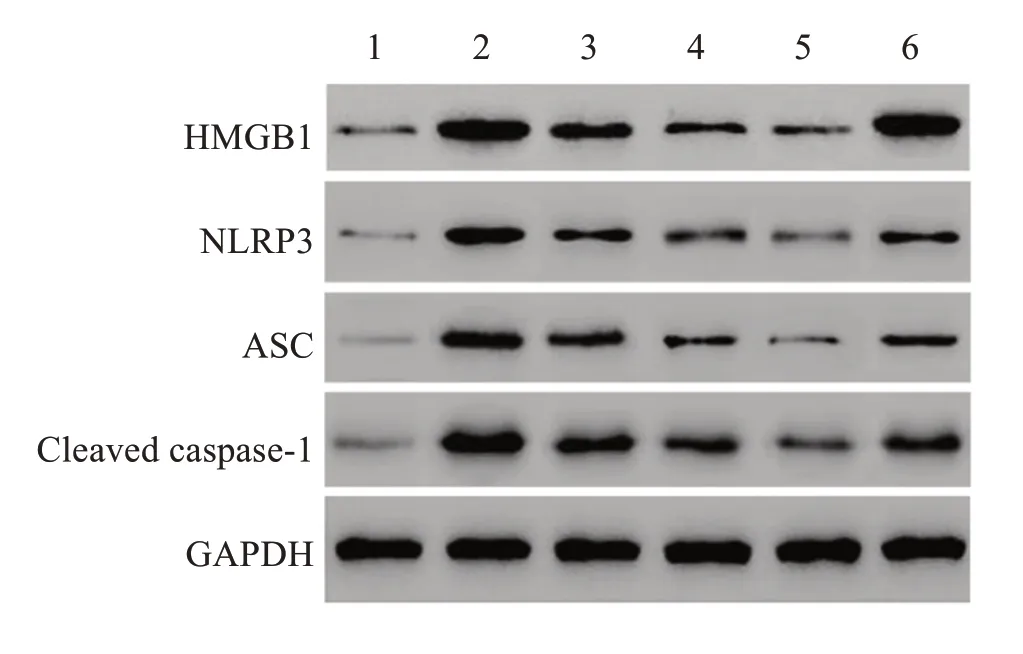
图11 Western blot检测各组小鼠HMGB1、NLRP3、ASC和Cleaved caspase-1蛋白表达Figure 11 Expressions of HMGB1,NLRP3,ASC and Cleaved caspase-1 proteins in each group by Western blot

图12 各组小鼠HMGB1、NLRP3、ASC和Cleaved caspase-1蛋白表达的比较Figure 12 Comparison of HMGB1,NLRP3,ASC and Cleaved caspase-1 proteins expressions in mice of each group
3 讨论
CRS作为一种发病率高的疾病,除了给卫生保健系统带来巨大的经济负担外,还严重影响患者的生活质量[14]。因此,需开发新的、有效的疾病治疗策略以改善CRS疾病现状。本研究通过建立CRS小鼠模型,旨在探究苦参碱在小鼠CRS发生发展中的作用。本研究结果显示,苦参碱可通过抑制HMGB1/NLRP3信号途径,减轻CRS的EMT、炎症反应和黏液分泌,从而在CRS中发挥治疗作用。
CRS患者以一系列炎症介质(如前列腺素和白细胞介素)上调和炎性细胞浸润(如嗜酸性粒细胞、中性粒细胞、肥大细胞和巨噬细胞)为特征[15]。组织重塑是伤口修复的关键过程,但当调控不当时,可导致以气道上皮、固有层和黏膜下区域变化为特征的病理重建,从而导致各种慢性气道疾病(包括CRS)[16]。证据显示,上皮-间充质转化(epithelial mesenchymal transition,EMT)参与组织重塑过程,与CRS的发展有关[17]。因此,靶向抑制CRS的EMT和炎症反应可能是CRS的潜在治疗策略。苦参碱具有抗炎和抗EMT作用,可能成为治疗炎症和氧化应激相关疾病的潜在药物。例如,苦参碱通过抑制核因子κB(nuclear factor kappa-B,NF-κB)信号通路,减轻气道上皮细胞和哮喘小鼠炎症因子的产生、炎症细胞浸润、杯状细胞分化和黏液生成[18]。苦参碱还可上调上皮细胞特异性标志物E-cadherin表达,下调间质细胞标志物N-cadherin和Vimentin表达,从而抑制胰腺癌细胞EMT[19]。此外,苦参碱对小鼠结肠炎中有明显的治疗作用。苦参碱通过减少出血和腹泻以及下调炎症因子(IL-1β和TNF-α)的表达来减轻结肠损伤和肠道炎症[20]。本研究结果显示,苦参碱低、中、高剂量组均可减少CRS小鼠临床症状,改善鼻窦黏膜病理学变化,抑制上皮增生、嗜酸性粒细胞和肥大细胞浸润和降低黏膜厚度,抑制IL-1β、IL-4、IL-6和TNF-α的产生,抑制黏蛋白MUC5B、MUC5AC和EMT相关蛋白N-cadherin和Vimentin的表达,促进E-cadherin表达,且苦参碱的作用呈剂量依赖性。该研究结果表明,苦参碱可抑制CRS小鼠炎症反应、黏液分泌和EMT,从而发挥治疗作用。
HMGB1是一种促炎介质,属于alarmin家族,在炎症和感染的刺激下,由单核细胞、巨噬细胞和树突状细胞释放到细胞间隙,也可以由死亡细胞释放[21]。HMGB1在不同的急性和慢性免疫疾病中发挥关键作用[22]。它不仅通过多种炎症因子和促炎细胞刺激免疫系统产生炎症反应,而且还参与NLRP3炎性小体的激活[23]。NLRP3炎性小体的异常激活与糖尿病、动脉粥样硬化、代谢综合征、心血管和神经退行性疾病等多种疾病有关,这引起了人们对探索NLRP3炎性小体潜在抑制剂的巨大兴趣[24],例如,异丙酚预处理可使HMGB1依赖的NLRP3炎性小体信号失活,抑制TNF-α、IL-6、IL-1β和IL-18的产生,从而减轻LPS诱导的乳鼠心肌细胞炎症和凋亡[25]。已有证据显示,HMGB1参与CRS疾病进展,与疾病严重程度、嗜酸性粒细胞浸润、促炎细胞因子水平和EMT过程密切相关。靶向抑制HMGB1在治疗CRS疾病中具有潜在的应用价值[26]。目前,已有证据证明,苦参碱可通过抑制HMGB1通路信号转导和NLRP3炎性小体的激活,降低TNF-α、IL-1β、IL-6和IL-1β炎症因子的产生,从而发挥疾病治疗作用[26-28]。本研究结果显示,CRS小鼠鼻窦黏膜中HMGB1、NLRP3、ASC和Cleaved caspase-1蛋白表达升高,而低、中、高剂量苦参碱处理CRS小鼠后,可降低HMGB1、NLRP3、ASC和Cleaved caspase-1蛋白表达,且苦参碱的作用呈剂量依赖性。进一步实验结果显示,rHMGB1处理可部分逆转苦参碱对CRS小鼠的作用,导致HMGB1、NLRP3、ASC和Cleaved caspase-1蛋白表达明显升高,从而促进炎症反应、黏液分泌和EMT,加快小鼠CRS疾病进展。该研究结果表明,苦参碱通过介导HMGB1依赖的NLRP3炎性小体信号失活,在CRS小鼠中发挥治疗作用。
综上所述,本研究结果表明,苦参碱呈剂量依赖性抑制CRS小鼠炎症反应、黏液分泌和EMT,从而对CRS小鼠发挥保护作用。苦参碱在CRS小鼠中的作用机制可能与抑制HMGB1依赖的NLRP3炎性小体激活相关。该研究结果为阐明苦参碱在CRS小鼠中的作用机制及开发新的CRS治疗策略提供了新的实验依据。

