短肽(Pro-His-Pro, PHP)预防酒精性肝损伤
陈杉彬,赵德义,姚逸萍,曹建全,赵文梅,孙伟, 杨海存,王德良,刘建波,郝飞克*
1(中国食品发酵工业研究院有限公司,北京,100015)2(山东景芝白酒有限公司,山东 安丘,262100) 3(酒类品质与安全国际联合研究中心,北京,100015)
过量酒精摄入可能会导致多种疾病,包括肝脏疾病、口咽癌、食管癌、结肠癌等重大疾病和肌肉损失、记忆力衰退等潜在疾病[1-2],其中酒精中毒和肝硬化是世界范围内最严重的健康问题[3]。这些疾病受多方面影响,大量研究证实了氧化应激在酒精性疾病中的关键作用[4-5]。过量消耗酒精会导致肝脏产生大量的氧自由基,如超氧物、H2O2和·OH等。自由基参与了许多重要的生命过程,过量的自由基会破坏细胞原本的氧化稳态平衡,就会对细胞的完整性造成损害,对细胞造成氧化损伤。酒精会诱导氧化应激和活性氧的产生,诱导造成的氧化压力对细胞大分子造成的严重损伤持续存在的同时,还可能会引起机体器官生理功能障碍[6-8]。自由基的堆积会引起生物大分子损伤,蛋白质、脂质和DNA是主要攻击靶点,过量的自由基造成氧化应激损伤,如脂质的破坏、酶的失活、引起DNA突变以及细胞膜的破坏,最终导致整个细胞被破坏,器官和系统的结构、形态、功能异常[9-10]。
普遍认为,由2~9个氨基酸残基所组成的小肽具有抗氧化活性,能够提高机体免疫能力、抗疲劳、提高免疫调节、抗菌,抗应激、镇定、抗肿瘤、促进酒精代谢。从宣威火腿中提取的六肽(NPPKFD)可以预防自由基引起的疾病,还能够防止酒精诱导造成的氧化应激损伤[11]。亚麻环肽在亚麻籽油氧化过程中扮演着重要角色,具有较高的潜在药物价值,或可用作药物替代品[12]。短肽添加到动物饲料中,作为营养物质能够对动物的消化液、激素分泌和免疫功能等产生影响[13]。首次从白酒酒醅中发现的多肽Lys-Gly-Pro(KGP)和al-Pro-Asp(PD)具有很强的自由基清除能力,可能具有缓解氧化损伤的作用[14]。从白酒中检测到三肽Pro-His-Pro(PHP),已被证明具有一定的体外抑制血管紧张素转换酶的能力,但其他方面仍未有深入研究。
小肽具体的抗氧化功能机理还不明晰,为探究其中可能的功能成分,利用高效液相色谱-四级杆-飞行时间质谱法(high performance liquid chromatography-quadrupole-time of flight-mass spectrometry,HPLC-Q-TOF-MS)从一品景芝酒酒样中检测到一种三肽Pro-His-Pro(PHP),从体内、体外两方面论证三肽PHP在肝损伤中的作用。
1 材料与方法
1.1 实验材料、试剂
Pro-His-Pro(PHP),纯度≥98%,吉尔生化有限公司,用超纯水配制为150 g/L试剂保存,实验时溶于52%ol食用酒精中。
人源肝细胞LO2,国家实验细胞资源共享服务平台,经本实验室传代后液氮保存。
实验动物,斯贝福生物技术有限公司,为49~56日龄雄性C57BL/6J小鼠,体重18~22 g,动物饲养温度为(23±2)℃,相对湿度为(50±5)%,光照时间12 h/d,自由饮食,5只/笼,合笼饲养,实验动物的相关处理均严格遵守实验动物福利伦理与保护相关规定,并随时接受实验动物伦理委员会的监督与检查。许可证号为(JK)2021-W-003。
偶氮二异丁脒盐酸盐(2,2′-azobis-2-methyl-propanimidamide,AAPH),纯度≥98%,苏州亚科公司;胎牛血清(fetal boine serum, FBS)、0.25%胰蛋白酶,Geminig公司;RPMI-1640培养液、双抗青链霉素,GIBCO公司;细胞培养皿、96孔板、6孔板,康宁公司;CCK8试剂盒,日本同仁化学研究所;lysis buffer,贝博生物公司;超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽还原型(glutathione reduction,GSH)、丙二醛(malondialdehyde,MDA)、谷丙转氨酶(glutamic-pyruic transaminase,ALT)、谷草转氨酶(glutamic oxalacetic transaminase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、总胆固醇(total cholesterol,TC)、血清中甘油三酯(triacylglycerol,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒,南京建成生物公司;PDF膜,默克公司;5×蛋白质上样缓冲液、BCA试剂盒,索莱宝公司;Marker,Bio-Rad公司;一抗:Nrf2、Keap1,英国Proteintech公司;GAPDH、二抗:Rabbit,美国CST公司;ECL曝光液,美国Merck millipore公司。
1.2 仪器与设备
NMYC-60C转移脱色摇床,泰州诺米医疗器械有限公司;BG-power600、转膜仪BG-erBLOT 101-540-001,北京百晶生物技术有限公司;chemiscope 6200化学发光成像系统,北京市六一仪器厂;WD-9405B型水平摇床,沃德生物医学仪器分公司;Mini-PROTEAN Tetra 电泳槽,美国Bio-Rad公司;Heraeus Pico 17离心机,美国赛默飞世尔科技公司;Eclipse Ci-L光学显微镜,日本尼康公司。
1.3 实验方法
1.3.1 细胞存活率测定
取处于指数生长期的LO2细胞,加入适量0.25%胰蛋白酶消化约2 min。用完全培养液(含10% FBS与1%双抗的RPMI-1640培养液,下同)重悬细胞并接种于96孔板,每孔100 μL,细胞量1.6×104。分为空白组、正常对照组和不同剂量PHP组(0~6.4 mg/mL),每组设3个复孔,培养箱中培养24 h后,取出培养板,每孔加入100 μL CCK8预混液[(完全培养液)∶(CCK8)=9∶1],继续培养2 h后用酶标仪于450 nm处测定每孔的吸光度值,重复3次,细胞存活率按公式(1)计算:

(1)
式中:OD实验组,测定孔吸光度值;OD空白孔,无添加吸光度值;OD正常对照组,只加RPMI-1640培养基处理细胞吸光度值。
1.3.2 细胞氧化指标测定
取处于指数生长期的LO2细胞,加入适量0.25%胰蛋白酶消化约2 min。用完全培养液重悬细胞并接种于6孔板,每孔2 mL,细胞量2×105。分为空白对照组、AAPH处理组(400 μmol/L)、低剂量PHP组(1 mg/mL)、中剂量PHP组(3 mg/mL)和高剂量PHP组(6 mg/mL),分别用PHP预处理21 h后,用PHP+AAPH同时处理3 h,冷PBS清洗2遍后,用lysis buffer裂解细胞,进行BCA定量,测量CAT、GSH、SOD和MDA含量,并加入5×蛋白质上样缓冲液制样,操作步骤按照试剂盒使用说明书进行。
1.3.3 实验动物分组与造模
实验小鼠适应性喂养一周后,将50只小鼠随机分成5组,包括空白对照、食用酒精组、PHP低剂量组、PHP中剂量组、PHP高剂量组。其中食用酒精组、PHP低剂量组、PHP中剂量组和PHP高剂量组分别腹腔注射相同剂量的52%ol食用酒精,其中PHP低剂量组、PHP中剂量组、PHP高剂量组分别每天注射0.1、0.2和0.4 g/kg·bw PHP,培养30 d后,最后一次注射后禁食不禁水,8 h后,眼球取血,颈椎脱臼处死小鼠,取肝脏组织和血液进行后续实验,其中,将右半部肝脏组织通过10%中性多聚甲醛固定制备石蜡切片,肝脏组织病理学变化采用HE染色后观察;其余肝脏存-80 ℃低温冰箱保存备用。
1.3.4 小鼠肝脏组织病理学检查
肝脏组织用10%中性多聚甲醛固定24 h后转入70%(体积分数,下同)酒精溶液中脱水处理24 h,常规石蜡包埋后制作厚度约4 μm的切片,使用C8H10进行脱蜡处理,酒精梯度(95%、90%、80%、75%)脱水;苏木精染色;盐酸醇分化;0.5%伊红染色后常规梯度酒精(75%、80%、90%、95%)脱水后经100%乙醇I(10 min),100%乙醇II(10 min);最后经二甲苯透明后中性树胶封片,在光学显微镜下,选取不同的视野拍照并分析肝脏组织病理学变化。
1.3.5 小鼠肝功能和血脂水平的检测
小鼠眼球取血,静置30 min,3 000 r/min离心10 min,得到血清,并将其转移至-80 ℃进行低温保存。通过赖氏法检测血清转氨酶AST和ALT水平,具体操作步骤严格按照试剂盒使用说明书进行。小鼠体内血清中TC、TG、HDL-C和LDL-C的水平分别通过COD-PAP法、GPO-PAP酶法、直接检测法进行测定。具体操作步骤严格按照试剂盒使用说明书进行。
1.3.6 Western Blot 实验操作
将所有蛋白样品进行上样,每个胶孔上样10 μL,样品两侧的泳道用10 μL的Marker进行上样,空白胶孔加入10 μL 1× Loading Buffer补齐。每块胶以20 mA的电流强度进行恒流电泳。在目的蛋白泳动至距胶下缘1 cm以上时结束或在溴酚蓝到达胶的底端附近即可停止电泳,关闭电源,进行转膜。将PDF膜完全浸湿于甲醇中,将胶卸下后保留分离胶,将转膜夹黑面朝下,并按照海绵-滤纸-胶-PDF膜-滤纸-海绵的顺序逐层摆放,将转膜夹合上夹紧后放到转膜槽中,加入适量电转缓冲液。并置于冰水混合物中,恒压120 ,运行60 min。将膜取出后用5%(质量分数)脱脂奶粉封闭液封闭,50 r/min,1 h。按照Marker标记的区间将整张膜裁剪成合适的大小加入适量封闭液,按1:1 000的比例加入相应的一抗,4 ℃孵育过夜。在室温条件下用TBS/T漂洗3次,每次5 min。按照1:5 000的比例加入相应的二抗,室温,摇床孵育40 min。结束后,用TBS/T漂洗膜3次,每次5 min。进行化学显影。
1.3.7 数据分析
用SPSS 23.0分析处理数据,组间检验采用t检验,P<0.01具有极显著差异(用**表示);P<0.05具有显著差异(用字母标记法表示),所有实验数据均为3个平行试验的平均值,用平均值±标准误表示;图表由Origin 2018绘制。
2 结果与分析
2.1 对细胞存活率及相关氧化指标的影响
用不同质量浓度(0~6.4 mg/mL)的PHP处理LO2细胞24 h,与空白组相比较的结果见图1-a。细胞存活率均在80%以上,PHP对LO2细胞增殖无明显影响和毒性作用,细胞活力正常。
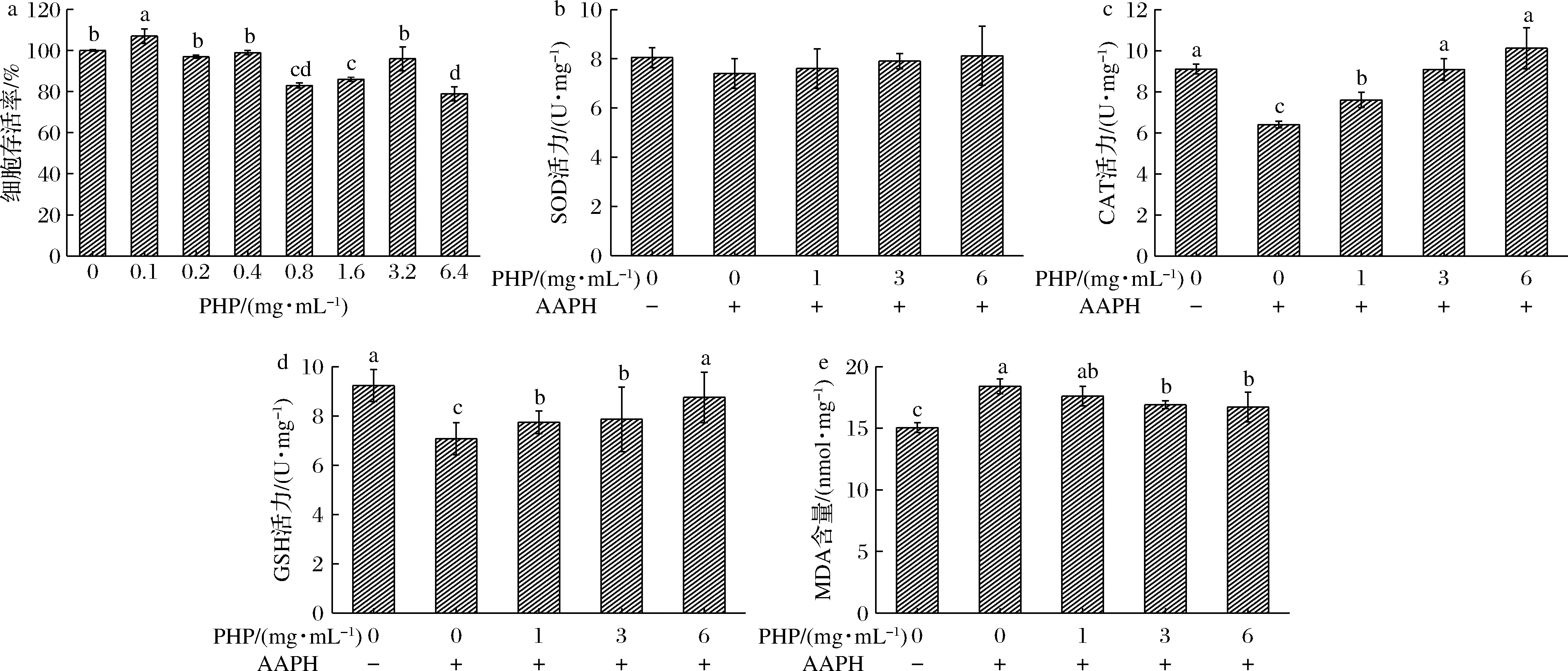
a-细胞存活率;b-SOD;c-CAT;d-GSH;e-MDA图1 不同浓度PHP处理细胞的细胞存活率、SOD、CAT、GSH活力和MDA含量Fig.1 The cell iability enzyme actiity of SOD, CAT, GSH, and MDA content in different dose PHP treatment 注:不同小写字母表示具有显著差异(P<0.05)(下同)
选用0~6 mg/mL进行后续实验,参考其他文献[15],选用AAPH(400 μmol/L)处理3 h进行氧化损伤模型构造,由图1-b~图1-e结果可知,与空白组相比较,氧化相关指标CAT、GSH活力均呈现不同程度的降低,MDA含量升高,均呈显著性差异。SOD活力随PHP浓度升高而略微升高。MDA含量随PHP浓度升高呈现降低趋势,与AAPH处理组间呈显著差异(P<0.05)。CAT和GSH活力均随PHP浓度升高而升高,与AAPH处理组间呈显著差异(P<0.05)。综合来看,小肽PHP能缓解AAPH造成的氧化应激损伤,维持机体的氧化稳态,可能是通过调控氧化应激信号通路的响应机制,使抗氧化物含量增加,缓解氧化压力。
2.2 对细胞氧化通路的影响
小肽PHP能够调控抗氧化物含量的增加,转录因子NF-E2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)是调节蛋白CNC(CapN’ collar-bZIP)家族成员的转录激活因子,主要和胞浆蛋白伴侣分子(Kelch-like ECH-associated protein 1, Keap1)结合。在正常生理条件下,Nrf2的表达具有一定的稳定性,通过泛素化以及蛋白酶体的降解作用维持和Keap1的动态平衡。当机体出现过量活性氧时,使Nrf2在胞浆内持续累积并转移进入细胞核,进而结合基因启动子区的ARE序列,通过激活下游抗氧化基因来保护细胞免受活性氧应激物引起的损伤[16]。由图2-a可知,与对照组相比,AAPH中Nrf2大量聚集,且在一定范围内,随PHP浓度的升高而升高。同时,蛋白Keap1随PHP浓度增高而略微增加,但在PHP为6 mg/mL时,Keap1蛋白较大幅度降低。明显可以观察到Nrf2是和Keap1解偶联进入细胞核中进行相关表达发挥功能。其半定量结果与免疫印迹结果基本一致。
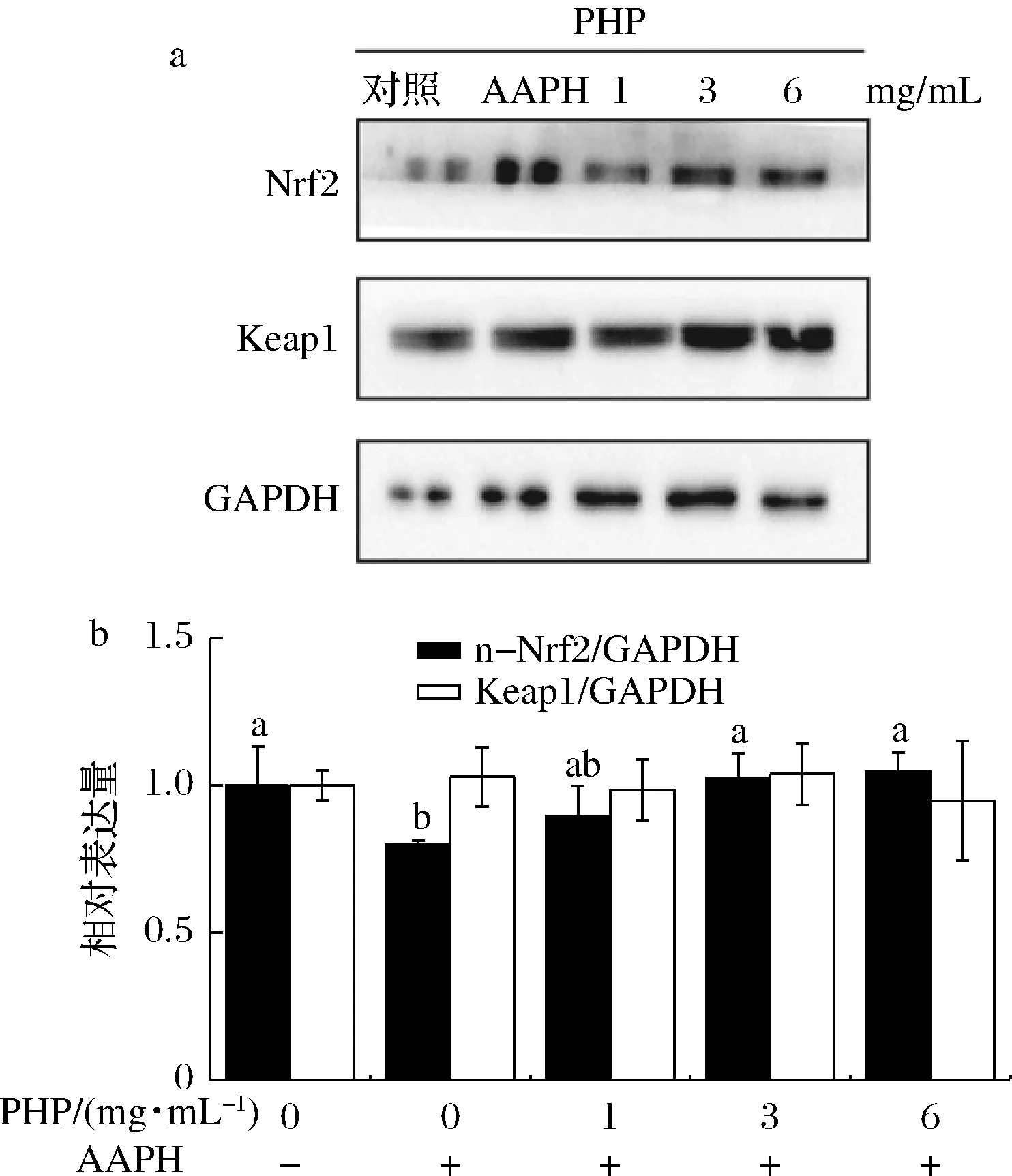
a-细胞氧化通路关键蛋白表达;b-半定量分析图2 不同浓度PHP处理细胞氧化通路关键 蛋白表达和半定量分析Fig.2 The expression and expression leels of n-Nrf2, Keap1 were detected by western blotting analysis
2.3 对小鼠肝组织病理形态学的影响
通过苏木精-伊红染色,由图3-a小鼠肝组织病理形态可见,空白对照组小鼠肝组织基本无明显病理变化,肝组织排列紧密,肝细胞正常生长,无变性情况;食用酒精组小鼠局部肝细胞小灶性干酪样坏死,胞核溶解,胞浆嗜酸性增强,伴少量炎性细胞浸润。低浓度PHP组出现肝细胞胞浆疏松淡染,有少量的炎性细胞浸染(图3-c);中浓度PHP组肝细胞胞浆疏松淡染,伴随一定量的炎性细胞(图3-d);高浓度PHP组少量的中性粒细胞浸润,炎性细胞小灶性浸润(图3-e)。长期饮酒对肝细胞产生一定影响,主要包括肝细胞变性、炎性侵染等,但不同处理均有一定差别,PHP处理后,肝细胞状态优于未处理组,PHP能够对食用酒精造成的肝损伤起到一定的保护作用,能够减少酒精带来的肝损伤危害。
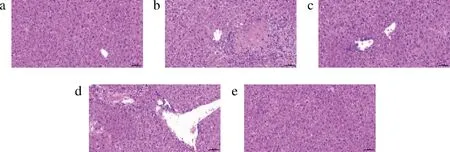
a-空白对照组;b-食用酒精组;c-PHP低剂量组; d-PHP中剂量组;e-PHP高剂量组图3 各组小鼠肝组织病理形态Fig.3 Hepatic histological morphology of mice in each group
2.4 对小鼠肝脏功能和血脂水平的影响
如图4所示,与食用酒精组比较,PHP处理组小鼠在血清中AST、ALT活力均有一定程度降低,且在ALT活力上具有显著性差异(P<0.05)。不同浓度PHP处理组AST活力分别是食用酒精组的0.936倍、0.909倍和0.894倍,但无显著性差异。而不同浓度PHP处理组ALT活力不同程度的低于食用酒精组,其中中高剂量处理组与食用酒精组相比出现显著性差异。不同浓度PHP处理组ALP活力与食用酒精组无显著性差异。与食用酒精组相比,PHP不同剂量组小鼠血清中TC、TG、LDL-C含量相较食用酒精组出现降低的现象(P<0.05),同时HDL-C含量上升;表明PHP能够在一定程度上缓解食用酒精造成的肝损伤,但无法使这种损伤恢复至初始状态。
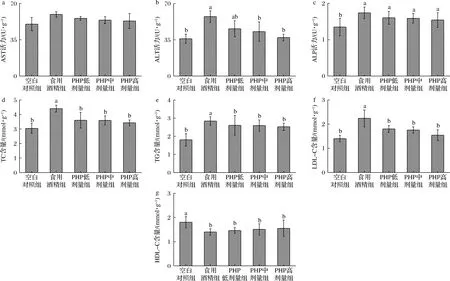
a-AST;b-ALT;c-ALP;d-TC;e-TG;f-LDL-C;g-HDL-C图4 不同浓度PHP处理对小鼠血清AST、ALT、ALP活性和TC、TG、LDL-C、HDL-C含量的影响Fig.4 The effect of PHP treatment on serum AST, ALT, and ALP actiity and TC, TG, LDL-C, and HDL-C content in mice
2.5 对小鼠氧化相关指标的影响
酶类抗氧化系统主要包括SOD、CAT、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的GSH。其中MDA是氧化损伤造成脂质过氧化的终产物,它在细胞内过量累积会引起细胞代谢紊乱或功能缺失,最终可能导致细胞死亡,因此可以用抗氧化系统中的抗氧化酶和MDA含量反映机体细胞氧化损伤程度[17-18]。由图5可知,与食用酒精组相比,PHP不同剂量处理组在氧化相关指标CAT、GSH、SOD活力相较食用酒精组出现不同程度的升高,能够使MDA不同程度的降低,但从SOD和GSH方面来看,不同浓度处理组相较于食用酒精组没有出现显著性差异,可能是抗氧化酶在对抗氧自由基时已经消耗。综合来看,酒精可能是通过影响氧化相关酶来造成肝损伤,PHP能够提高氧化酶的活力进而恢复肝细胞内氧化平衡,在一定程度上保护酒精造成的肝损伤。
3 结论与讨论
为探究一品景芝酒中可能的有益成分,利用HPLC-Q-TOF-MS从一品景芝酒酒样中检测到一种三肽PHP。为探究PHP对缓解酒精性肝损伤可能的作用机理,通过使用不同浓度的PHP对人源肝细胞LO2及C57小鼠进行处理,观察在氧化应激条件下的LO2细胞情况及诱导型小鼠酒精性肝损伤的影响作用。通过AAPH处理LO2细胞后,测定其相应抗氧化物酶含量,均能够提高抗氧化酶活力,不同程度减少了由AAPH带来的氧化损伤。同时,Nrf2-Keap1是抗氧化通路中的一条关键通路,在各种组织、器官中均能表达[19]。Nrf2也可能是调控酒精肝损伤的关键蛋白,利用Nrf2全身敲除小鼠证实,Nrf2的缺失能够增加小鼠急性酒精暴露导致的死亡率[20-21]。当氧化应激后,Nrf2与Keap1解离,更多的Nrf2进入细胞核中发挥功能[22-23]。在一定范围内,随PHP浓度的升高,核中的Nrf2蛋白表达升高。同时,PHP为6 mg/mL时,Keap1蛋白表达量降低,可能是因为在低浓度下的PHP对氧化应激损伤没有明显的缓解作用。
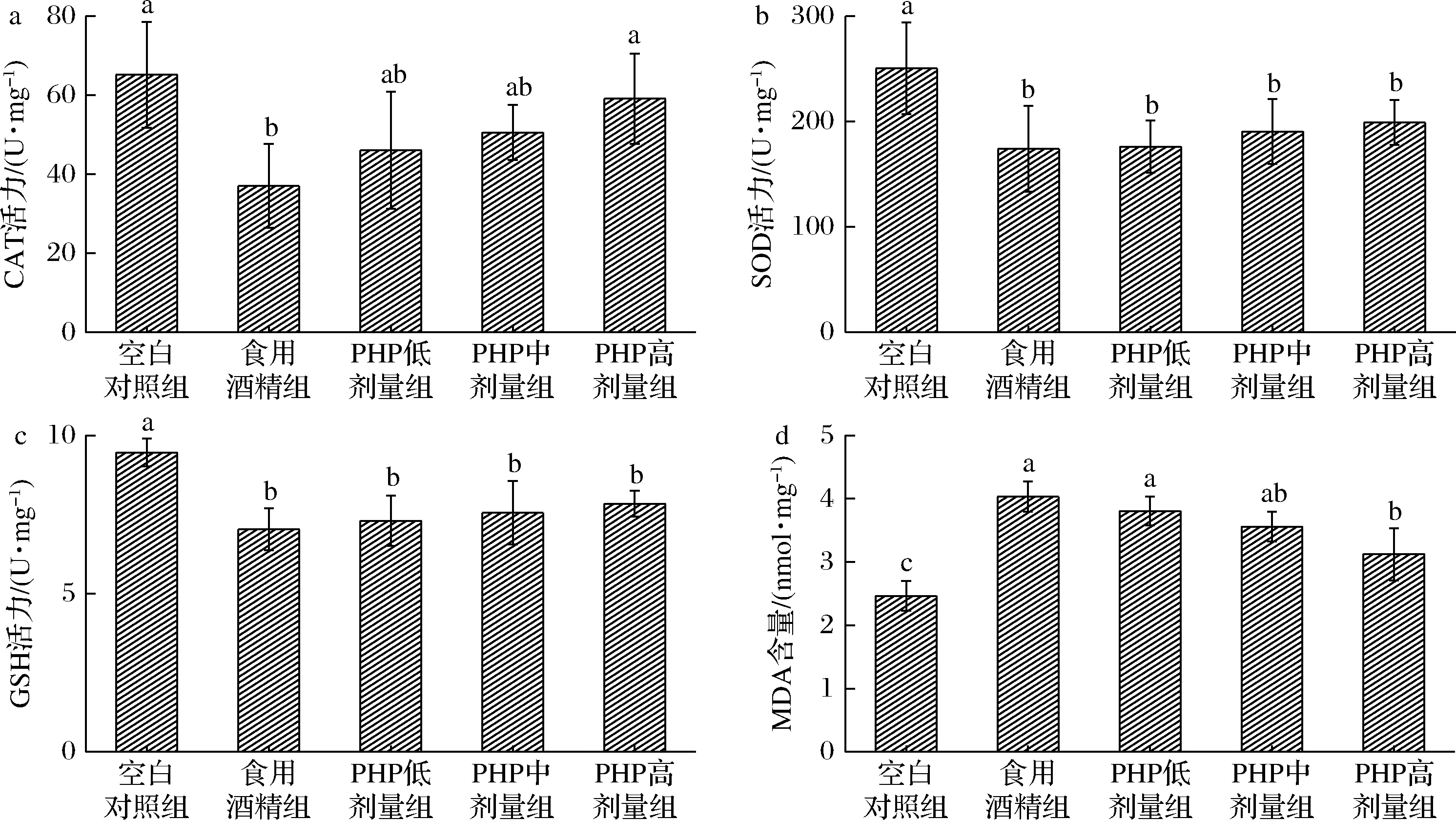
a-CAT;b-SOD;c-GSH;d-MDA图5 不同浓度PHP处理对CAT、SOD、GSH活力和MDA含量的影响Fig.5 The effect of PHP treatment on CAT, SOD, GSH actiity and MDA content
病理切片显示,食用酒精组小鼠肝组织已经受到了一定的损害,发生炎性改变;PHP各浓度处理组肝细胞变性数量及情况均要优于食用酒精组小鼠。同时对不同组小鼠肝脏健康相关指标进行比较,结果表明在食用酒精组中,血清AST、ALT、TC、TG、LDL-C水平均要高于PHP组,同时HDL-C含量明显低于PHP组。所有肝脏相关指标均能够表明,通过用PHP处理酒精性肝损伤小鼠,确实能够在一定程度上缓解酒精性肝损伤的产生。目前研究表明酒精能够产生氧化应激引起机体产生相应反应。乙醇代谢产物乙醛可直接与组织SOD、GSH-Px等抗氧化酶和抗氧化蛋白GSH结合而导致抗氧化酶活性下降,造成系统抗氧化功能降低[24]。能够发现PHP处理组中的氧化相关指标CAT、GSH、SOD活力均比食用酒精组有不同程度的升高,MDA含量降低。
目前研究结果表明,三肽PHP不光能够在体外抑制血管紧张素转换酶,具有一定的抗氧化能力,同时也能证明PHP是通过调控抗氧化物酶的活力来缓解氧化应激损伤,保持氧化水平,但这种缓解能力是有一定限度的,可能是PHP直接作用于抗氧化通路的某些关键蛋白带来的影响。PHP能够通过减少氧化应激,达到减缓酒精带来的肝脏损害。

