苦瓜叶片叶绿素响应白粉病菌侵染的遗传分析
杨 怡,田丽波*,商 桑,陈虹容,范晨伟,郭雪松
苦瓜叶片叶绿素响应白粉病菌侵染的遗传分析
杨 怡1,田丽波1*,商 桑2*,陈虹容1,范晨伟1,郭雪松1
1. 海南大学园艺学院/海南省热带园艺作物品质调控重点实验室,海南海口 570228;2. 海南大学生命科学学院,海南海口 570228
为了探索苦瓜苗期叶片叶绿素a、叶绿素b以及总叶绿素响应白粉病菌侵染的遗传规律,以苦瓜高代自交系09-a与09-b为亲本构建的170个F2个单株和140个F2:3家系作为材料,利用植物数量遗传的主基因+多基因混合遗传模型分别对2个地点的2个群体进行基于单个分离世代群体的遗传分析。结果表明,白粉病菌胁迫下叶绿素a、叶绿素b以及总叶绿素含量均会降低,感病品系降低幅度显著大于抗病品系,降解量与病情指数呈正相关,且降解量在2个群体中均呈正态分布。F2和F2:3群体中叶绿素a和叶绿素b的降解量均由一对加性主基因决定,2个群体控制叶绿素a降解量的1对主基因加性效应分别为0.3151、0.1670,控制叶绿素b降解量的1对主基因加性效应分别为0.1333、0.1670。总叶绿素降解量受2对加性-显性主基因控制,2对主基因在F2群体中加性效应分别为0.2601、0.3184,显性效应为‒0.3452、‒0.2221,在F2:3群体加性效应分别为0.1892、0.1624,显性效应分别为‒0.0465、‒0.0897,2对主基因的加性和显性效应共同发挥着重要作用。3个性状的加性效应均为正值,且控制总叶绿素降解量的2对主基因均以加性效应为主。F2和F2:3群体中叶绿素a降解量主基因遗传率为76.40%、62.68%。叶绿素b降解量主基因遗传率分别为72.99%、62.86%,控制叶绿素降解量的2对主基因遗传率为65.25%、95.36%,遗传率均大于60%,表明白粉菌胁迫下叶绿素a、叶绿素b及总叶绿素的降解主要受主基因的控制,但也受部分环境的影响。在苦瓜白粉病抗性育种实践中,可将叶绿素相关性状的降低量结合病情指数在早期世代进行选择。本研究为探索苦瓜白粉病抗病机理和抗病育种提供了理论依据。
苦瓜;叶绿素;遗传分析;主基因+多基因模型
苦瓜(L.)俗名癞瓜、凉瓜,是葫芦科具有重要经济价值的蔬菜。起源于印度,在亚洲和非洲国家广泛种植[1]。其果实富含β-胡萝卜素、维生素C、叶酸、镁、磷和钾等营养物质[2],具有抗氧化、消炎、抗癌、抗糖尿病、抗菌、抗肥胖和免疫调节的功效[3]。因其含有预防疾病和促进健康的植物化合物,已被用于各种中医治疗中。近年来,随着人们对苦瓜营养价值及诸多药用功效的深刻认识,栽培面积也逐年扩大。而白粉病是苦瓜设施与露地栽培过程中普遍发生的真菌性病害之一,多发生在亚热带和热带地区[4-8]。主要为害叶片、叶柄以及茎蔓等,具有潜育期短、传播速度快、周年可发生等特点[9-11],严重影响其产量和品质。杀菌剂是防治白粉病的主要措施之一。然而,药剂防控不仅危害健康还污染环境,因此,培育抗或耐白粉病品种是一种理想的病害控制策略。
病原菌入侵会使植物寄主发生一系列复杂的生理生化变化,许多病原菌尤其是危害植物叶片的病原菌侵染植物后通常会与叶绿体发生互作,从而导致叶绿体的降解,叶片出现褪绿、黄化、早衰等症状,进而影响叶片的光合能力,造成大量减产[11-12]。因此叶片叶绿素含量的高低往往能客观反映植物抗病性的强弱[13]。MORADI等[14]通过对黄瓜抗感白粉病品种的叶片叶绿素荧光发射光谱分析表明,感病品种受侵染后叶片光合器官受损,但对抗病品种的影响不显著,叶绿素荧光发射分析可为白粉病的早期检测和植物种质资源的筛选和分类提供依据。此外,AZMAT等[15]认为豌豆叶表面气孔密度、叶绿素a和b、总叶绿素浓度与感病严重程度显著相关,可作为豌豆抗白粉病筛选的标准。因此掌握感病后叶绿素含量的遗传规律,有利于抗病基因的定位和抗病品种的选育,实现农药减施,对绿色、高效、安全的农业可持续发展具有重要意义。
目前叶绿素突变体的遗传机理研究较为广泛,大都属于质量性状,如大豆黄绿叶突变体、水稻黄叶突变体、以及拟南芥黄化突变体均受1对隐性核基因控制[16-19]。而大部分研究表明叶绿素含量属于数量性状,主要受核基因控制,具有较高的遗传力[20]。传统的质量性状分析法存在把控制性状遗传的基因视为一个整体,且无法阐明单个基因的行为和效应等缺点。数量性状遗传的基本模型为主基因与多基因共同控制,即可采用主基因+多基因混合遗传分析方法[21]。该方法把孟德尔分离分析法合理地融合在数量性状遗传分析研究中,给出了数量性状基因体系及其效应的最佳估计,将2对或2对以上的包括上位性和连锁等情况考虑在内,使植物数量性状的遗传分析更深入、准确[22]。目前该方法已经在大豆[23]、玉米[24]、不结球白菜[25]、烤烟[26]以及苦瓜[27]等多种植物叶绿素含量遗传分析上广泛应用。然而在叶绿素响应逆境胁迫的遗传机理方面研究较少,在苦瓜上的研究则更少。本研究利用主基因+多基因混合遗传分析法对白粉病菌侵染苦瓜后叶绿素相关性状降解量进行遗传分析,探讨叶绿素响应白粉病的遗传规律,为提高作物产量和探索抗病机理提供理论依据。
1 材料与方法
1.1 材料
供试材料:以纯合的苦瓜高代自交系09-a(P1)和09-b(P2)为亲本,均在2015年鉴定其对白粉病的抗性[28]。09-a为斯里兰卡的野生苦瓜,对白粉病的抗性表现为抗病,在接种白粉菌后感病叶叶绿素降解量低,09-b从广东收集获取,对白粉病的抗性表现为感病,在接种白粉菌后感病叶叶绿素降解量高。利用母本自交系(09-a)和父本自交系(09-b)组合配置杂交一代F1及自交二代F2,同时F2通过单粒传获得F2:3家系。供试白粉病菌为单囊壳白粉菌(),生理小种2F,由海南大学热带瓜类团队分离纯化并鉴定。
试验仪器:多样品组织研磨机(型号:Tissuelyser-48;产地:上海);紫外可见分光广度计(型号:T6新世纪;产地:北京)。
1.2 方法
1.2.1 试验设计 将苦瓜种子温汤浸种消毒后,置于覆有双层湿润滤纸的培养皿中,并放置在28℃的恒温培养箱中催芽,露白后单粒播种于10 cm×10 cm的营养钵中。栽培基质按泥炭土∶珍珠岩∶有机肥=6∶3∶1的比例配制,在第3片真叶展开时将幼苗从育苗室移至田间。分别于2019年11月在海口市海南大学园艺学院试验基地定植苦瓜F2170个单株,2021年1月在琼海市中原基地定植苦瓜140个F2:3株系,2个群体实验分别在海口和琼海2个环境中完成。采用随机区组设计的方法F2:3每株系定植5株,重复2次,株行距分别为0.5 m和0.8 m。
取感白粉病严重的苦瓜叶片,用毛笔刷取叶片上的孢子于配制好的浓度为0.05%的Tween-20溶液中,搅拌均匀获得孢子悬浮液。再用血球计数板在显微镜下观察并计数分生孢子数,使接种液浓度为每毫升1.0×106个孢子。当植株长至6叶1心时,用小型手持喷雾器将上述孢子悬浮液均匀喷洒在6片真叶表面且呈水珠而不滴落的状态。
1.2.2 白粉病抗性鉴定 在接种白粉病菌26 d后调查发病情况,进行白粉病抗性鉴定,病情级别的划定参考SAKATA等[29]和粟建文等[30]的方法,分级标准如表1。
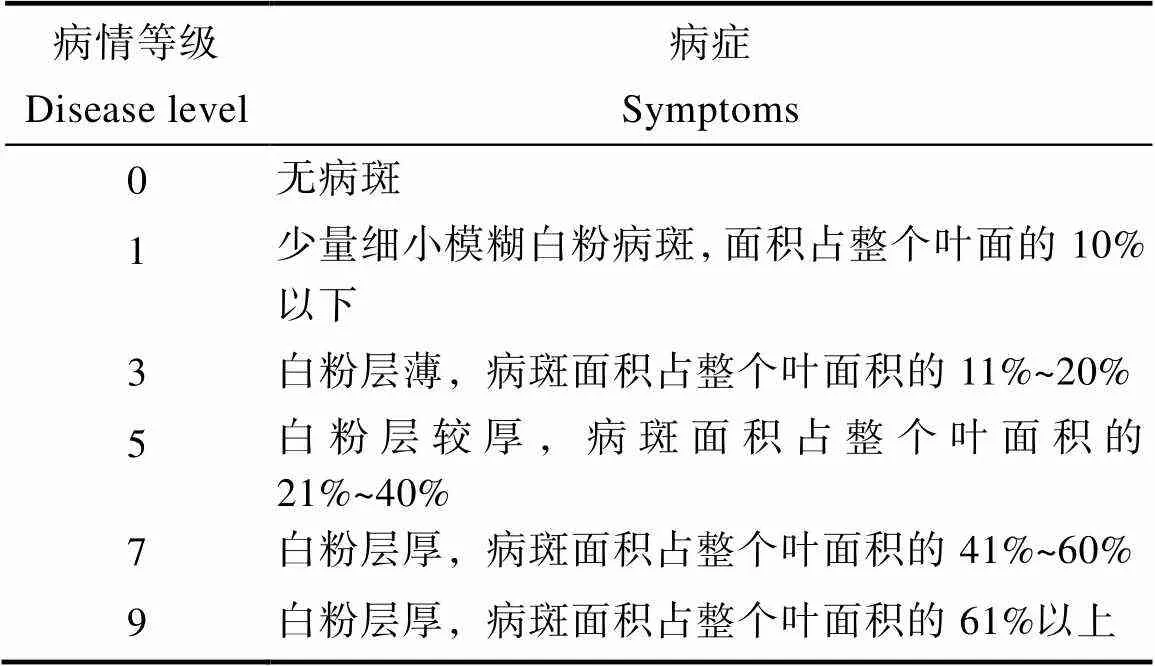
表1 病情等级
病情指数(disease index, DI)计算如下:DI=∑(各病级叶数×相对级数值)/(调查叶总数×9)× 100。植株的抗性鉴定结果依据病情指数分为5级(表2)。
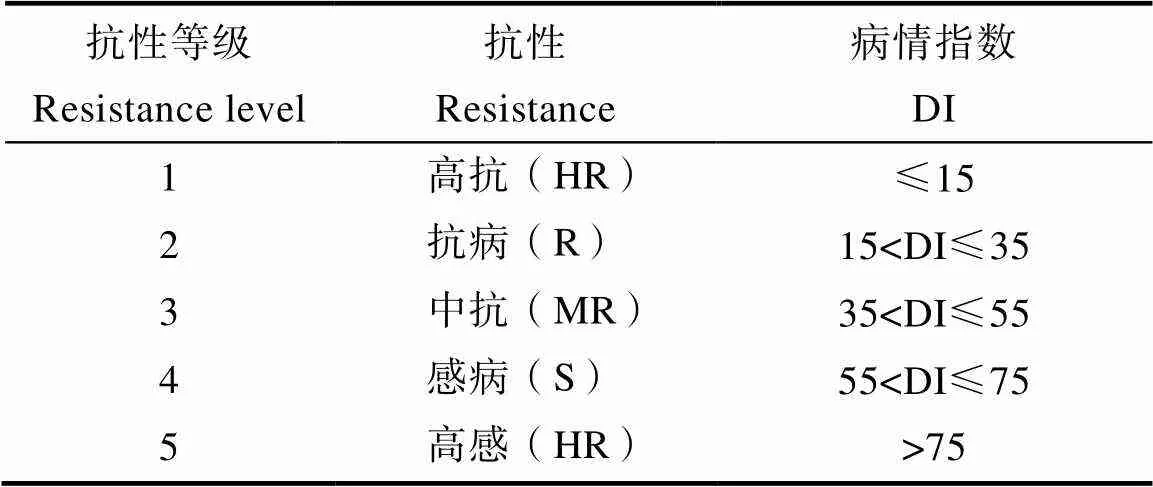
表2 抗性等级
1.2.3 叶绿素含量的测定 叶绿素含量的测定参照李合生[31]的方法,略作改动。接种白粉病菌26 d后达到发病高峰期,在同一植株上分别取发病的第6片真叶和1片未发病的功能叶,将新鲜的叶片剪碎混匀,取0.08 g置于2 mL离心管中,加入0.5 mL 95%乙醇,再加入2颗直径4 mm和1颗直径为3 mm的钢珠,放入研磨机中(50 HZ 3 min)充分研磨。研磨后离心10 min,5000 r/min,将上清液转入10 mL的棕色容量瓶中,加95%乙醇定容至10 mL。将叶绿素提取液倒入光径1 cm的比色杯内,分别在665 nm(叶绿素a)、649 nm(叶绿素b)波长下测定吸光值(),根据以下公式分别计算出叶绿素a、叶绿素b、总叶绿素的含量,再计算正常功能叶和发病叶的含量差值。
a=13.95665–6.88649
b=24.96649–7.32665
总叶绿素含量(mg/g)=(××)/(×1000)
式中:为色素含量(mg/L);为提取液体积(mL);为稀释倍数;为样品鲜质量(g)。
1.3 数据处理
采用SPSS.19以及Excel 2019软件对数据进行统计分析和亲本间差异显著性分析,分别根据盖钧镒[21]提出的单个分离世代群体的遗传模型方法即主基因+多基因混合遗传模型分离分析法,进行F2和F2:3世代遗传分析。通过极大似然法对混合分布中的有关参数作出估计,选择AIC值最小或较小的几个模型作为最佳模型和备选模型,再根据均匀性12、22、32检验、Smironv检验和Kolmogorov检验等适合性检验选出最佳模型。由此估计出混合分布中各成分分布参数、一阶和二阶遗传参数。
2 结果与分析
2.1 白粉病菌胁迫下叶绿素相关性状特征及次数分布
如图1和图2所示,高感亲本09-b(DI=86.20)在感病26 d后从下到上大部分叶片上面有厚重白粉层且失绿,感病严重的叶片白粉层覆盖整个叶面,而高抗亲本09-a(DI=14.07)仅少部分叶片有零星的斑点及薄薄的白粉层。白粉菌胁迫下P1的感病叶片与健康功能叶相比叶绿素a、叶绿素b、总叶绿素降解量分别为0.352、0.129、0.481 mg/g,P2为0.919、0.285、1.204 mg/g,接种白粉病菌后感病自交系叶绿素a、叶绿素b、总叶绿素降解量极显著高于抗病自交系,且叶绿素a的含量变化大于叶绿素b。病情指数与叶绿素降解量相关性分析表明(表3,表4),F2与F2:3群体接种白粉菌后,其叶绿素a、叶绿素b及总叶绿素的降解量均与病情指数呈极显著正相关,F2群体病情指数与叶绿素a、叶绿素b及总叶绿素的降解量相关系数分别为0.572、0.515、0.565,F2:3群体相关系数分别为0.540、0.489、0.535。综上表明苦瓜对白粉病的抗性可能与叶绿素降解量幅度的大小有关。

图1 09-a(P1)和09-b(P2)感病后植株表型
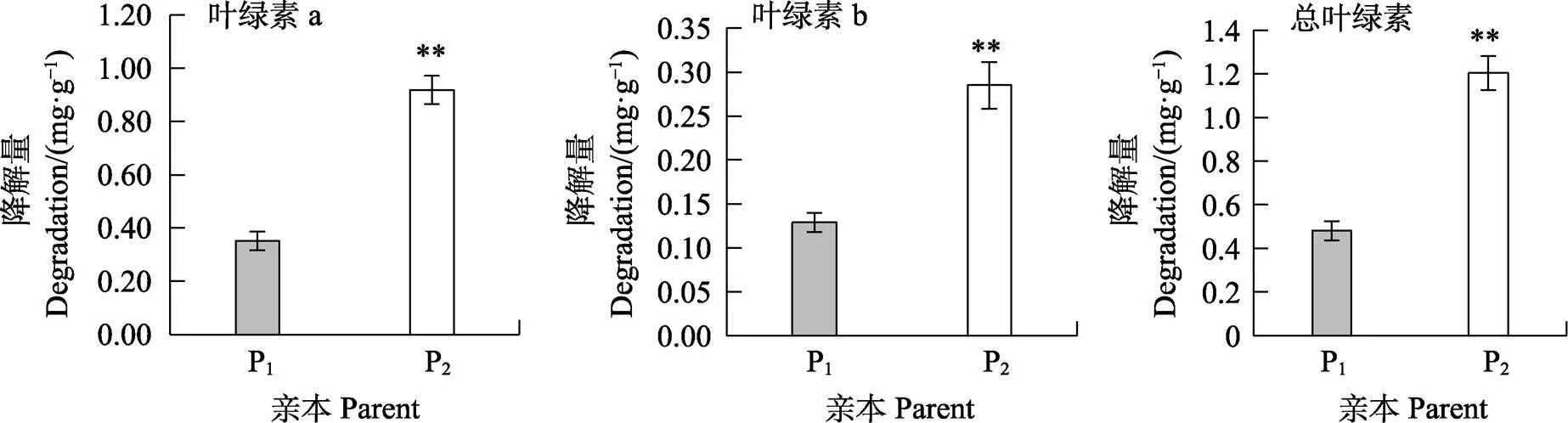
*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
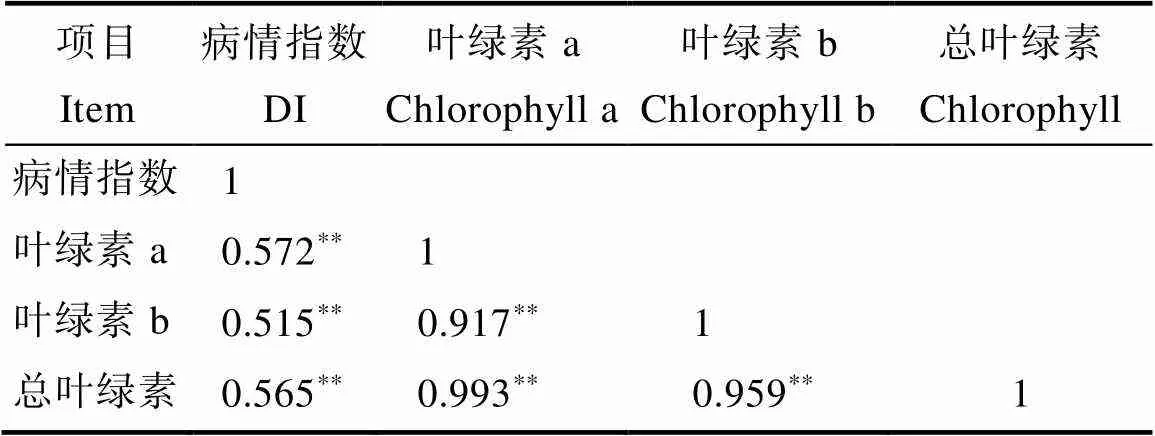
表3 F2病情指数与叶绿素降解量相关性分析
注:*表示显著相关(<0.05),**表示极显著相关(<0.01)。
Note:*indicates significant correlation (<0.05),**indicates extremely significant correlation (<0.01).
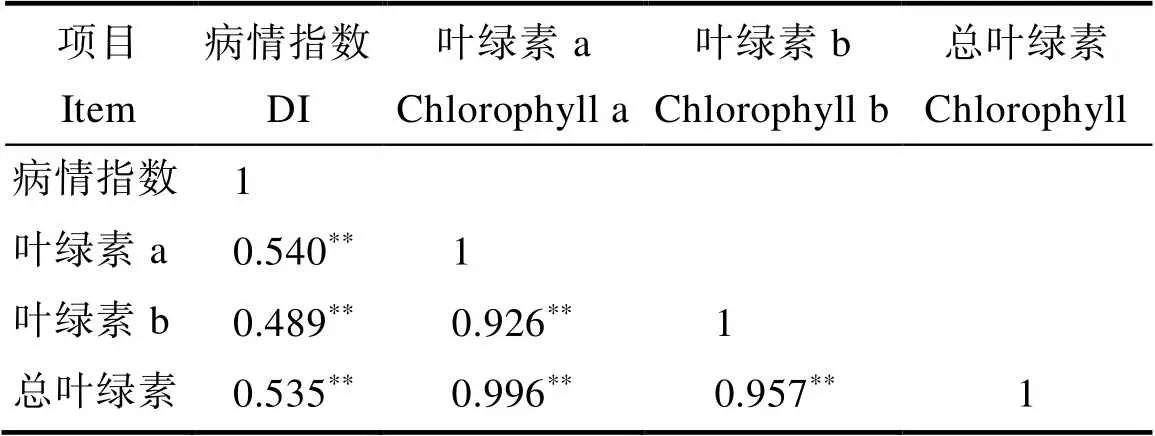
表4 F2:3病情指数与叶绿素解量相关性分析
注:*表示显著相关(<0.05),**表示极显著相关(<0.01)。
Note:*indicates significant correlation (<0.05),**indicates extremely significant correlation (<0.01).
白粉病菌胁迫下F2和F2:3世代的叶绿素a、叶绿素b和总叶绿素降解量均表现出连续的正态分布,偏度和峰度均小于1,且双向超亲分离,属于数量性状(图3,表5),适合进一步遗传分析。3个性状在不同群体中呈单峰或多峰分布,表明苦瓜响应白粉病叶绿素a、叶绿素b和总叶绿素的遗传符合主基因-多基因遗传特征。F2群体3个性状的变幅均较F2:3大,且3个性状分离群体中的变异系数介于33.1%~56.1%之间,可见两亲本组合产生的F2和F2:3群体有较好的遗传多样性。
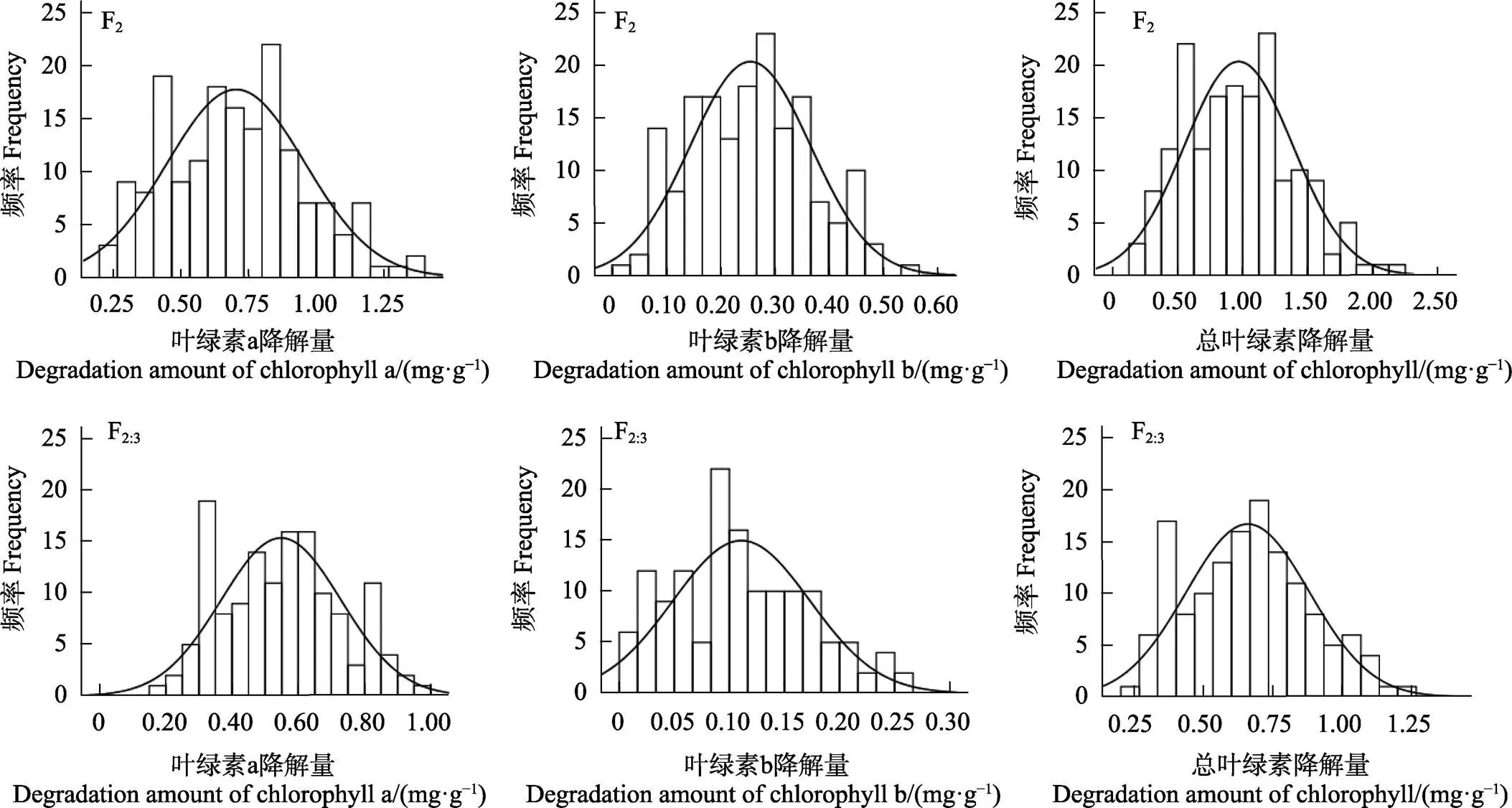
图3 F2和F2:3群体叶绿素降解量频率分布图
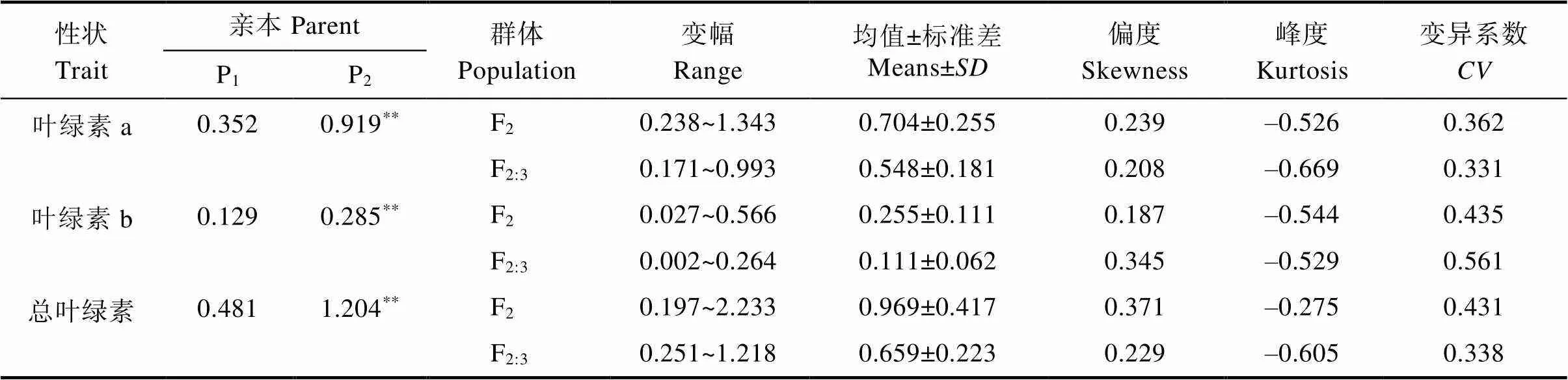
表5 白粉病菌胁迫下F2和F2:3群体相关性状描述
注:*表示显著相关(<0.05),**表示极显著相关(<0.01)。
Note:*indicates significant correlation (<0.05),**indicates extremely significant correlation (<0.01).
2.2 遗传模型的选择及适合性检验
利用植物数量性状的主基因+多基因的混合遗传模型对F2和F2:3分别进行基于单个分离世代群体的遗传分析,计算出各个性状所有模型的极大似然值(MLV)和AIC值(表6,表7)。依据AIC最小原则,选择AIC值最小为最佳可能模型,及2个与之最为接近的模型为备选模型(表8)。结果表明,F2和F2:3群体叶绿素a和叶绿素b响应白粉病菌胁迫的最小AIC值模型均为A-2,叶绿素a和叶绿素b在F2群体中的备选模型分别为B-3、A-1,在F2:3中的备选模型分别为A-1、A-0。F2和F2:3群体叶绿素降解量的最小AIC模型均为B-2,备选模型分别为F2:A-1、A-0,F2:3:A-2、A-0。经适合性检验(表8),发现各个模型在各项检验下均未能达差异显著水平,无显著区别,所以选择3个备选模型中AIC最小的为最优遗传模型。因此2个群体叶绿素a、叶绿素b最佳遗传模型均为A-2,总叶绿素降解量的最佳模型均为B-2。说明在2个群体中白粉病菌的胁迫下叶绿素a和叶绿素b降解量均受一对加性主基因控制,叶绿素降解量则受2对加性-显性主基因控制。
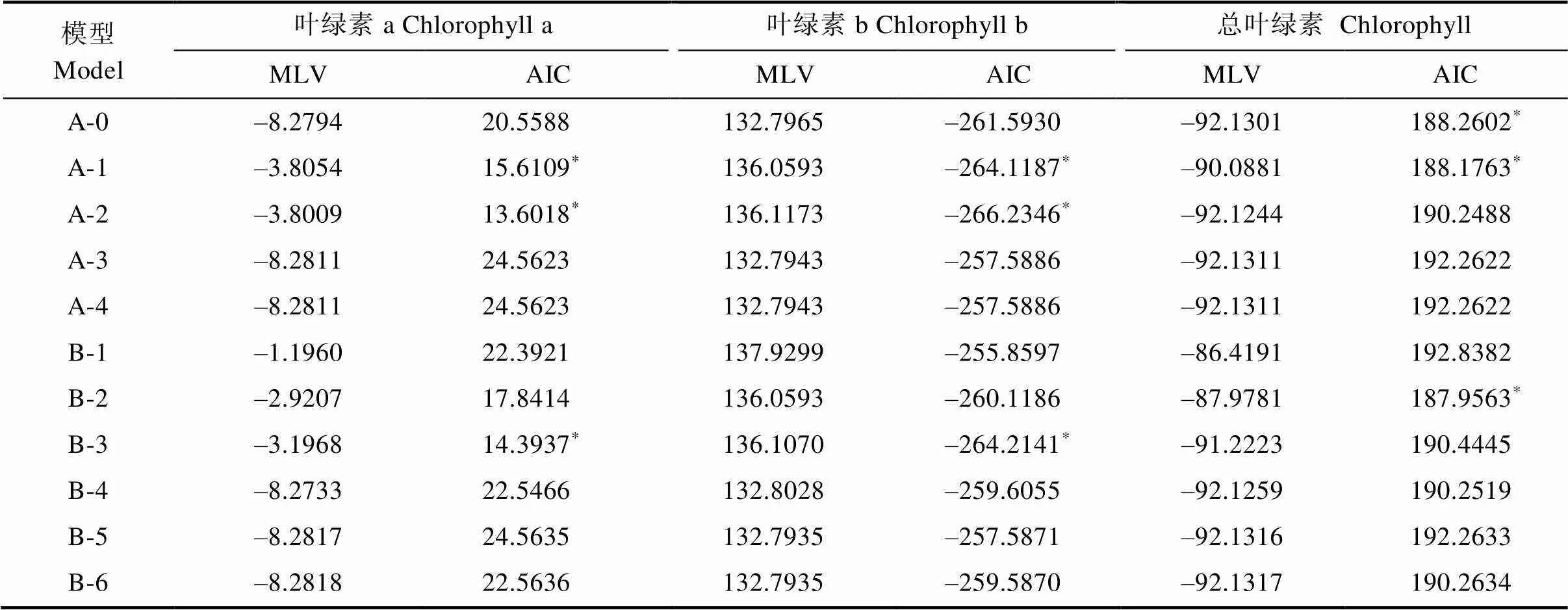
表6 F2各性状遗传模型的MLV和AIC值
注:*表示AIC值较小,指示的模型为较优遗传模型。
Note:*indicates the AIC values were smaller, and indicateing models were better genetic models.
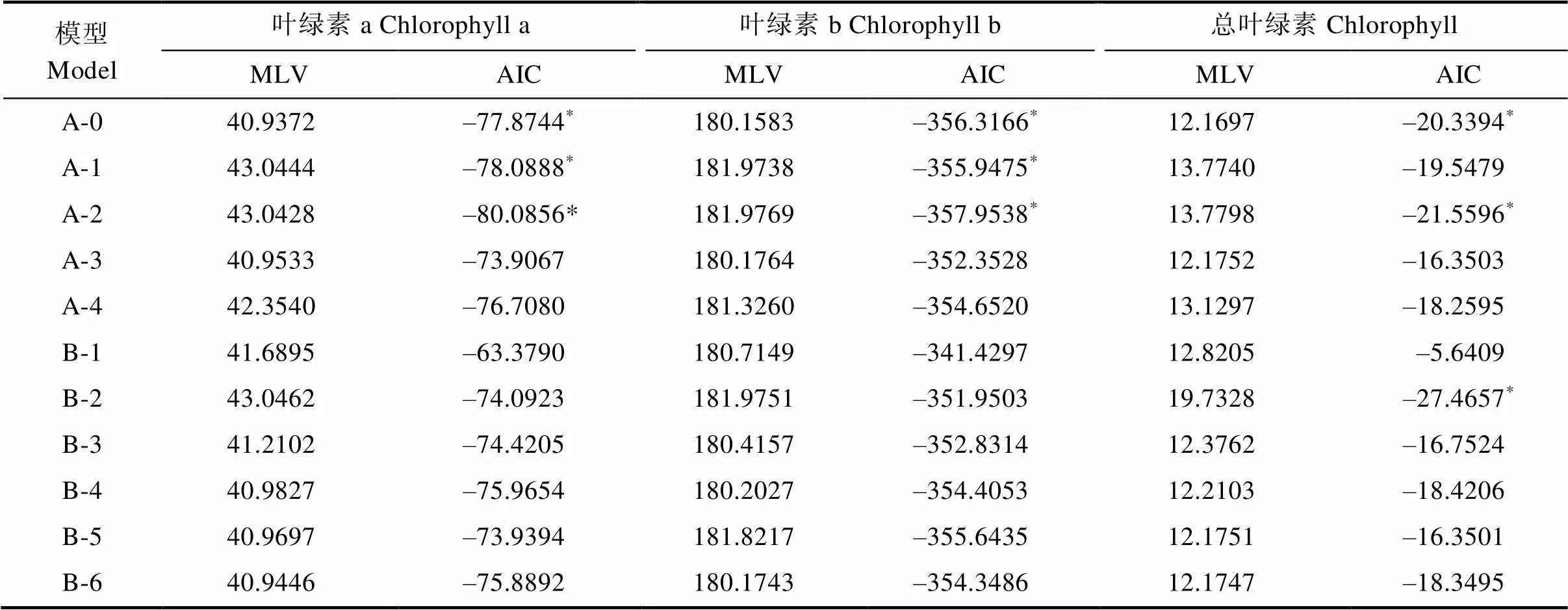
表7 F2:3各性状遗传模型的MLV和AIC值
注:*表示AIC值较小,指示的模型为较优遗传模型。
Note:*indicates the AIC values were smaller, and indicateing models were better genetic models.
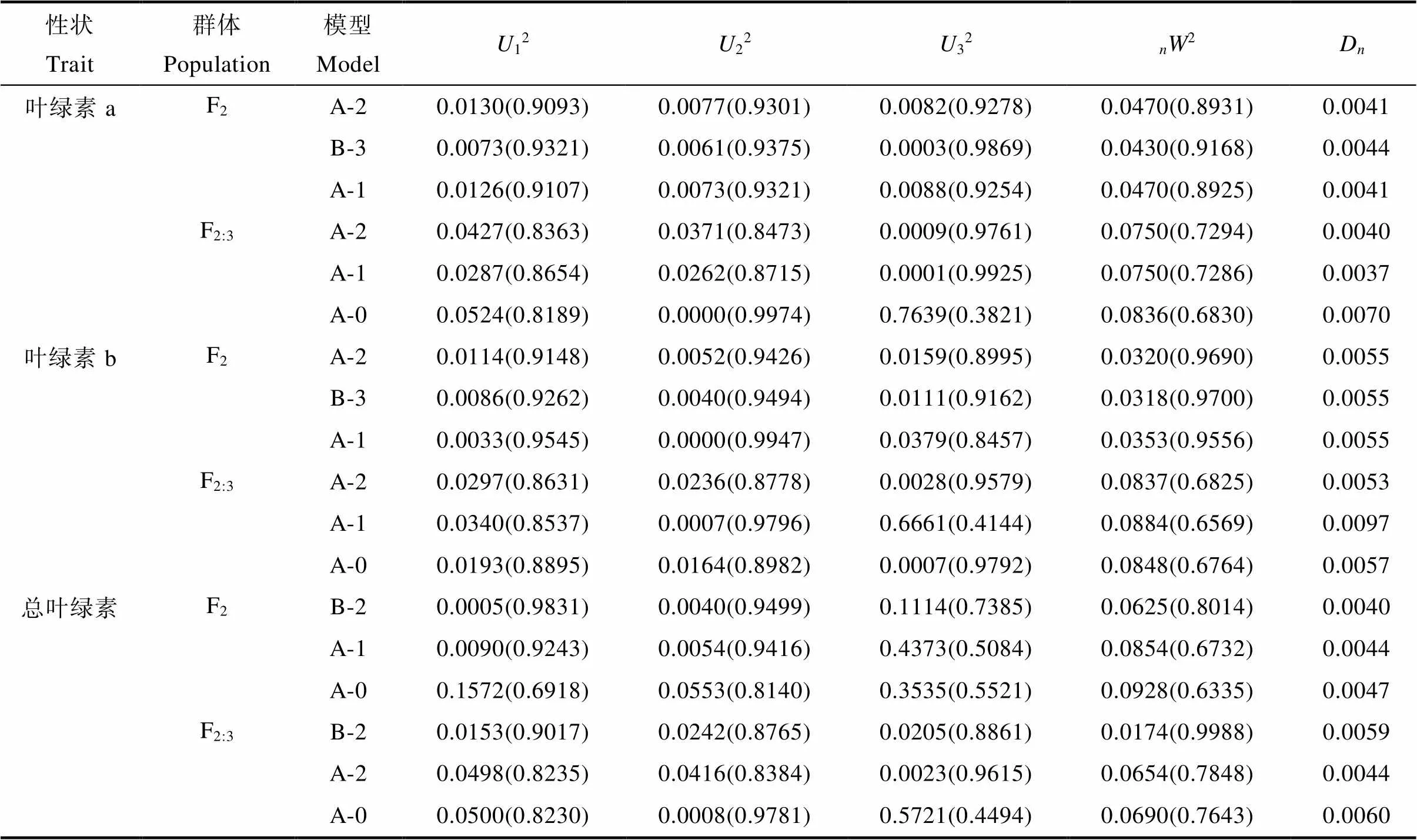
表8 各性状备选模型的适合性检验
注:12、22、32、2、为适合性检验的统计量,括号内数据为理论概率。
Note:12,22,32,W2,are the statistics of compatibility test, the data in brackets are theoretical probabilities.
2.3 遗传参数估计
由表9的一阶参数可知,在白粉病菌胁迫下,F2和F2:3群体控制叶绿素a降解量的一对主基因加性效应分别为0.3151、0.1670,控制叶绿素b降解量的一对主基因加性效应分别为0.1333、0.1670,其加性效应均为正,白粉病胁迫下叶绿素降解量受到多个微效基因的累加。
控制感病后总叶绿素降解量的2对主基因在F2中加性效应分别为0.2601和0.3184,显性效应为‒0.3452、‒0.2221,F2:3群体中2对主基因的加性效应分别为0.1892和0.1624,显性效应分别为‒0.0465、‒0.0897。显性效应为负值,表明等位基因中其隐性基因决定了叶绿素的降解量。在2个群体中其2对主基因的加性效应|a+b|大于其显性效应值|a+b|,说明控制总叶绿素降解量以基因累加为主。然而2个群体中第一对主基因的势能比值a/a为‒1.33和‒0.25,主基因的效应在2个不同地点的2个群体中表现不一,可能是由于控制数量性状遗传的基因其效应大小会随着种植地点不同而有所差异。2个群体中第二对主基因a/a分别为‒0.69和‒0.55,主基因的显性效用小于加性效应,具有反向的部分显性作用。可见在苦瓜09-a和09-b组合对总叶绿素响应白粉病菌胁迫的遗传中,2对主基因的加性和显性效应共同发挥着重要作用。
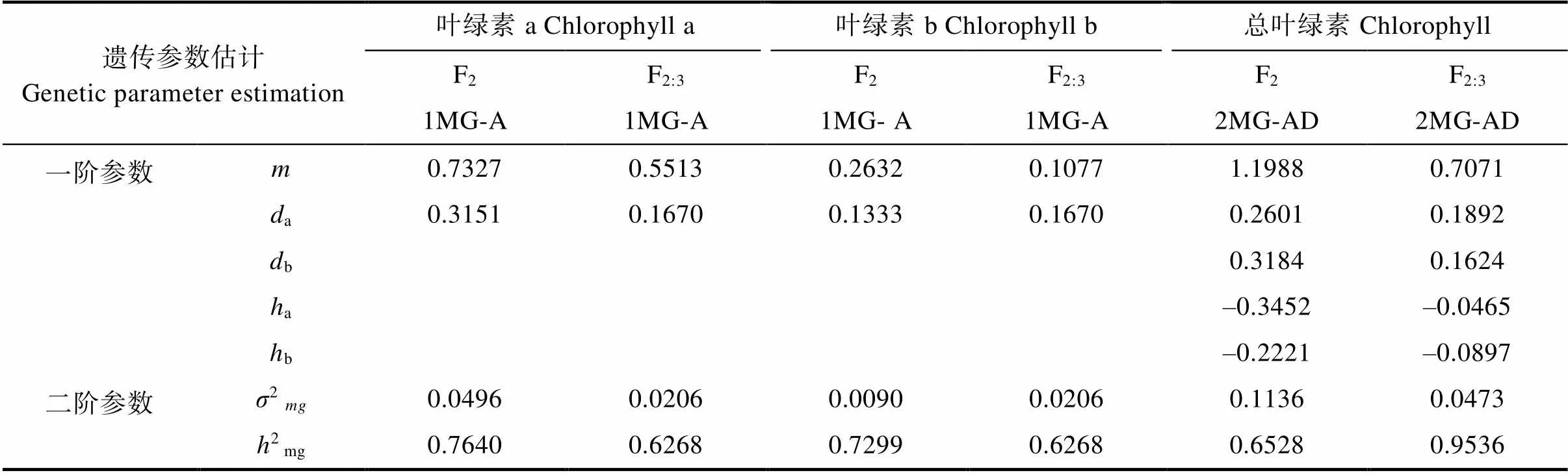
表9 各性状最佳模型遗传参数估计值
注:m为均值;a为第一对主基因的加性效应,b为第二对主基因的加性效应;a为第一对主基因的显性效应,b为第二对主基因的显性效应;2为主基因遗传率,2为主基因方差。
Note:is means;ais additive effect of the first pair of major genes,bis additive effect of the second pair of major genes;ais dominant effect of the first pair of major genes,bis dominant effect of the second pair of major genes;his major gene inheritance rate,σ is major gene variance.
由表9的二阶参数可知,在白粉病菌胁迫下F2和F2:3群体中叶绿素a降解量主基因遗传率为76.4%、62.68%。叶绿素b降解量的主基因遗传率分别为72.99%和62.68%,控制总叶绿素降解量2对主基因遗传率为65.25%和95.36%。3个性状无论是F2或者是F2:3群体遗传率均大于60%,说明主要由主基因控制了苦瓜叶绿素对白粉病菌的响应,此外环境条件对白粉病胁迫下3个性状的遗传存在部分影响,可在早代对这3个性状进行适度定向选择。
3 讨论与结论
叶绿素是地球上含量最为丰富和重要的色素,是光合作用的重要元件,通过捕获和转化光能成为有机质,是作物产量的主要来源[32]。叶绿素的降低是绿色植物对外界不利环境最敏感的反应,其含量的降低往往暗示着叶片的衰老、缺乏营养或遭遇胁迫,并与植株的抗性有紧密的联系。本研究发现高抗和高感苦瓜品系被白粉病菌侵染后,感病品系叶绿素降低量极显著的高于抗病品系。这与在黄瓜[33]、南瓜[34-35]、苦瓜[36]等瓜类上的发现类似,即白粉病抗性与叶绿素含量成正相关,同时也在葡萄[37]、小麦[38]、豌豆[39]等农作物上有相同发现。然而王惠哲等[40]、贠琰[41]分别发现南瓜、黄瓜在感染白粉病后无论抗病品种还是感病品种的叶绿素含量均有增加。但2种观点均认为植株抗白粉病的能力与叶绿素含量呈正相关。可见叶绿素含量在抗病中起着举足轻重的作用。因此掌握叶绿素响应白粉菌侵染的遗传规律,能够为抗病品种的选育提供一定的理论依据。
本研究采用植物数量的主基因+多基因的混合遗传模型对白粉菌胁迫下F2和F2:3群体3个叶绿素相关性状分别进行基于单个分离世代群体的遗传分析。结果表明,2个群体的结果均表明白粉菌胁迫下叶绿素a和叶绿素b的降解量符合一对加性主基因遗传模型,其加性效应均为正。总叶绿素降解量受2对加性显性主基因控制且在2个群体中其2对主基因的加性效应|d+d|大于其显性效应值|a+b|,控制总叶绿素降解量的2对主基因均以加性效应为主。而据相关研究报道,在未接种白粉病菌的情况下,以2个苦瓜叶绿素含量有差异的苦瓜品系为亲本构建6个世代,利用主基因+多基因混合遗传模型分析苦瓜叶绿素含量的遗传规律,发现叶绿素相对含量遗传受一对主基因控制[27, 42]。而本研究是基于白粉菌胁迫下的叶绿素降解量的遗传分析,叶绿素含量在胁迫下所呈现的遗传规律也有所差异。同时也表明,苦瓜在受到白粉菌侵染后,叶绿素会与病原菌相互作用。在琼海和海口2个地点的2个群体主基因的遗传效率在62.68%~95.36%之间,数值均较大,说明主要由主基因控制苦瓜叶绿素对白粉病菌的响应,此外环境条件对白粉病胁迫下3个性状的遗传存在部分影响。
综上所述,白粉病抗性与叶绿素的降解量负相关。本研究利用2个群体分别在琼海和海口2个地点进行遗传分析,2个群体中,白粉病菌胁迫下叶绿素a和b的降解量均由1对加性主基因决定,总叶绿素降解量均受2对加性-显性主基因控制,在2个不同地点的群体中得到的结论相互印证。同时环境也对叶绿素响应白粉病菌侵染有部分干扰。因此,在苦瓜白粉病抗性育种实践中,可将叶绿素相关性状的降低量结合病情指数在早期世代进行选择,同时应该关注其加性效应的应用,避免主基因的累加效应所导致植株抗性的降低。而控制叶绿素a和b的2对主基因,是否与控制总叶绿素的2对主基因是否存在某种联系尚未明确,所以在以后的研究中,将结合苦瓜高密度遗传图谱,对叶绿素响应白粉病菌的QTL精细定位,挖掘关键基因,为白粉病抗性的鉴定及抗病品种的选育奠定基础并加速其育种进程。
[1] CUI J J, YANG Y, LUO S B, WANG L, HUANG R K, WEN Q F, HAN X X, MIAO N S, CHENG J W, LIU Z J, ZHANG C Y, FENG C C, ZHU H S, SU J W, WAN X J, HU F, NIU Y, ZHENG X M, YANG Y L, SHAN D, DONG Z S, HE W M, DHILLON N P S, HU K L. Whole-genome sequencing provides insights into the genetic diversity and domestication of bitter gourd (spp.)[J]. Horticulture Research, 2020, 7(1): 85.
[2] DHILLON N P S, LIN C C, SUN Z Y, HANSON P M, LEDESMA D R, HABICHT S D, YANG R Y. Varietal and harvesting stage variation in the content of carotenoids, ascorbic acid and tocopherols in the fruit of bitter gourd (L.)[J]. Plant Genetic Resources, 2016, 15(3): 1-12.
[3] DANDAWATE P R, SUBRAMANIAM D, PADHYE S B, ANANT S. Bitter melon:a panacea for inflammation and cancer[J]. Chinese Journal of Natural Medicines, 2016, 14(2): 81-100.
[4] ZITTER T A, HOPKINS D L, THOMAS C E. Compendium of cucurbit diseases[M]. USA: The American Phytopathological Society, 1996.
[5] LEBEDA A, KŘÍSTKOVÁ E, SEDLÁKOVÁ B, COFFEY M D, MCCREIGHT J D. Gaps and perspectives of pathotype and race determination inand[J]. Mycoscience, 2011, 52(3): 159-64.
[6] SITTERLY W R, SPENCER D M. Powdery mildews of cucurbits[M]//The Powdery Mildews. USA: The American Phytopathological Society, 1987: 359-379.
[7] HE X M, LI Y H, PANDEY S, YANDELL B S, PATHAK M, WENG Y Q. QTL mapping of powdery mildew resistance in WI 2757 cucumber (L.)[J]. Theoretical & Applied Genetics, 2013, 126(8): 2149-2161.
[8] 甘 露, 马含月, 高京草, 张 显. 瓜类蔬菜白粉病抗性诱导及抗性遗传研究进展[J]. 中国瓜菜, 2021, 34(3): 1-6.
GAN L, MA H Y, GAO J C, ZHANG X. Progress on including and inheritance of resistance to powdery mildew in cucurbits[J]. Chinese Cucurbits and Vegetables, 2021, 34(3): 1-6. (in Chinese).
[9] 刘苗苗, 刘宏宇, 顾兴芳, 张圣平, 苗 晗. 黄瓜白粉病抗性遗传规律及分子标记研究进展[J]. 中国蔬菜, 2009(24): 7-12.
LIU M M, LIU H Y, GU X F, ZHANG S P, MIAO H. Research progress on inheritance and molecular markers of resistance to powdery mildew in cucumber[J]. Chinese Vegetables, 2009(24): 7-12. (in Chinese)
[10] 罗晶晶, 齐晓花, 陈学好. 瓜类作物白粉病抗性遗传机制[J]. 分子植物育种, 2010, 8(3): 556-562.
LUO J J, QI X H, CHEN X H. Advances on genetic mechanisms of powdery mildew resistance in cucurbit crops[J]. Molecular Plant Breeding, 2010, 8(3): 556-562. (in Chinese)
[11] ALEJANDRO P G, DIEGO R, DOLORES F O, FRANCISCO L R, ANTONIO D V, JUAN A T. The powdery mildew fungus(synonym), a constant threat to cucurbits[J]. Molecular Plant Pathology, 2009, 10(2): 153-160.
[12] 刘 丽, 刘长远, 王 辉, 于舒怡, 关天舒, 王东旭, 李柏宏. 葡萄不同抗霜霉病品种的生理生化指标研究[J]. 沈阳农业大学学报, 2018, 49(5): 594-589.
LIU L, LIU C Y, WANG H, YU S Y, GUAN T S, WANG D X, LI B H. Indices of physiology and biochemistry of various grape cultivars resistant to downy mildew[J]. Journal of Shenyang Agricultural University, 2018, 49(5): 594-599. (in Chinese)
[13] 欧志远. 叶绿素含量与植物抗病性的关系[J]. 安徽农学通报, 2007(6): 134-135.
OU Z Y. Relationship between chlorophyll content and plant disease resistance[J]. Anhui Agricultural Science Bulletin, 2007(6): 134-135. (in Chinese)
[14] MORADI N, RAHIMIAN H, DEHESTANI A, BABAEIZAD V, YAGHOUBIAN Y. Screening of cucumber cultivars resistant to powdery mildew and comparative assessment of chlorophyll florescence in resistant and sensitive cultivars[J]. Journal of Plant Protection, 2017, 31(3): 83-85.
[15] AZMAT M A, KHAN A A, NIAZ S. Stomatal density and chlorophyll concentration as an indicator of powdery mildew resistance in pea (L.)[J]. Pakistan Journal of Agricultural Sciences, 2016, 53(4): 871-877.
[16] 王好让, 张 勇, 于春淼, 董全中, 李微微, 胡凯凤, 张明明, 薛 红, 杨梦平, 宋继玲, 王 磊, 杨兴勇, 邱丽娟. 大豆突变体黄绿叶基因的精细定位[J]. 作物学报, 2022, 48(4): 791-800.
WANG H R, ZHANG Y, YU C M, DONG Q Z, LI W W, HU K F, ZHANG M M, XUE H, YANG M P, SONG J L, WANG L, YANG X Y, QIU L J. Fine mapping of yellow-green leaf gene () in soybean (L.)[J]. Acta Agronomica Sinica, 2022, 48(4): 791-800. (in Chinese)
[17] 康伟伟, 李哲理, 易自力, 孙志忠, 盛夏冰, 黄安平, 段美娟, 谭炎宁. 水稻黄叶突变体()的鉴定与遗传分析[J]. 农业生物技术学报, 2020, 28(12): 2108-2117.
KANG W W, LI Z L, YI Z L, SUN Z Z, SHENG X B, HUANG A P, DUAN M J, TAN Y N. Identification and genetic analysis of the yellow leaf mutant()in rice ()[J]. Journal of Agricultural Biotechnology, 2020, 28(12): 2108-2117. (in Chinese)
[18] 袁 铠. 水稻黄叶突变体()的遗传分析和基因定位探究[J]. 南方农业, 2020, 14(17): 182-183.
YUAN K. Genetic analysis and gene mapping of the yellow leaf mutant() in rice[J]. South China Agriculture, 2020, 14(17): 182-183. (in Chinese)
[19] 戴 楠, 袁光孝, 刘小敏, 高宏波. 拟南芥黄化突变体的基因作图定位[J]. 北京林业大学学报, 2017, 39(7): 40-45.
DAI N, YUAN G X, LIU X M, GAO H B. Gene mapping ofyellowing mutant[J]. Journal of Beijing Foresty University, 2017, 39(7): 40-45. (in Chinese)
[20] 叶景秀, 柳海东. 叶绿素含量相关QTL定位研究进展[J]. 青海大学学报, 2019, 37(4): 55-60.
YE J X, LIU H D. Research progress of QTL mapping of chlorophyll content[J]. Journal of Qinghai University, 2019, 37(4): 55-60. (in Chinese)
[21] 盖钧镒. 植物数量性状遗传体系的分离分析方法研究[J]. 遗传, 2005, 27(1): 130-136.
GAI J Y. Segregation analysis of genetic system of quantitative traits in plants[J]. Hereditas, 2005, 27(1): 130-136. (in Chinese)
[22] 田丽波. 苦瓜遗传图谱构建及白粉病抗性的QTL定位[D]. 沈阳: 沈阳农业大学, 2015.
TIAN L B. Constructing of genetic maps and QTL mapping of powdery mildew resisitance in bitter melon[D]. Shenyang: Shenyang Agricultural University, 2015. (in Chinese)
[23] 梁慧珍, 余永亮, 杨红旗, 董 薇, 许兰杰, 牛永光, 张海洋, 刘学义, 方宣钧. 大豆叶片性状和叶绿素含量QTL间的上位性和环境互作效应[J]. 作物学报, 2015, 41(6): 889-899.
LIANG H Z, YU Y L, YANG H Q, DONG W, XU L J, NIU Y G, ZHANG H Y, LIU X Y, FANG X J. Epistatic and QTL × environment interaction effects of QTLs for leaf traits and leaf chlorophyll content in soybean[J]. Acta Agronomica Sinica, 2015, 41(6): 889-899. (in Chinese)
[24] 李洪涛, 许瀚元, 李景芳, 祝 庆, 迟 铭, 王 军. 玉米叶绿素含量基因效应分析[J]. 作物杂志, 2019, 192(5): 46-51.
LI H T, XU H Y, LI J F, ZHU Q, CHI M, WANG J. Gene effect analysis of chlorophyll content in maize[J]. Corps, 2019, 192(5): 46-51. (in Chinese)
[25] 林婷婷, 王 立, 张 琳, 王建军, 侯喜林, 李 英. 不结球白菜叶绿素含量的主基因+多基因混合遗传分析[J]. 南京农业大学学报, 2014, 37(5): 34-40.
LIN T T, WANG L, ZHANG L, WANG J J, HOU X L, LI Y. Genetic analysis of chlorophyll content using mixed major gene plus polygene inheritance model in non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2014, 37(5): 34-40. (in Chinese)
[26] 张兴伟, 王志德, 牟建民, 刘艳华, 任 民. 烤烟叶绿素含量遗传分析[J]. 中国烟草学报, 2011, 17(3): 48-52.
ZHANG X W, WANG Z D, MOU J M, LIU Y H, REN M. Genetic analysis of chlorophyll content in flue-cured tobacco leaf[J]. Acta Tabacaria Sinica, 2011, 17(3): 48-52. (in Chinese)
[27] 陈虹容, 商 桑, 田丽波, 朱国鹏. 苦瓜叶片叶绿素含量的遗传分析[J]. 热带作物学报, 2021, 42(6): 1572-1578.
CHEN H R, SHANG S, TIAN L B, ZHU G P. Genetic analysis of chlorophyll content in bitter gourd leaves[J]. Chinese Journal of Tropical Crops, 2021, 42(6): 1572-1578. (in Chinese)
[28] 田丽波, 张 燕, 商 桑, 杨 衍. 基于生理生化性状和病情指数评价苦瓜种质资源的白粉病抗性[J]. 分子植物育种, 2015, 13(12): 2824-32.
TIAN L B, ZHANG Y, SHANG S, YANG Y. Assessment of powdery mildew resistance of bitter melon germplasm resources based on physiological and biochemical indexes and disease index[J]. Molecular Plant Breeding, 2015, 13(12): 2824-2832. (in Chinese)
[29] SAKATA Y, KUBO N, MORISHITA M, KITADANI E, SUGIYAMA M, HIRAI M. QTL analysis of powdery mildew resistance in cucumber (L.)[J]. Theoretical and Applied Genetics, 2006, 112(2): 243-250.
[30] 粟建文, 胡新军, 袁祖华, 李勇奇, 刘雪源. 苦瓜白粉病抗性遗传规律研究[J]. 中国蔬菜, 2007(9): 24-26.
SU J W, HU X J, YUAN Z H, LI Y Q, LIU X Y. The inheritance of resistance to powdery mildew in bitter ground[J]. China Vegetables, 2007(9): 24-26. (in Chinese)
[31] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 246- 247.
LI H S. Experimental principles and techniques of plant physiology and biochemistry[M]. Beijing: Hight Education Press, 2000. (in Chinese)
[32] FROMME P, MELKOZERNOV A, JORDAN P, KRAUSS N. Structure and function of photosystem I: interaction with its soluble electron carriers and external antenna systems[J]. FEBS Letters, 2003, 555(1): 40-44.
[33] 金海军, 胡继军, 卜立君, 丁小涛, 余纪柱, 张红梅. 华南型黄瓜自交系白粉病抗性与光合特性的关系[J]. 中国瓜菜, 2020, 177(2): 32-35.
JIN H J, HU J J, BU L J, DING X T, YU J Z, ZHANG H M. Relationship between powdery mildew resistance and photosynthetic characteristics of cucumber inbred lines of South China type[J]. Chinese Cucurbits and Vegetables, 2020, 177(2): 32-35. (in Chinese)
[34] 颜惠霞, 徐秉良, 梁巧兰, 薛应钰, 陈荣贤, 梁志福. 南瓜品种对白粉病的抗病性与叶绿素含量和气孔密度的相关性[J]. 植物保护, 2009, 35(1): 79-81.
YAN H X, XU B L, LIANG Q L, XUE Y Y, CHEN R X, LIANG Z F. Effects of chlorophyll content and stoma density on pumpkin resistance to powdery mildew[J]. Plant Protection, 2009, 35(1): 79-81. (in Chinese)
[35] 郭卫丽, 郭言言, 李新峥. 中国南瓜苗期性状与白粉病抗性的关系[J]. 北方园艺, 2016(24): 104-108.
GUO W L, GUO Y Y, LI X Z. Relationship between morphological index and resistance to powdery mildew in pumpkin[J]. Northern Horticulture, 2016(24): 104-108. (in Chinese)
[36] 田丽波, 商 桑, 杨 衍, 司龙亭. 苦瓜对白粉病的抗性与相关生理生化指标的关系[J]. 西北农业学报, 2015, 24(9): 166-173.
TIAN L B, SHANG S, YANG Y, SI L T. Relationship between bitter melon’s resistance to powdery mildew with associated physiology and biochemical indexes[J]. Acta Agriculturae Boreali-occidentalissinica, 2015, 24(9): 166-173. (in Chinese)
[37] 吴 昊, 董华芳, 许延波. 番茄白粉病对番茄叶片叶绿素含量的影响[J]. 北方园艺, 2011(16): 8-10.
WU H, DONG H F, XU Y B. Effect of tomato powdery mildew on chlorophyll content in tomato leaves[J]. Northern Horticulture, 2011(16): 8-10. (in Chinese)
[38] 韩庆典, 杨美娟, 黄择祥, 闫 丽, 胡晓君. 小麦白粉病菌对小麦幼苗光合生理特性的影响[J]. 基因组学与应用生物学, 2017, 36(10): 4373-4379.
HAN Q D, YANG M J, HUANG Z X, YAN L, HU X J. Effects of wheat powdery mildew on the photosynthetic physiological characteristics of wheat seedlings[J]. Genomics and Applied Biology, 2017, 36(10): 4373-4379. (in Chinese)
[39] 张丽娟, 杨晓明, 陆建英, 王 昶. 豌豆白粉病抗性相关指标的研究[J]. 甘肃农业科技, 2015(3): 33-36.
ZHANG L J, YANG X M, LU J Y, WANG C. Study on indicators related with pea powdery mildew resistance[J]. Gansu Agricultural Science and Technology, 2015(3): 33-36. (in Chinese)
[40] 王惠哲, 李淑菊, 霍振荣, 庞金安. 黄瓜感染白粉病菌后的生理变化[J]. 2016, 21(1):105-109.
WANG H Z, LI S J, HUO Z R, PANG J A. Physiological changes of cucumber after being infected by[J]. Acta Agriculturae Boreali-Sinica, 2016, 21(1): 105-109. (in Chinese)
[41] 贠 琰. 南瓜抗白粉病机理的初步研究[D]. 南京: 南京农业大学, 2017.
YUN Y. Preliminary study on resistance mechanism of pumpkin to powdery mildew[D]. Nanjing: Nanjing Agricultural University, 2017. (in Chinese)
[42] 张 燕, 王佳楠, 商 桑, 田丽波, 杜卓涛, 周萌萌. 苦瓜苗期几个主要性状的遗传分析[J]. 分子植物育种, 2017, 15(5): 1906-1917.
ZHANG Y, WANG J N, SHANG S, TIAN L B, DU Z T, ZHOU M M. Genetic analysis on several main seedling characters of bitter melon[J]. Molecular Plant Breeding, 2017, 15(5): 1906-1917. (in Chinese)
Genetic Law of Chlorophyll Response to Powdery Mildew Infection in Bitter Melon Leaves
YANG Yi1, TIAN Libo1*, SHANG Sang2*, CHEN Hongrong1, FAN Chenwei1, GUO Xuesong1
1. College of Horticulture, Hainan University / Hainan Key Laboratory of Tropical Horticultural Crop Quality Control, Haikou, Hainan 570228, China; 2. College of Life Sciences, Hainan University, Haikou, Hainan 570228, China
In order to explore the genetic law of chlorophyll a, chlorophyll b and chlorophyll in response to powdery mildew infection in bitter melon seedlings, 170 individual plants of F2and 140 families of F2:3were constructed with bitter melon high-generation inbred lines 09-a and 09-b, The genetic analysis of two populations in two environments based on a single separated generation population was carried out using the major gene + polygene mixed genetic model of plant quantitative inheritance. The results showed that the contents of chlorophyll a, chlorophyll b and chlorophyll decreased under the stress of powdery mildew. The reduction range of susceptible strains was significantly greater than that of resistant strains. The degradation amount was positively correlated with the disease index, and the degradation amount was normally distributed in the two populations. The degradation amounts of chlorophyll a and chlorophyll b in F2and F2:3populations were determined by a pair of additive major genes. The additive effect of a pair of major genes controlling the degradation amount of chlorophyll a in the two populations was 0.3151 and 0.1670 respectively, and the additive effects of a pair of major genes controlling the degradation amount of chlorophyll b was 0.1333 and 0.1670 respectively. The chlorophyll degradation was controlled by two pairs of additive dominant major genes. The additive effect of the two pairs of major genes in F2population was 0.2601 and 0.3184, the dominant effect was ‒0.3452 and -0.2221, and the additive effect in F2:3population was 0.1892 and 0.1624, the dominant effect was -0.0465 and ‒0.0897, respectively. The additive and dominant effects of the two pairs of major genes played an important role together. The additive effects of the three traits were positive, and the two pairs of major genes controlling the chlorophyll degradation were dominated by additive effects. The major gene heritability of chlorophyll a degradation in F2and F2:3populations was 76.40% and 62.68%. The heritabilities of major genes controlling chlorophyll b degradation was 72.99% and 62.86%, respectively. And the heritability of two pairs of major genes controlling chlorophyll b degradation was 65.25% and 95.36%, both were greater than 60%, indicating that chlorophyll a, chlorophyll b and chlorophyll degradation were mainly controlled by main genes under powdery mildew stress, but it was also affected by some environment. In the breeding practice of bitter melon powdery mildew resistance, the reduction of chlorophyll related traits could be selected in the early generation combined with the disease index. This study would provide a theoretical basis for exploring the disease resistance mechanism and disease resistance breeding of bitter melon powdery mildew.
bitter melon; chlorophyll; genetic analysis; major gene + polygene model
S436.429
A
10.3969/j.issn.1000-2561.2022.09.017
2022-01-26;
2022-04-27
2019年海南省基础与应用基础研究计划(自然科学领域)高层次人才项目(No. 2019RC150);国家自然科学基金项目(No. 32060682);海南省研究生创新科研课题基金项目(No. Hys2020-236)。
杨 怡(1997—),女,硕士研究生,研究方向:园艺植物遗传育种。*通信作者(Corresponding author):田丽波(TIAN Libo),E-mail:faiy7play@163.com;商 桑(SHANG Sang),E-mail:fair.play@163.com。

