高寒地区牧草根际促生菌的筛选与特性
柴加丽,姚 拓,王振龙,韩江茹,张 蔚,刘晓婷,李 茜
(1. 甘肃农业大学草业学院 / 草业生态系统教育部重点实验室 / 中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070;2. 中国科学院西北高原生物研究所 / 青海省寒区恢复生态学重点实验室, 青海 西宁 810008)
高寒地区是我国重要的生态保护区,该地区海拔高、常年低温、气候条件恶劣,加上不合理放牧等一系列人类活动,使高寒地区草地生态系统受到破坏。研究发现,目前约有90%的可利用天然草地都存在不同程度退化[1],这不仅改变了植物群落结构,还影响土壤固碳、水土保持等生态服务功能[2-3]。草地作为发展畜牧业的基础和重要的生态屏障,受多重影响退化严重,因此,加强高寒地区草地生态的保护,探寻促进草地生物生长和恢复的有效措施势在必行[4]。目前,我国研究学者和相关部门已经采取了一些措施,使用较多的就是围栏封育和施肥,这些方法的实施有力地缓解了高寒地区草地退化问题[5],但均有一定的弊端,围栏封禁一般年限较长,造成草地资源浪费[6];另外天然草地施用化肥,虽然可以显著提高地上生物量,但调查显示,我国化肥利用率只有40%左右,大部分化肥施入后以渗透方式进入土壤[7],间接造成土壤微生物活性下降、养分比例失调、性状恶化,导致草地稳定性和可持续性差[8]。因此,研制新型肥料对实现高寒草地可持续发展和保护生态环境十分必要[9]。
植 物 根 际 促 生 菌 (plant growth promoting rhizobacteria, PGPR)是一类有益菌,能在植物根际定殖,并通过固氮、溶磷、分泌激素等功能来促进植物生长,利用PGPR 研制微生物菌肥或菌剂,能够修复土壤结构,改善土壤养分供应状况,持续效果好且对环境无污染[10-11]。崔晓双等[12]研究发现PGPR对番茄(Solanum lycopersium)、黄瓜(Cucumis sativus)株高都有显著促进作用;任卓然等[13]以两株促生菌为基础材料,发现微生物菌肥在退化草地修复中具有改善土壤理化性质的潜力;Piromyou 等[14]筛选饲用玉米(Zea mays)中PGPR,发现其有利于田间植物生长发育。因此,筛选优良PGPR 制作微生物菌肥或菌剂的技术为高寒地区植被恢复提供了新思路。鉴于此,本研究从高寒地区优良牧草中华羊茅(Festuca sinensis)、草地早熟禾(Poa pretensis)、紫穗鹅观草(Roegneria purpurascens)根际筛选低温适应型PGPR,并将其运用于后续高寒地区微生物菌剂研制,对农业可持续发展具有重要意义。
1 材料与方法
1.1 材料
样品于2020 年8 月采自青海省门源县皇城乡,该采样地位于海北藏族自治州东部,海拔3 200 -3 250 m,地理位置37°39′51″ N,101°10′44″ E,气候类型属于高原大陆性气候,年平均气温0.8 ℃,年平均降水量500~600 mm。植被类型为高寒草甸,优势种包括嵩草(Kobresia myosuroides)、草地早熟禾(Poa pretensis),伴生种主要以禾本科异针茅(Stipa aliena)、中华羊茅(Festuca sinensis)为主[15-16]。采集中华羊茅、草地早熟禾、紫穗鹅观草完整植株,标注植物名称和采集日期,贮存于无菌自封袋后放入冰盒中,带回实验室立即进行PGPR 菌株的分离。
1.2 培养基
固体溶磷培养基[17]:葡萄糖10 g,硫酸铵[(NH4)2SO4] 0.1 g,氯化钾(KCl) 0.3 g,七水合硫酸镁(MgSO4·7H2O) 0.25 g,六 水 合 氯 化 镁(MgCl2·6H2O)5.0 g,有机磷植酸钙5.0 g /无机磷[Ca3(PO4)] 5.0 g,蒸馏水1 000 mL,琼脂20 g,pH 7.0。
无氮培养基[9](nitrogen free medium,NFM):二水合氯化钙(CaCl2·2H2O) 0.02 g,七水合硫酸镁(MgSO4·7H2O) 0.2 g,磷酸氢二钾(K2HPO4) 0.5 g,二水合钼酸 钠(NaMoO4·2H2O) 0.002 g,氯 化 钠(NaCl) 0.1 g,苹果酸5.0 g,0.5%溴百里酚蓝5 mL,琼脂20 g (固体培养基)或2 g (半固体培养基),总体积1 000 mL,pH 7.0。
King’B 培养基(KB):蛋白胨20 g,磷酸氢二钾(K2HPO4) 1.15 g,七水合硫酸镁(MgSO4·7H2O) 1.5 g,丙三醇15 mL。
LB 培养基:蛋白胨10 g,酵母提取物5 g,NaCl 5 g,琼脂20 g,蒸馏水1 000 mL,pH 7.0~7.5。
1.3 方法
1.3.1牧草根际菌株分离纯化
为获得牧草根际所有菌株及分布状况,参考蒋永梅[9]的方法,通常将根际分为3 个区域,即根表土壤(soil adhering to roots, RS)、根系表面(rhizoplan or surface of roots, RP)和 根 内 组 织(histoplan or interior of roots, HP)。分离方法:在超净工作台中抖落牧草根系的土壤后称取1 g 植物根系,放入含有9 mL 生理盐水(0.85%,已灭菌)的试管中,充分混匀,得到RS 区域10-1稀释液;将根系取出并放入另一个含有无菌玻璃珠的9 mL 生理盐水(0.85%,已灭菌)的试管中,充分混匀得到RP 区域的10-1稀释液;再将根系取出用石蜡将根系两端密封,先用75%酒精灭菌3 min,然后用无菌水冲洗2~3 次,剪去石蜡两端并研磨后全部转入含有9 mL 生理盐水(0.85%,已灭菌)的试管中,充分混匀,得到HP 区域的10-1稀释液;吸取各区域的10-1稀释液1 mL,加入含有9 mL 生理盐水(0.85%,已灭菌)的试管中充分混匀,得到10-2稀释液,按照梯度稀释法再依次制备浓度为10-3、10-4、10-5稀释液备用。利用平板涂布法分别将10-3、10-4、10-5稀释液均匀涂布到NFM 培养基和固体溶磷培养基上,每个区域的每个梯度稀释液在培养基上各重复3 次,15 ℃培养箱中培养7 ~ 10 d,用接种环挑取能在NFM 培养基上生长的不同菌落进行纯化,即为固氮菌株;挑取固体溶磷培养基上有溶磷圈的不同菌落进行纯化,即为溶磷菌株,将纯化后的菌株保存于4 ℃备用[18]。
1.3.2菌株促生特性测定
菌株固氮特性测定[19]:乙炔还原法。用接种环将菌株接种于LB 液体培养基中,在15 ℃、180 r·min-1条件下培养2~3 d,并用无菌LB 液体调节OD600一致[11],吸取100 μL 菌液接种于盛有3 mL 半固体NFM 培养基的12 mL 血清瓶中,每株菌3 次重复,以不接菌培养基为对照,15 ℃培养48 h 后将棉花塞换成橡胶塞,用无菌注射器抽出1 mL 气体并注入1 mL 乙炔,15 ℃培养48 h。用微量进样器抽取混合气体50 μL 注入气象色谱仪(Agilent 7890A,美国)气体进样柱内,记录并观察C2H4出峰时间及峰面积百分比,计算固氮酶活性。
菌株溶磷特性测定[20]:钼蓝比色法。将固体溶磷培养基上有溶磷圈的菌株接种于装有20 mL 液体培养基(已灭菌)中于15 ℃、180 r·min-1条件下培养10~14 d。取培养液8 mL 于4 ℃、12 000 r·min-1条件下离心15 min,取上清液1 mL 于100 mL 三角瓶中,同时加入NaHCO3溶液19 mL,置于摇床(180 r·min-1)摇动30 min 后,准确吸取滤液5 mL,再加入5 mL钼锑抗显色液于50 mL 容量瓶中,定容后显色30 min。用紫外可见光分光光度计测定OD700,并计算溶磷量。
菌株分泌激素特性测定[21],定性判断:将PGPR菌株接种于盛有已灭菌的三角瓶中,在15 ℃、180 r·min-1条件下振荡培养10~12 d。吸取各菌液50 μL于白瓷板上,加50 μL Spot 比色液,其中对照加50 μL浓度为0.01‰的3-IAA,将白瓷板放置于室温黑暗条件下,20 min 内观察并记录颜色变化。如变深粉色即菌株分泌生长素(Indole-3-acetic acid,IAA)能力较强,用++表示;变浅粉色即菌株能分泌IAA 但能力较弱,用+表示。定量测定:采用高效液相色谱法(high performance liquid chromatography, HPLC)[22]测定植物激素(IAA、GA3、t-Z)含量。HPLC 色谱条件 为:固 定 相 为Agilent ZORBAX Eclipse Plus C18 column (4.6 mm × 250 mm, 5-Micron),流动相为甲醇 ∶水 ∶ 冰乙酸溶液 = 45 ∶ 54 ∶ 1,检测波长为254 nm,柱温为30 ℃,流速为0.8 mL·min-1,进样量为10 μL。将筛选出的菌株接种于150 mL KB 液体培养基中,15 ℃、180 r·min-1摇床中培养5 d。发酵液在4 ℃离心10 min (5 000 r·min-1)收集上清液,用乙酸乙酯萃取后用浓缩仪浓缩至近干,甲醇定容至2 mL,HPLC进行分析。
1.3.3优良菌株鉴定
将上述分离筛选到的优良PGPR 菌株在LB 平板上进行活化,采用热裂解法提取细菌DNA,利用通用引物27F 和1492R 进行16 S r DNA 序列的PCR 扩增[23],反应体系为2 × Taq PCR MasterMix 25 μL、DNA模板3 μL、正反向引物各1 μL、dd H2O 20 μL、16 S r DNA序列测定由兰州天启生物科技有限公司完成。将测序结果在EzbioCloud 的16S-based ID 数据库中进行同源序列比较,采用Mega5.0 软件以邻接法构建所测菌株的系统发育树再次确认[24]。
1.4 数据分析
采用SPSS 25.0 软件分析数据,采用Duncan 法对不同菌株促生特性(溶磷、固氮、分泌激素)进行差异分析,采用Excel 2010 软件作图。
2 结果与分析
2.1 高寒地区牧草根际促生菌数量分布
通过3 种培养基筛选,共获得181 株菌株(图1),分离自中华羊茅根际59 株,其中根表土(RS)、根表面(RP)和根内(HP)菌株分别占总数的33.90%、38.98%和27.12%;草地早熟禾根际64 株,其中32.81%分离自RS,39.06%分离自RP,28.13%分离自HP;紫穗鹅观草根际58 株,不同区域(RS、RP、HP) PGPR 占总数的32.76%、39.66%和27.58%。总体来看,3 种牧草根际促生菌分布均表现出RP > RS > HP 的分布趋势。通过选择培养基共分离到溶解有机磷52株,溶解无机磷55 株,固氮74 株。
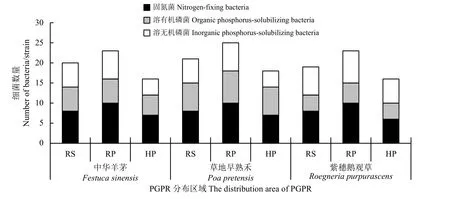
图1 细菌菌株牧草根际的数量及分布情况Figure 1 Number and distribution of bacterial strains in the rhizosphere of forage species
2.2 菌株促生特性测定
2.2.1菌株溶磷特性测定
对溶磷菌株溶磷量测定,结果表明,供试的52株溶有机磷菌株中有14 株具有良好的溶解以植酸钙为有机磷磷源的能力,占供试菌株的26.92%;供试的55 株溶无机磷菌株中有16 株具有良好的溶解以磷酸三钙为无机磷磷源的能力,占供试菌株的29.09%。14 株溶有机磷菌株溶磷量为6.51~141.49 μg·mL-1(表1),其中ZMBJ2 溶磷量显著(P< 0.05)高于其他菌 株,达141.49 μg·mL-1,GMDB1 溶 磷 量 最 低,为6.51 μg·mL-1,溶磷量在100 μg·mL-1以上的菌株有两株,分别是ZMBJ2 和ZMBN4,均分离自中华羊茅根际。菌株溶有机磷培养液均呈酸性,pH 2.97~3.79。16 株溶无机磷菌株溶磷量为371.29~538.59 μg·mL-1(表2),其中菌株GPDB3 溶磷量最大,达538.59 μg·mL-1,其 次 是ZPBN1,为533.93 μg·mL-1;菌 株GPDJ1 溶磷量最小,为371.29 μg·mL-1,菌株溶无机磷培养液pH 为3.98~4.79,呈酸性。
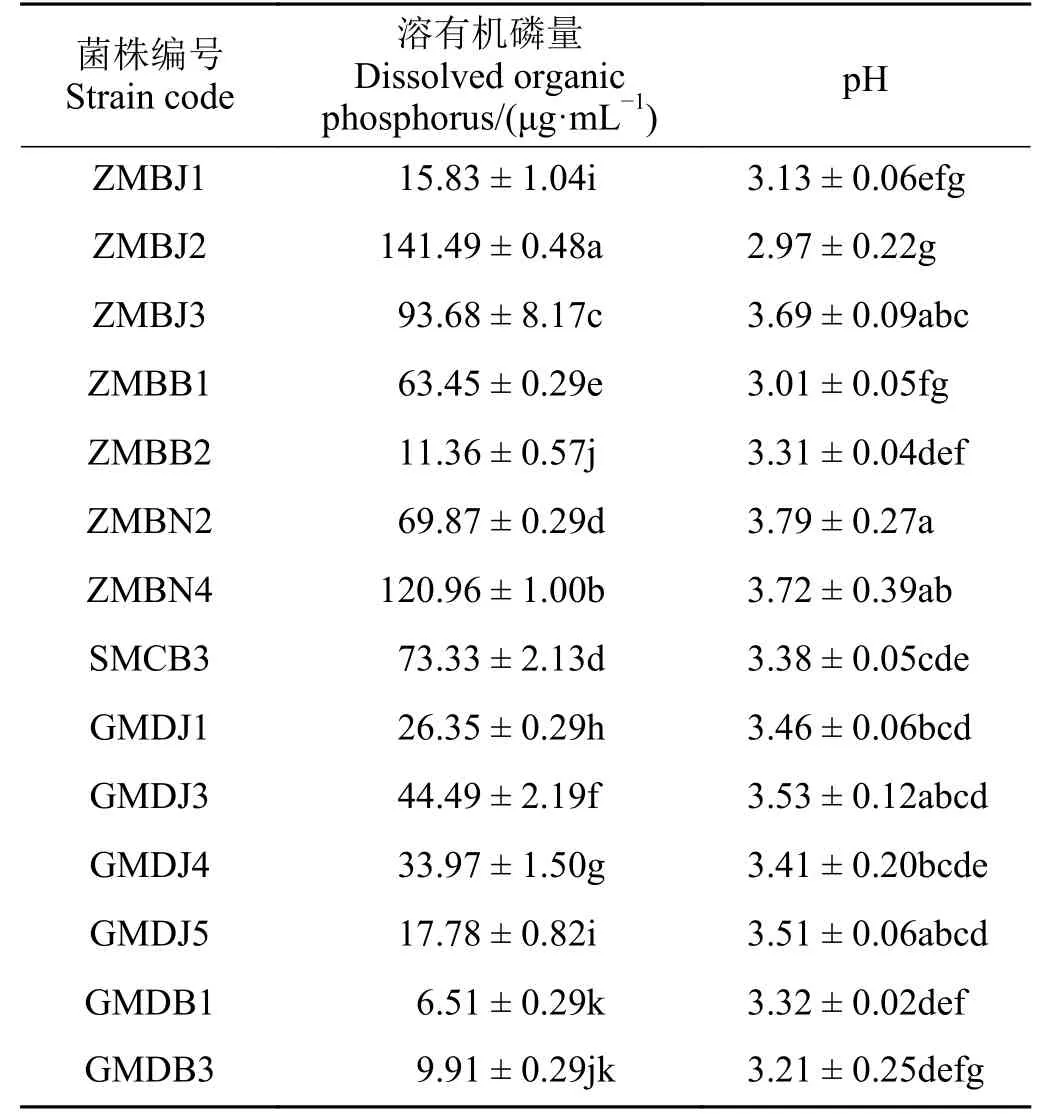
表1 PGPR 菌株溶解有机磷能力Table 1 Ability of PGPR to dissolve organic phosphorus
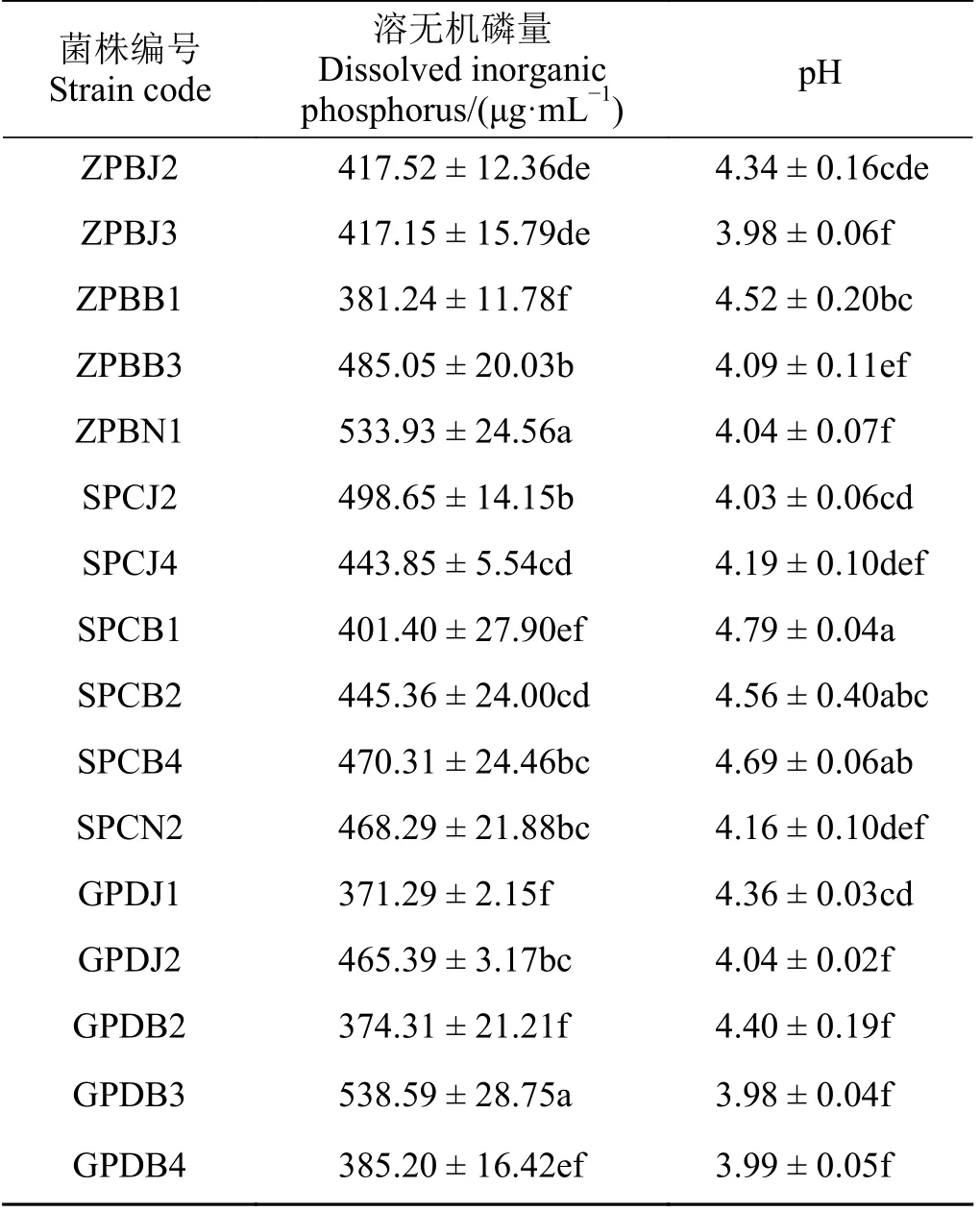
表2 PGPR 菌株溶解无机磷能力Table 2 Ability of PGPR to dissolve inorganic phosphorus
2.2.2固氮菌株特性测定
对固氮菌株固氮酶活性测定(表3)发现,不同菌株固氮能力不同,根据固氮能力共筛选出22 株优良固氮菌,固氮酶活性在91.71~160.20 nmol·(h·mL)-1(C2H4),其中固氮酶活性在150 nmol·(h·mL)-1(C2H4)以上的菌株有两株,分别是GNDJ1 和ZNBJ1,GNDN2固氮酶活性最小,为91.71 nmol·(h·mL)-1(C2H4)。从中华羊茅和紫穗鹅观草根际分离的优良固氮菌数量较多,而草地早熟禾根际最少。
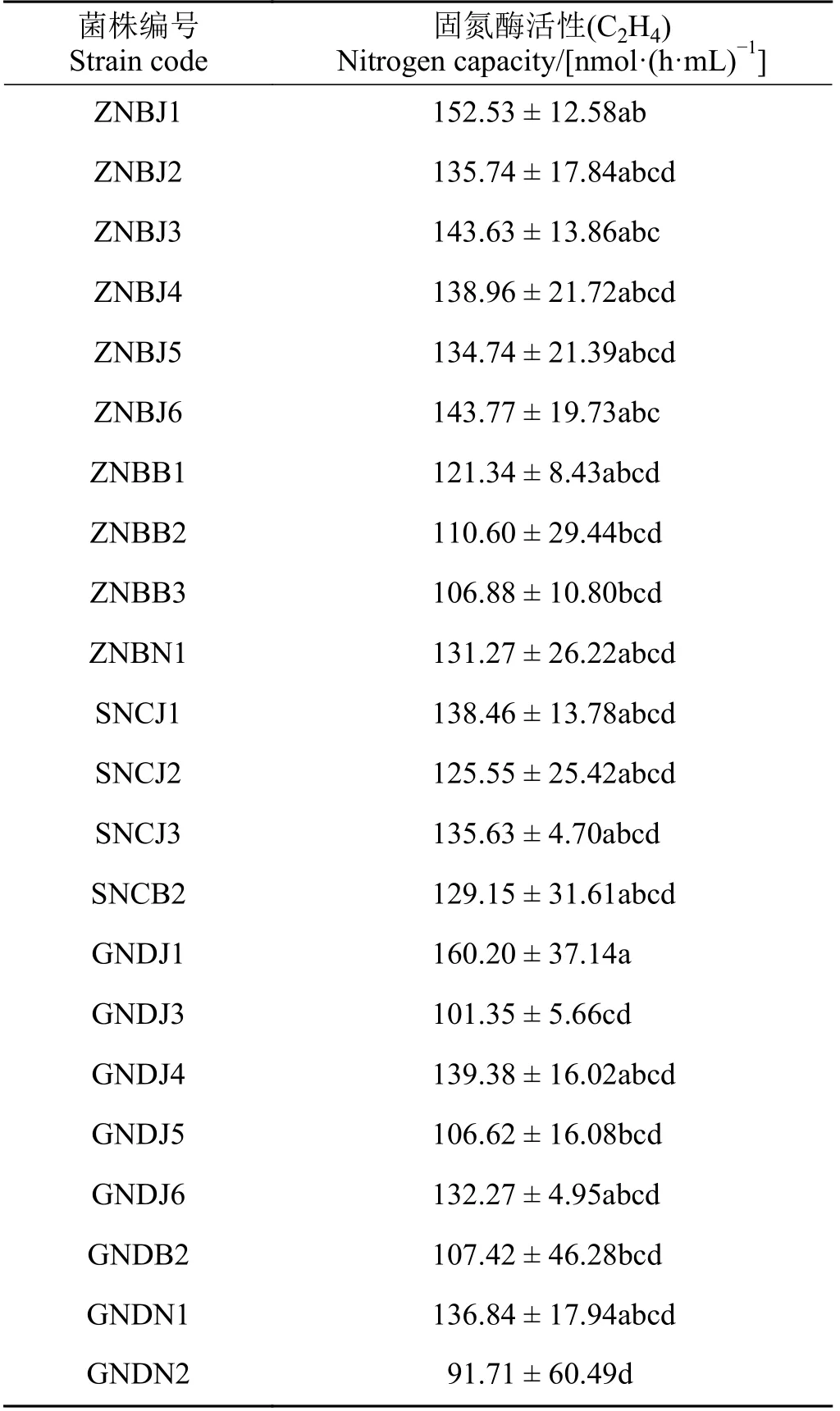
表3 PGPR 菌株固氮能力Table 3 Nitrogen fixing capacity of PGPR strains
2.2.3分泌激素菌株特性测定
对上述溶磷、固氮PGPR 分泌IAA 能力定性判断(表4),发现14 株菌株具有分泌IAA 能力,其中ZNBJ1、ZMBN4、ZPBN1、SNCJ3、SPCJ2、SPCB4 在显色反应中呈现深粉色,其余菌株为浅粉色。利用高效液相色谱法对14 株PGPR 分泌激素含量测定发现,菌株分泌赤霉素、IAA、玉米素的含量分别为0.52~139.22、0.10~0.92 和0.12~0.99 μg·mL-1;其中,菌株ZMBN4 分泌赤霉素能力最强,显著高于其他菌株(P< 0.05),菌株SPCB4 分泌IAA 和玉米素能力均最强,相比其他菌株差异显著(P< 0.05)。
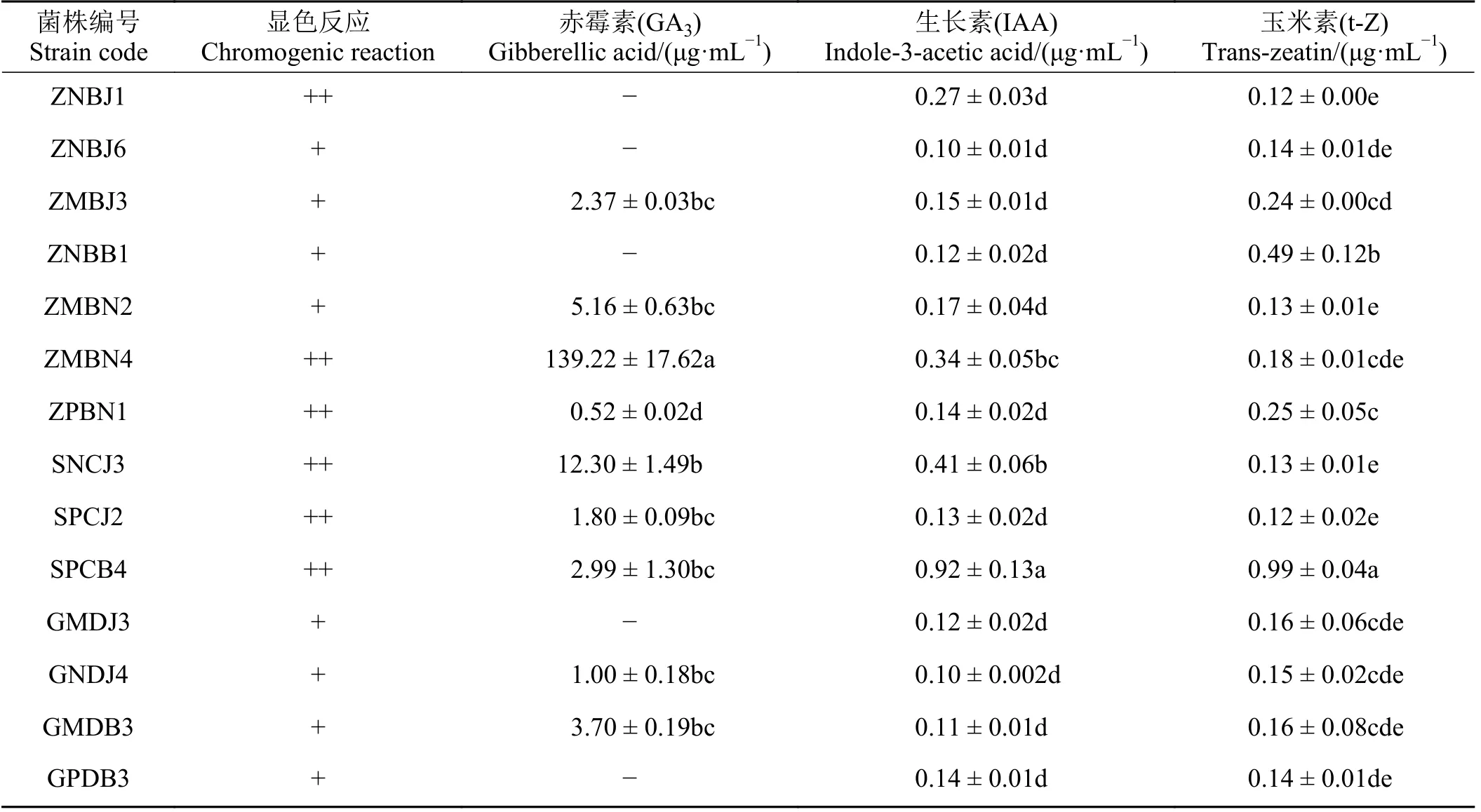
表4 PGPR 菌株分泌植物激素能力Table 4 Ability of PGPR strains to secrete plant hormones
2.3 菌株综合促生特性评价
对前期筛选的53 株菌株综合特性测定,共筛选出12 株优良PGPR(表5),其中菌株ZMBJ3、ZMBN4、SPCJ2、SPCB4 同时具有固氮、溶有机磷、溶无机磷、分泌3 种激素的能力,ZMBJ2 溶有机磷能力较强;ZPBN1、GPDB3 溶无机磷能力较强;ZNBJ1、ZNBJ3、GNDJ1、GNDJ4、GNDN1 固氮能力较强,综合测定发现上述12 株PGPR 促生特性较全面,可为后期微生物复合菌剂研制提供菌种资源。
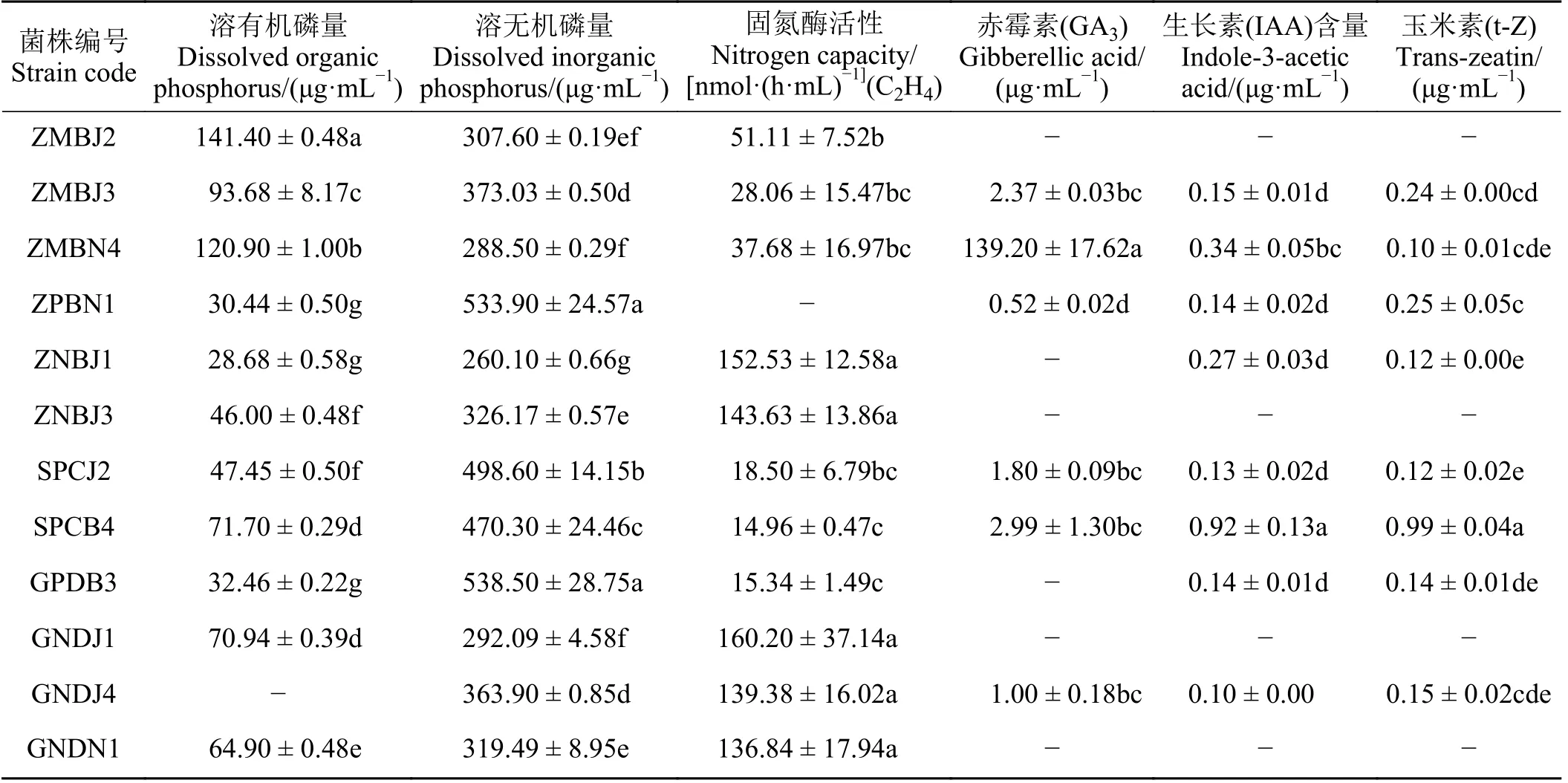
表5 优良PGPR 菌株综合特性Table 5 Comprehensive characteristics of excellent PGPR strains
2.4 优良PGPR 菌株的鉴定
通过对12 株优良PGPR 测序,使用Ezbiocloud进行同源序列比对,MEGA 7.0 构建系统发育树后,发现本研究测定的12 株菌株16S r DNA 基因序列与所选参比序列的相似度均高于98% (表6)。鉴定结果表明,菌株SPCB4 为华西肠杆菌(Enterobacter huaxiensis),其余11 株菌株均为假单胞菌属,其中ZNBJ3、ZNBJ1、SPCJ2、GPDB3、GNDN1、GNDJ1 为Pseudomonas piscium;ZPBN1、ZMBJ3 为Pseudomonas neuropathica;ZMBJ2 为Pseudomonas pisciculturae;ZMBN4 为Pseudomonas bubulae;GNDJ4 为Pseudomonas mucoides。
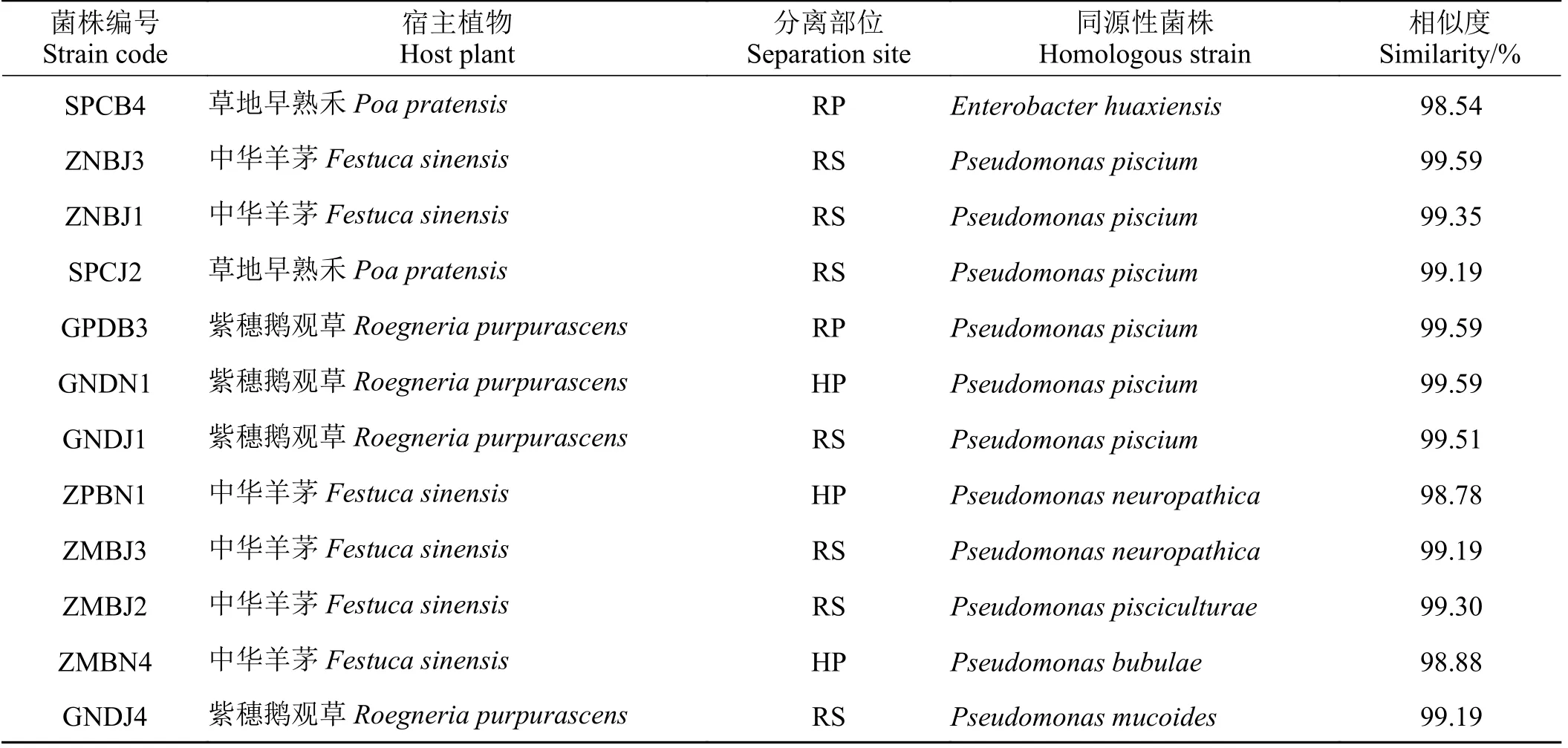
表6 优良PGPR 菌株鉴定Table 6 Identification of superior PGPR strains
3 讨论
本研究发现菌株溶磷量与菌液pH 没有相关关系,这与赵小蓉等[25]、Narsian 和Patel[26]研究结果一致,而张亮等[27]对5 株自生固氮菌溶磷机制的研究发现,培养基pH 与磷含量呈显著负相关关系;康贻军等[28]也发现溶磷菌的溶磷量与培养介质pH 之间存在良好的相关性。对于溶磷菌的溶磷量与菌液pH 相关性的研究,出现不同的研究结果,究其原因可能与菌株在不同时期的代谢活动有关,溶磷过程较复杂,菌株在溶磷时会产生有机酸,如草酸、乳酸、苹果酸、柠檬酸等,在有机酸的作用下,导致菌液呈酸性。不同菌株在不同生长时期产生有机酸种类及含量不同,导致研究结果不同[29-30]。因此,研究菌株培养过程中产生的有机酸及含量,了解溶磷量与培养液pH 的动态变化,才能明确分析其相关关系。
根际固氮菌是定殖于植物根际的固氮细菌,这类细菌不仅为植物生长提供氮素营养,还能活化土壤微生物,从而促进植物生长[31]。杨婉秋等[20]从天祝高寒草甸5 种牧草根际分离20 株固氮菌,固氮酶活性为5.23~64.87 nmol·(h·mL)-1(C2H4);而本研究从海北高寒草甸3 种牧草根际分离到22 株固氮能力优良的菌株,固氮酶活性为91.71~160.20 nmol·(h·mL)-1(C2H4)。固氮酶活性不同主要指微生物体内钼铁固氮酶活性不同,钼铁固氮酶由铁蛋白和钼铁蛋白组成[32],主要受样地生境条件和寄主植物种类影响,本研究采集样地海拔低于天祝高寒草甸,且采集牧草均为多年生禾本科牧草,生长季较长,使本研究固氮酶活性相对较高。
植物激素(plant hormones, PHs)是植物体内可自身合成的微量有机物,在低浓度下参与并调控植物生长发育[33]。除植物外,微生物也能分泌生长素(indole-3-a cetic acid, IAA)、赤 霉 素(gibberellic acid,GA3)、玉米素(trans zeatin, t-Z)等植物激素,这些微生物分泌的植物激素释放到土壤中,共同参与调控植物生长发育[34]。高亚敏等[22]从天祝高山草原优良牧草嵩草(Kobresia myosuroides)、珠芽蓼(Polygonum viviparum)根际分离的菌株在28 ℃培养后发现,菌株分泌IAA、GA3和t-Z 含量分别为0.24~69.98、0.34~68.87 和0.11~47.59 μg·mL-1,刘婷等[35]在同一样地采用相同方法分离无脉苔草(Carex enervis)根际PGPR,发现IAA 分泌量为8.20~86.36 μg·mL-1,GA3分泌量为26.36~135.90 μg·mL-1,t-Z 分泌量为9.55~141.68 μg·mL-1;本研究测定了3 种牧草根际促生菌分泌激素的能力,发现不同菌株分泌激素种类和含量存在差异,其中从中华羊茅根际分离的菌株分泌GA3能力最强,而早熟禾与紫穗鹅观草分泌3 种激素的能力差异不明显。从3 种牧草根际分离的菌株分泌激素(IAA、GA3和t-Z)含量分别为0.10~0.92、 0.52~139.22、0.10~0.99 μg·mL-1,其中GA3分泌量与前人研究基本相同,而IAA 与t-Z 分泌量较低。造成这种结果的原因是采样地、植物种类与培养温度的不同[36]。本研究培养温度为15 ℃,说明低温不利于菌株分泌IAA 与t-Z,而对GA3分泌没有影响。
鉴定的12 株优良PGPR 中,有11 株假单胞菌属和1 株肠杆菌属。假单胞菌属细菌生态适应性广,主要分布于土壤、水和其他基质上,是世界上最复杂的细菌属之一,也是种类最多的,并且物种数目在逐年增加[37]。据报道,大多数假单胞菌属不仅可以促进植物生长,还能防治植物病害,生防机理包括竞争营养物质、诱导植物抗性、产生抑菌物质等[38-39],生防作用有待进一步研究。目前发现华西肠杆菌对部分临床常用抗菌药物耐药,其研制微生物菌剂的安全性尚不明确,若作为微生物接种剂,需要对其致病性和安全性检测[40]。本研究鉴定的优良PGPR 主要是假单胞菌属,并未发现芽孢杆菌属,可能与牧草本身及生存的生境条件有关,此外芽孢杆菌耐受温度范围较广,大多为20~50 ℃,本研究筛选温度会使一些低温适应性菌株优先生长,不适宜大多数芽孢杆菌生长繁殖。目前,国内对PGPR的研究及相关菌剂产品研发较多,但存在不同菌剂对环境的适应性不同的问题。因此,可以借鉴国外的经验,从特定气候、生境中筛选PGPR 菌株,以生产出适合特定气候、生境的微生物菌剂[41],另外,国内外对于PGPR 的研究主要集中在对作物生长促进方面[42],而针对草地与牧草的微生物菌剂研制较少。本研究筛选的菌株对低温有良好适应性,利用其研制微生物菌剂对后期高寒地区天然草地植被恢复具有重要意义。
4 结论
共分离到181 株菌株,分离自中华羊茅根际59株、草地早熟禾根际64 株、紫穗鹅观草根际58 株,菌株在3 种牧草根际均表现出RP > RS > HP 的分布规律。通过促生特性综合测定,共筛选12 株综合促生特性较强,有进一步研究利用价值的菌株,其中有1 株肠杆菌属(Enterobacter),11 株假单胞菌属(Pseudomonas),可用于微生物菌剂的研制。

