基于代谢组学的虾夷扇贝不同组织风味与营养成分变化差异
刘 蓉,刘雨曦,2,张玉莹,辛 然,郑建祎,秦 磊,
(1.大连工业大学食品学院,国家海洋食品工程技术研究中心,辽宁 大连 116034;2.辽宁省海洋水产科学研究院,辽宁 大连 116023)
虾夷扇贝()属珍珠贝目,富含蛋白质、多不饱和脂肪酸和矿物质等营养成分。据统计,2020年我国养殖贝类产量达到1 498.7万 t,居世界前列。以往研究发现,贝类的风味和营养成分与游离氨基酸、5′-核苷酸和脂质密切相关。游离氨基酸是生物体中不可缺少的营养素,常作为底物参与体内代谢,也可以有效改善食品口感。核苷酸是半必需营养成分,不仅能合成核酸,对水产品鲜味也有突出贡献。脂质是提供能量的重要物质,对于预防疾病,促进身体健康有重要作用。
在虾夷扇贝加工过程中,闭壳肌通常被保留,而大部分副产物(主要为外套膜和内脏)被丢弃,造成了资源浪费和环境污染的现象。扇贝内脏中含有高度不饱和脂肪酸,是值得开发的优质资源,也是制备高附加值保健食品及功能性食品的理想原料。外套膜的营养价值也不逊色于闭壳肌,富含氨基酸等活性成分,可用于生产天然调味料。除此之外,有学者研究从扇贝副产物中提取牛磺酸、氨基多糖、多肽等功能因子用于生物和医疗领域。所以获取虾夷扇贝不同组织中更多的营养和风味的信息是非常必要的,这不仅有益于不同偏好消费者对产品的选择,也能为扇贝深加工提供理论基础,从而避免资源浪费。
由于代谢等多种因素的影响,不同扇贝性别和组织中的营养组成不尽相同,液相色谱是常用的检测氨基酸和5′-核苷酸的方法,但该方法往往无法同时量化游离氨基酸和5′-核苷酸,且易受试剂干扰。稳定同位素标记结合液相色谱-质谱(stable isotope labeling combined with liquid chromatography-mass spectrometry,SIL-LC-MS/MS)联用方法可消除复杂基质的影响,检出限低,灵敏度较高。此外,Q-Exactive轨道阱质谱是高效的脂质组学检测方法,具有高分辨率、灵敏度和质量准确度的特点。本研究通过使用SIL-LC-MS/MS的靶向代谢组学和使用超高效液相色谱-Q-Exactive轨道阱串联质谱的非靶向脂质组学方法,明确雌雄扇贝不同组织的风味和营养物质组成变化,有助于扇贝副产物的进一步加工,提高扇贝经济价值。
1 材料与方法
1.1 材料与试剂
新鲜虾夷扇贝购于大连市长兴市场(扇贝采集时间为12月份,海表温度在零上3.8 ℃左右),在2 h内加冰转移到实验室。扇贝洗干净后,按雌雄分成2 组,性腺颜色白色为雄性,黄色为雌性。每组分割成5 种不同的组织,包括性腺、闭壳肌、外套膜、消化腺和鳃。将雌性和雄性扇贝的不同组织切成小块并立即贮存在-80 ℃中。
-谷氨酸-2,4,4-(-Glu,98%) 美国剑桥同位素实验室;-天冬氨酸-2,3,3-(-Asp,99%) 加拿大CDN同位素实验室;-亮氨酸(Leu,98%)、-精氨酸(Arg,98%)、-蛋氨酸(Met,99%)、-天冬酰胺(Asn,98%)、-组氨酸(His,99%)、-丝氨酸(Ser,99%)、-丙氨酸(Ala,99%)、-甘氨酸(Gly,99%)、-赖氨酸(Lys,98%)、-色氨酸(Trp,98%)、-谷氨酸(Glu,98%)、-异亮氨酸(Ile,≥98%)、-脯氨酸(Pro,≥99%)、-缬氨酸(Val,≥98%)、-半胱氨酸(Cys,97%)、-苏氨酸(Thr,≥98%)、-天冬氨酸(Asp,99%)、-苯丙氨酸(Phe,99%)、-谷氨酰胺(Gln,99%)、-酪氨酸(Tyr,99.0%~101.0%)、5′-单磷酸胞苷(cytidine 5′-monophosphate,CMP,99%)、5′-单磷酸肌苷(inosine 5′-monophosphate,IMP,99%)、5′-单磷酸鸟苷(guanosine 5′-monophosphate,GMP,99%)、5′-单磷酸腺苷(adenosine 5′-monophosphate,AMP,99%)、5′-单磷酸尿苷(uridine 5′-monophosphate,UMP,99%)、5′-单磷酸黄嘌呤(xanthine 5′-monophosphate,XMP)、三酰甘油(triacylglycerol,TAG,17:0/17:0/17:0) 美国Sigma Aldrich公司;磷脂酰胆碱(phosphatidylcholine,PC,17:0/17:0)、磷脂酰乙醇胺(phosphatidyl-ethnolamine,PE,17:0/17:0)、磷脂酰甘油(phosphatidyl-glycerol,PG,17:0/17:0) 阿拉丁(上海)试剂有限公司;-羟脯氨酸(Hpro,99%)北京Solarbio试剂有限公司;C-胞苷单磷酸 加拿大TRC公司;溶血磷脂酰胆碱(lysophosphatidylcholine,LPC,17:0) 美国Avanti Polar Lipid公司。
1.2 仪器与设备
QTRAP 5500高效液相色谱-串联质谱 美国SCIEX公司;Q-Exactive-HF-X超高效液相色谱-Q-Exactive轨道阱串联质谱 美国赛默飞世尔科技有限公司;CF16RXII高速冷冻离心机 日本日立公司;DN-12A氮气吹干仪 天津市乐康科技有限公司。
1.3 方法
1.3.1 游离氨基酸和5′-核苷酸含量的测定
1.3.1.1 样品处理
在冰浴条件下,取2 g虾夷扇贝样品加入去离子水(1∶5(g/mL))均质,将样本在4 ℃下以9 190×离心10 min,移取25 μL上清液加入75 μL去离子水混合,每个样品各加入100 μL内标混合物,用氯仿-甲醇混合液(2∶1,/)定容至1 mL,均匀振荡1 min;4 ℃条件下静置10 min,以22 400×离心10 min,取上清液100 μL于真空离心浓缩机中蒸发至干;用1 mL流动相A相复溶,20 000×离心10 min后进样分析。每个样品进行3 组平行实验。
1.3.1.2 色谱条件
ACE Excel 3 AQ色谱柱(150 mm×3.0 mm);流动相A为0.1%甲酸溶液;流动相B为0.1%甲酸-乙腈溶液;洗脱梯度:0~0.5 min,98% A,2% B;0.5~10.0 min,75% A,25% B;10.1~12.0 min,10% A,90% B;12.1~18 min,98% A,2% B。流速0.4 mL/min;柱温30 ℃;进样量2 µL。
1.3.1.3 质谱条件
质谱监测采用多反应监测正离子模式;源参数为:入口电位10 V;离子喷雾电压5 500 V;帘气20 psi;去溶剂温度600 ℃;离子源Gas1和离子源Gas2为60 psi。
1.3.1.4 定量分析
配制质量浓度分别为0.1、1、10、20、50、100、200、500、700、1 000 ng/mL混合标准溶液。以混标中待测物与内标的峰面积比为纵坐标,以标准品质量浓度为横坐标绘制标准曲线。通过标准曲线计算样品中待测物浓度。
1.3.2 脂质组成测定
1.3.2.1 样品处理
取2 g虾夷扇贝样品,在10 mL去离子水和7.5 mL氯仿-甲醇混合物(2∶1,/)中匀浆,在4 ℃条件下以9 190×离心10 min。取下层(有机层)放入预先称量的样品瓶中用氮气吹干,用甲醇复溶至终质量浓度10 mg/mL,取50 μL样品溶液与50 μL内标溶液混合,用400 μL甲醇溶液稀释至样品质量浓度为1 mg/mL,20 000×离心10 min后进样分析。每个样品进行3 组平行实验。
1.3.2.2 色谱条件
Acquity UPLC BEH C色谱柱(2.1 mm×100 mm,1.7 μm);流动相A:0.1%甲酸铵-乙腈(60∶40,/),流动相B:0.1%甲酸铵-异丙醇-乙腈(90∶10,/);洗脱梯度:0~2 min,85%~70% A,15%~30% B;2~2.5 min,52% A,48% B;2.5~11 min,18% A,82% B;11~11.5 min,1% A,99% B;11.5~12 min,1% A,99% B;12~12.1 min,85% A,15% B;12.1~15 min,85% A,15% B。柱温65 ℃;流速0.6 mL/min;进样量1 μL。
1.3.2.3 质谱条件
采用电喷雾离子源;正离子模式和负离子模式进行检测;质量扫描范围/120~1 200;鞘气流量60%;辅助气流量25%;吹扫气流量2%;毛细管温度380 ℃;辅助气体加热器温度370 ℃;正离子模式喷雾电压3.6 kV,负离子模式喷雾电压3.0 kV。
1.3.2.4 TAG计算
使用LipidBlast数据库,通过匹配MS/MS相似性和同位素比值对脂质结构进行鉴定。以TAG(17:0/17:0/17:0)、LPC(17:0)、PC(17:0/17:0)、PE(17:0/17:0)、PG(17:0/17:0)作为脂质内标,对不同脂质分子进行半定量分析。相同类型脂质的质谱响应强度相似,可用于半定量的响应信号校正。例如,使用TAG(17:0/17:0/17:0)对所有TAG进行半定量。按下式定量:

式中:为样品溶液中检测到的脂质质量浓度/(μg/mL);为样品中加入的内标质量浓度/(μg/mL);、为色谱图峰高。
1.4 数据处理
使用MS-DIAL对数据进行预处理和定性分析,使用MetaboAnalyst 4.0对氨基酸、5′-核苷酸和脂质进行主成分分析(principal component analysis,PCA),使用Excel 2017和SPSS 22.0对数据进行统计分析。
2 结果与分析
2.1 不同组织中的游离氨基酸和5′-核苷酸含量分析
如图1所示,一共检测到21 种游离氨基酸,不同部位的氨基酸含量为200.42~420.31 μg/g。雌性扇贝各组织中游离氨基酸含量从大到小依次为消化腺>闭壳肌>性腺>外套膜>鳃,而雄性扇贝各组织含量为闭壳肌>消化腺>外套膜>性腺>鳃。由图1A可知,在雄性扇贝中,Gly含量最丰富,占总游离氨基酸的47.90%,尤其是在闭壳肌中可达280.37 μg/g。Glu在消化腺和闭壳肌中含量较高,分别为31.40 μg/g和81.53 μg/g。在雌性扇贝中(图1B),Glu和Gly在闭壳肌中占比最大,其次是性腺中的Gly,含量可达144.23 μg/g。21 种氨基酸根据风味可分为:鲜味、甜味、苦味和无味氨基酸。在图1A、B中,甜味氨基酸中Gly和Ala的含量高于Thr、Pro、Ser和Gln。Glu是扇贝中主要的呈鲜味氨基酸,各组织中苦味氨基酸和无味氨基酸含量相对较低。

图1 雌雄扇贝不同组织中游离氨基酸和5′-核苷酸含量的比较Fig.1 Comparison of free amino acid and 5′-nucleotide contents in different tissues of female and male P.yessoensis
如图1C所示,在虾夷扇贝中共检测到6 种5′-核苷酸。其中AMP和IMP的含量最高。AMP主要在闭壳肌和外套膜中积累,雌性闭壳肌中AMP的含量可达22.77 μg/g,约为雄性闭壳肌的2 倍。IMP在雄性扇贝里含量较高,且有85.45%贮存于外套膜。此外AMP和IMP及其衍生物是主要的呈鲜味核苷酸,且AMP具有压抑苦味产生理想甜味和咸味的特性。
从滋味的角度分析,消化腺中含有较多Asp、Gly、Glu等而具有鲜甜味,又因其含有多种人体必需氨基酸,所以消化腺是风味与营养共同具备的部位。外套膜含有AMP、IMP、Glu而呈鲜味。闭壳肌是扇贝主要的食用部分,其呈味氨基酸占游离氨基酸总量的91%以上,AMP含量高达总核苷酸的50%,从而使闭壳肌的鲜甜味极为丰富。
2.2 游离氨基酸和5′-核苷酸偏最小二乘判别分析(partial least squares-discriminant analysis,PLS-DA)
通过PLS-DA可以有效对样品进行区分,并找到导致组间区别的影响变量。由图2A可知,雌雄个体之间氨基酸变化差异较小,但在不同部位之间差异明显。前两个主导成分分别占38.3%和26.6%。闭壳肌位于第1象限,消化腺位于第2象限,性腺、鳃和外套膜主要位于第3、4象限。由图2B、C可知,Lys、Gly、Hpro、Asp、Phe、AMP、Trp、Met、XMP、IMP、Asn是引起各组分差异的主要氨基酸(变量投影重要性(variable importance in projection,VIP)>1)。其中Gly、Hpro和AMP是影响闭壳肌的主要因素,Gly和Hpro两者皆可通过食物摄入人体,Gly不仅可以为其他氨基酸提供氮源,还具有调节免疫系统、抗炎等作用。除此之外Gly也是体内合成谷胱甘肽的重要原料。Hpro是胶原组织主要成分之一,对皮肤弹性有重要作用。Lys、Trp、Met、Phe为人体必需氨基酸,其总量在各部位的排序为消化腺>外套膜>性腺>鳃>闭壳肌。Asp和Asn主要存在于消化腺中,Asp参与人体三羧酸代谢,在医学上常将其用于治疗高血压等疾病。AMP是差异最显著的5′-核苷酸,IMP和XMP次之;三者在闭壳肌和外套膜中占主导。AMP是ATP代谢的产物,代谢速率与扇贝所处环境有重大关系。在正常生物代谢中AMP降解为IMP,进一步代谢生成肌酐和黄嘌呤。但在水产品中AMP很少量产生或几乎不产生IMP,而是直接代谢成腺苷从而转化为肌酐。这可能是扇贝中IMP含量远少于AMP的原因。

图2 虾夷扇贝不同部位游离氨基酸和5′-核苷酸PLS-DAFig.2 PLS-DA analysis of free amino acids and 5′-nucleotides in different parts of P.yessoensis
2.3 游离氨基酸和5′-核苷酸相关性分析
通过偏最小二乘回归(partial least squares regression,PLSR)对不同虾夷扇贝游离氨基酸和5′-核苷酸之间的关系进行综合分析。由图3可知,氨基酸与核苷酸之间存在相关性。闭壳肌中AMP和UMP与Glu、Gly、Hpro相互影响。在外套膜中IMP和Cys相关性较强,且组分1可达0.75。而CMP的含量与多种氨基酸相关如:Gln、His、Thr等。Glu和核苷酸协同作用,会极大地增加贝类的鲜甜味。有研究证明,在非挥发性的游离氨基酸、核苷酸、呈味多肽等物质的共同影响下使产品的风味更加独特。
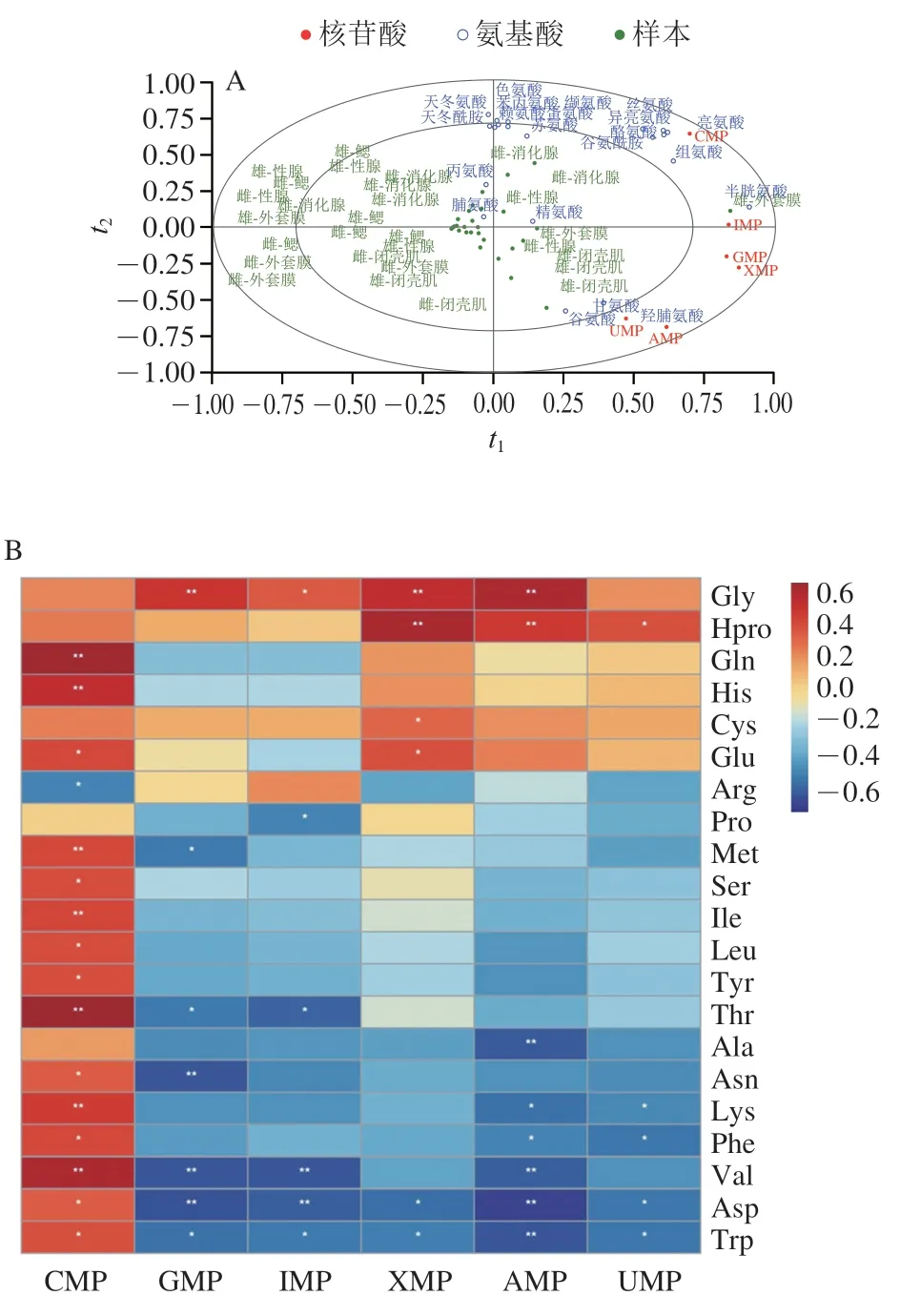
图3 虾夷扇贝中游离氨基酸和5′-核苷酸相关性PLSR分析Fig.3 PLSR analysis of free amino acids and 5′-nucleotides in P.yessoensis
2.4 不同组织中的脂质含量变化
从虾夷扇贝中共检测到188 种脂质,包括磷脂134 种,甘油酯46 种,其他脂质8 种。其中磷脂分为PC、磷酯酰肌醇(phosphatidylinositol,PI)、PE和溶血磷脂;甘油酯主要为TAG;其他脂质包括游离脂肪酸、鞘脂等(图4)。在虾夷扇贝中磷脂含量最高,其次是甘油酯,其他类脂质含量最低,这与之前的研究结果相同。通过热图聚类分析可知,磷脂和甘油酯分别聚集在一起,且在扇贝各组织间均有积累。

图4 雌雄扇贝不同组织中的脂质含量变化热图分析Fig.4 Heatmap of changes in lipid content of different tissues of male and female P.yessoensis
2.5 不同组织中的脂质组成变化
由图5A可知,扇贝中的脂质受性别和组织部位的影响。PC1和PC2分别为45.1%和39.3%,外套膜、性腺、闭壳肌分布在第1、4象限;消化腺和鳃分布在第2、3象限。雌性扇贝闭壳肌在所有部位中所占比重最大,雌雄扇贝的鳃和闭壳肌差异最显著。图5B结果显示,与其他部位相比消化腺中TAG含量最高,在雌雄扇贝中分别占总甘油酯的49.36%和33.11%。雌性扇贝性腺磷脂含量高于雄性,而2 种扇贝外套膜中脂质含量差异较小,在各部位的变化趋势相同。磷脂是闭壳肌中的主要脂质,且雄性闭壳肌磷脂含量高于雌性。

图5 雌雄扇贝不同组织脂质组成分析Fig.5 Analysis of lipid composition in different tissues of male and female P.yessoensis
2.6 不同组织中脂质组成变化的PLS-DA
如图6A所示,与PCA结果相同雌雄扇贝闭壳肌差异最显著,但其他部位脂质组成相似。图6B表明,脂质分子与虾夷扇贝各部位在空间分布中具有明显的特征性对应且分布范围较广,闭壳肌中磷脂种类最丰富,消化腺受甘油酯的影响较大。通过图6C挑选出的30 种标志性变化物质(VIP>1.2)可知,影响扇贝各部位差异的脂质主要为磷脂,大部分磷脂在闭壳肌中含量较高,其次是性腺,这与楼乔明等所得结果一致。性腺的发育与脂质密切相关,雌性扇贝在产生配子及繁殖的过程中需要大量能量,这可能是雌性性腺脂质含量高于雄性的主要原因。此外,磷脂是所有活细胞膜的主要成分,是人体必不可少的物质,具有降低血清和肝脏胆固醇,改善记忆和免疫功效,对人体大脑、心脏、肝脏、骨骼肌、脂质代谢等功能至关重要。扇贝产品中的高磷脂含量将有助于提升其营养价值。


图6 雌雄虾夷扇贝不同部位脂质PLS-DAFig.6 PLS-DA of lipids in different parts of female and male P.yessoensis
3 结论
深入研究雌雄虾夷扇贝营养和风味成分在各组织间的变化。扇贝闭壳肌中游离氨基酸含量较高,以Glu和Gly为主。AMP是虾夷扇贝中含量最高的5′-核苷酸,在闭壳肌和外套膜中积累较多。不同组织中共检测到188 种脂质,包括磷脂134 种,甘油酯46 种,鞘脂和游离脂肪酸等8 种。甘油酯主要贮存在内脏中,闭壳肌中磷脂含量较多,磷脂可能是引起扇贝组织营养和风味差异的关键脂质。本研究结果可从营养和风味的角度为虾夷扇贝的科学研究提供数据支撑,有助于更好地认识扇贝的食用功能,为扇贝副产物作为新型功能食品来源的利用提供理论依据,有效避免资源浪费,有益于不同偏好消费者对扇贝不同部位的选择,促进合理消费,为虾夷扇贝的进一步精深加工和综合利用及推动扇贝养殖和加工行业的经济发展奠定基础。

