没药甾酮下调TLR4/NF-κB通路减轻脓毒症相关性脑病神经炎症反应机制探究*
李 探 徐宏彬 张潇月 邵龙刚 刘克琴
(江苏省第二中医院,江苏 南京 210000)
脓毒症相关性脑病(SAE)是脓毒症严重的中枢神系统并发症,目前临床上缺乏有效的治疗手段,其根本原因在于SAE的发生机制尚未阐明[1]。炎症反应的失衡是导致脓毒症多并发症、高死亡率的最根本因素,而神经炎症反应也是导致SAE发病的最重要的机制之一。Toll样受体4(TLR4)/核转录因子-κB(NF-κB)通路作为经典的固有免疫应答通路,也是诱导SAE神经炎症反应最重要的信号通路[2-3]。但遗憾的是目前SAE仍缺乏特异性的药物治疗,临床上仍以积极的液体复苏、抗感染、脏器功能保护等对症治疗为主,结果均不理想。
SAE多归属于中医学“神昏”范畴,病机多为热毒、痰浊、瘀血而致气机逆乱,上扰神明,蒙蔽清窍,进而令各脏器损伤,治疗方药亦以清热、涤痰、通腑逐瘀之品为主[4]。乳香-没药药对作为中药经典的配伍,始见于“乳香止痛散”。《本草纲目》言“乳香活血,没药散血,皆能止痛、消肿、生肌,故二药每每相兼而用”,可协同互补,增强药力,为宣通脏腑,流通经络之要药,现代医学常用于抗炎、抗肿瘤、抗氧化、改善认知等[5],以其为基础的经典名方“西黄丸”在乳腺癌、肝癌、肺癌等恶性肿瘤的治疗中,因其显著的抗炎作用取得了显著疗效[6],这也为乳香-没药在SAE中的应用提供了强有力的模板和支撑。最新研究报道,没药的主要成分没药甾酮(GS)具有显著的抗炎作用,可通过抑制脑内胶质细胞活化以及TLR4、NF-κB、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)等的产生,减轻神经炎症反应、改善神经功能[7-8]。为研究乳香-没药药对在SAE中的作用,故我们前期选择没药的主要活性成分GS进行了相关的细胞实验研究。
1 材料与方法
1.1 试药与仪器
LPS、GS购自美国 Sigma公司(L2630、370690);CCK-8检测试剂盒购自日本同仁化学研究所(CK04);TLR4、β干扰素TIR结构域衔接蛋白(TRIF)、髓样分化因子(MyD88)、NF-κB、磷酸化NF-κB(p-NF-κB)抗体购自美国Cell Signaling Technology公司(143585、45965、42835、8242、3033);TNF-α、IL-1β、转化生长因子-β(TGF-β)、IL-10 ELISA检测试剂盒购自美国Abcam公司(ab208348、ab197742、ab215715、ab189392)。多功能酶标仪(美国Thermo公司);DMI 6000B倒置显微镜(德国Leica公司);Odyssey双色红外激光成像系统(美国LI-COR公司);电泳仪、转膜槽等(美国Bio-BAND公司)。
1.2 细胞培养与分组
小鼠小胶质细胞系BV2细胞购自中国科学院上海细胞库。用含有10%胎牛血清、100 μmol/L青霉素和链霉素的DMEM培养液(美国Gibco公司),在5%CO2、37℃条件下培养。当细胞长至培养皿底部80%时,用胰酶消化并接种至孔板中,待细胞长至孔板底部80%时,弃去旧培养液,分组加入含不同浓度药物的完全培养液,分为空白对照(NC组)、LPS组、LPS+GS组。
1.3 标本采集与检测
1.3.1 CCK-8法检测细胞增殖 取对数生长期细胞接种于96孔板中,每孔细胞量为1×104,每孔液体量为100 μL。首先进行给药浓度梯度测定:LPS处理浓度梯度为0.1、0.3、1、3、10、30 μg/mL,GS处理浓度梯度为0.3、1、3、10、30、100 μg/mL,每个浓度3个复孔,处理24 h后,于培养箱中反应2 h,用酶标仪测450 nm处OD值,每组实验重复4次。时间梯度:LPS+GS联合给药6、12、24、48、72、168 h,加入10%CCK-8试剂,于培养箱中反应2 h,用酶标仪测450 nm处OD值,每组实验重复4次。存活率计算:存活率(%)=OD实验组平均值÷OD对照组平均值×100%。
1.3.2 Western blotting检测蛋白表达 取对数生长期细胞接种于6孔板中,每孔细胞量为3×105,每孔液体量为3 mL。用LPS单药(1 μg/mL)、LPS+GS(1 μg/mL+30 μg/mL)处理细胞,6、12、24 h后提取蛋白。BCA法测定样品蛋白浓度,上样量为30 μg。样品经SDSPAGE电泳分离,之后转移至NC膜上,用5%BSA室温下在摇床上封闭1 h,用封闭液稀释抗体(β-actin抗体按1∶5 000稀释,其余一抗按1∶1 000稀释),一抗4℃孵育过夜,之后用PBST洗膜3次,每次10 min,二抗室温下避光孵育1 h,PBST洗膜3次,每次10 min,用Odyssey红外激光成像系统采集图片,用Odyssey软件分析图像。实验重复3次。结果分析:采用Image J图像分析系统,对蛋白条带的相对灰度进行分析,计算各组的OD值,以目的蛋白与内参灰度的比值表示目的蛋白的相对表达量。
1.3.3 ELISA法检测细胞因子表达 取对数生长期细胞接种于6孔板中,每孔细胞量为3×105,每孔液体量为3 mL。用LPS单药(1 μg/mL)、LPS+GS(1 μg/mL+30 μg/mL)处理细胞,6、12、24 h后提取蛋白。严格按照试剂说明书进行操作,操作完毕后采用酶标仪进行做出OD值曲线,读出相应的OD值。
1.4 统计学处理
采用Graphpadprism5.0软件进行统计分析及绘图,计量资料符合正态分布者以()表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 LPS和GS单独及联合给药对BV2细胞增殖的影响
见表1,表2,图1。LPS和GS单独给药24 h,LPS浓度在0~1 μg/mL时对细胞增殖影响不大,当≥3 μg/mL时细胞增殖被显著抑制(P<0.01),GS在浓度100 μg/mL时细胞增殖被显著抑制(P<0.01),结合既往研究报道,选择LPS(3 μg/mL)和GS(30 μg/mL)作为联合给药浓度,联合给药后GS能显著增加细胞增殖,随时间增长无显著统计学差异(P<0.05)。
表1 LPS和GS单独给药对BV2细胞增殖的影响(%,±s)

表1 LPS和GS单独给药对BV2细胞增殖的影响(%,±s)
注:与1 μg/mL组比较,*P<0.01;与30 μg/mL组比较,△P<0.01。
LPS 0 μg/mL 0.1 μg/mL 0.3 μg/mL 1 μg/mL 3 μg/mL 10 μg/mL 30 μg/mL n 5 5 5 5 5 5 5增殖率100.00±2.06 98.64±1.31 97.44±2.29 93.32±10.29 74.88±14.46*57.26±7.10*48.33±12.01*GS 0 μg/mL 0.3 μg/mL 1 μg/mL 3 μg/mL 10 μg/mL 30 μg/mL 100 μg/mL n 5 5 5 5 5 5 5增殖率100.00±0.44 95.32±1.65 92.09±4.63 94.38±2.18 92.52±1.93 87.35±9.17 51.06±7.72△
表2 LPS和GS联合给药各时间点BV2细胞增殖变化(%,±s)

表2 LPS和GS联合给药各时间点BV2细胞增殖变化(%,±s)
LPS(3 μg/mL)+GS(30 μg/mL)6 h 12 h 24 h 48 h 72 h 168 h n55 5 5 55增殖率100.00±0.44 95.32±1.66 88.75±9.77 90.51±13.58 87.45±10.64 85.83±13.62

图1 LPS和GS联合给药对BV2细胞增殖影响
2.2 GS对TLR4/NF-κB通路各关键蛋白表达的影响
见表3,图2。与NC组相比,LPS给药6、12、24 h,TLR4/NF-κB 通路相关蛋白(TLR4、TRIF、MyD88、NF-κB、p-NF-κB)表达量显著增加,差异有统计学意义(P<0.05);与LPS组相关,GS干预后能在一定程度上下调其相关蛋白的表达,差异有统计学意义(P<0.05)。
表3 各组细胞TLR4/NF-κB通路蛋白表达量比较(±s)

表3 各组细胞TLR4/NF-κB通路蛋白表达量比较(±s)
注:与NC组比较,△P<0.05;与LPS组比较,*P<0.05。
组别NC组(n=5)LPS组(n=5)LPS+GS组(n=5)时间6 h 12 h 24 h 6 h 12 h 24 h 6 h 12 h 24 h TLR4 0.22±0.07 0.28±0.07 0.28±0.07 0.23±0.06 0.45±0.06△0.92±0.06△0.18±0.07 0.18±0.05△*0.38±0.03△*TRIF 0.68±0.15 0.71±0.15 1.06±0.15 0.75±0.12 1.28±0.12△1.75±0.12△0.53±0.10△*0.93±0.12△*0.53±0.10△*MyD88 1.55±0.23 0.65±0.13 0.44±0.08 1.73±0.18 0.96±0.18△0.73±0.18△1.16±0.16△*0.72±0.16*0.34±0.06*NF-κB 1.72±0.15 0.85±0.15 1.42±0.15 2.23±0.19△1.64±0.19△2.23±0.20△1.17±0.17△*1.21±0.15△*1.12±0.17△*p-NF-κB 0.92±0.11 0.82±0.11 1.02±0.11 1.46±0.12△1.26±0.12△1.56±0.12△0.98±0.09*0.91±0.09*0.68±0.09△*
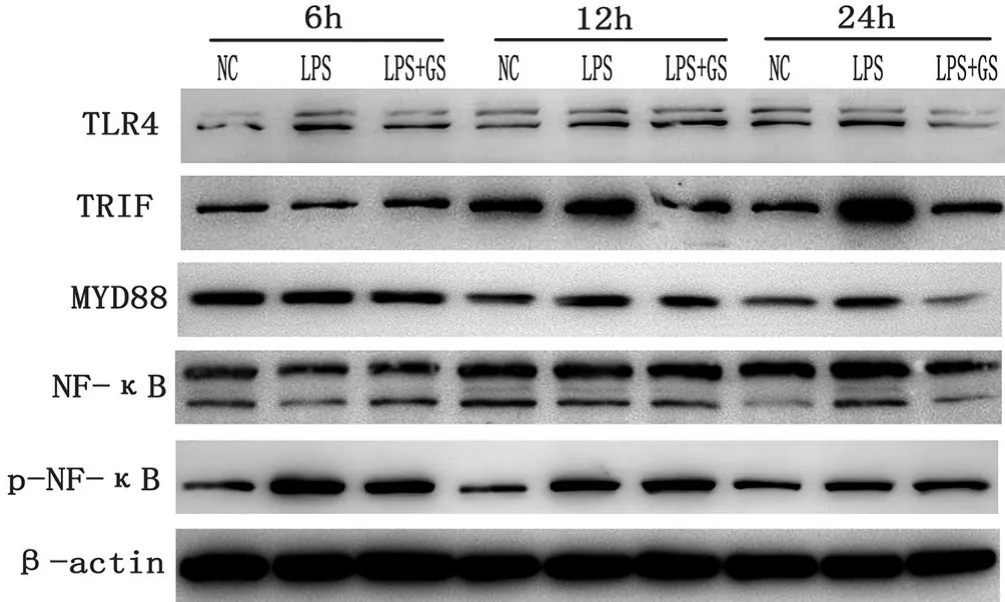
图2 免疫印迹法检测TLR4/NF-κB通路各蛋白表达情况
2.3 GS对细胞因子表达的影响
见表4。与NC组相比,LPS诱导后TNF-α、IL-1β表达量显著增加,差异有统计学意义(P<0.05);与LPS组相比,GS干预后能在一定程度上下调TNF-α、IL-1β表达,并上调TGF-β、IL-10的表达,差异有统计学意义(P<0.05)。
表4 各组相关细胞因子的表达比较(pg/mL,±s)

表4 各组相关细胞因子的表达比较(pg/mL,±s)
组别NC组(n=5)LPS组(n=5)LPS+GS组(n=5)时间6 h 12 h 24 h 6 h 12 h 24 h 6 h 12 h 24 h TNF-α 20.55±3.56 68.34±10.34 64.31±5.28 38.91±6.06△122.62±20.78△159.35±21.05△15.24±3.12*35.36±5.40△*121.81±8.21△*IL-1β 10.56±3.56 28.34±10.55 34.31±5.42 38.90±06.06△72.62±10.78△98.35±21.05△25.20±3.12△*42.36±5.40△*58.81±8.10△*TGF-β 1.45±0.56 3.34±1.34 4.31±1.42 4.96±1.06△3.34±1.34△18.35±2.05△10.21±2.12△*22.36±3.42△*28.81±3.17△*IL-10 3.45±0.56 8.34±1.34 24.31±5.42 8.91±1.06△22.62±3.78△38.35±8.05△15.23±2.12△*42.36±5.44△*58.81±8.28△*
3 讨论
脓毒症相关性脑病作为脓毒症严重的中枢神经系统并发症,因其较高的致死和致残率备受临床关注。虽然目前SAE的发病机制仍有诸多不明确之处,但感染所致的炎症反应作为脓毒症的始发因素,贯穿着脓毒症疾病的发生、发展过程,同样神经炎症反应也是导致SAE发病的最重要的机制之一,积极地干预炎症反应也是目前治疗脓毒症及其并发症的核心[1-2]。TLR4/NF-κB通路作为经典的固有免疫应答通路,是诱导SAE神经炎症反应最重要的信号通路。虽然目前对TLR4/NF-κB通路的活化机制相对明确,但近期被寄予厚望的TLR4受体结合的拮抗剂Eritoran(NCT00334828)和小分子TAK-242(NCT00633477)皆在三期临床宣告了失败[9-10]。因此,积极地深究其机制和寻找新型、高效的TLR4/NF-κB通路抑制剂具有重要的临床意义。
传统中药乳香-没药药对具有活血散瘀、宣通脏腑之功效,契合于SAE的病机——痰浊瘀血,蒙蔽清窍,现代医学常将其用于抗炎、抗肿瘤、抗氧化、改善认知等。脓毒症发生后各种因素导致血脑屏障的损伤,使得LPS有机会通过受损的血脑屏障进入脑组织中激活脑内的固有免疫细胞—小胶质细胞,进而激活TLR4/NF-κB信号通路[11]。当LPS与TLR4结合后,即开启下游一系列反应。这种由TLR4介导的信号通路又可分为2条途径:一种为MyD88依赖途径,一种为非依赖MyD88途径,也称TRIF依赖途径,在脓毒症中主要以MyD88依赖途径为主[12]。MyD88通过激活下游一系列信号因子,最终激活NF-κB并使之磷酸化,进而被转运到细胞核内,促进小胶质细胞释放细胞因子包括TNF-α、IL-1β、IL-6等。作为重要的细胞因子,TNF-α、IL-1β、IL-6不仅能够调节、诱导炎症细胞从血管向神经组织迁移,也能够直接激活细胞凋亡信号通路导致神经元凋亡。当这些细胞因子大量进入组织后,又可以作为胞外刺激因子再次激活NF-κB,形成正反馈的级联放大效应,进一步加重炎症反应[13-14]。本研究也发现,在LPS造模后6、12、24 h后,TLR4/NF-κB通路相关蛋白表达量显著增加,GS干预后能在一定程度上下调其相关蛋白的表达,且对细胞因子TNF-α、IL-1β表达有显著的抑制作用。
另外我们还发现,GS能够逆转LPS对BV2细胞的增殖抑制作用,且能够增加细胞因子IL-10和TGF-β的表达。小胶质细胞起源于胚胎时期的卵黄囊髓系祖细胞,是中枢神经系统内“唯一”的免疫细胞,相当于脑和脊髓中的“巨噬细胞”,在SAE神经炎症反应中扮演着不可或缺的角色[15]。小胶质细胞的形态高度可塑,当中枢神经系统发生出血、感染或创伤等病理改变时,小胶质细胞迅速活化,胞体增大,呈阿米巴样,突起变短甚至消失,并具备迁徙和吞噬能力[16-17]。活化的小胶质细胞依据抗原标志物和功能分为两种表型:M1表型和M2表型。M1表型是小胶质细胞的经典激活途径,主要表达CD16、CD32和CD86等表面抗原,分泌IL-1β、IL-6、TNF-α等促炎因子,介导炎症反应,并产生细胞毒性作用。M2表型是小胶质细胞的替代激活途径,主要表达精氨酸酶1(Arg-1)和CD206等表面抗原,分泌IL-10、胰岛素样生长因子-1(IGF-1)和TGF-β等抗炎因子,抑制中枢炎症反应的过度发生、分泌神经营养因子,对神经元发挥保护作用[18-20]。这也意味着,在LPS适当浓度的诱导下,小胶质细胞能够朝着M1型大量分化,而GS能够促使小胶质细胞朝着M2型分化,但具体调控机制尚不明确。
综上所述,我们推测GS具有调控SAE神经炎症反应作用,且其保护作用机制可能与下调TLR4/NF-κB信号通路表达及调控小胶质细胞定向分化有关,但具体的调控靶点尚不明确,需进一步探究。

