果生炭疽菌Rab蛋白家族鉴定及生物信息学分析
张丽勍,安海山,方献平,李水根,张学英
(上海市农业科学院林木果树研究所,上海市设施园艺技术重点实验室,上海 201403)
上海草莓产业发展优势明显,2015—2019年上海郊区草莓生产面积在1 533.33—2 066.67 hm2,总产值在4.71亿—6.18亿元(人民币,下同)。由炭疽菌属(Colletotrichum)真菌引起的草莓炭疽病是草莓生产上的一种重要病害,发生严重年份草莓死苗率达80%,减产达50%以上[1]。果生炭疽菌C.fructicola是华东地区草莓炭疽病的主要病原之一[2]。目前果生炭疽菌的全基因组测序已完成,这为该物种的研究起到了极大地促进作用[3]。
Rab蛋白家族是Ras(rat sarcoma)超家族的最大亚族,通过GTP结合态之间的构象变化起到分子开关的作用,只有GTP结合活性态能够与下游效应子相互作用,以促进膜运输过程中的多种功能,如囊泡形成、运输、对接和融合等[4-5]。Rab蛋白是膜运输的主要调节子,最早在酵母菌(Saccharomyces cerevisiae)中被发现[6]。在真菌中,Rab蛋白家族的数量稳定在7到12个,每个蛋白负责膜转运途径的一个特定阶段[7]。对子囊菌门和担子菌门真菌Rab蛋白进行生物信息学分析,发现这两类真菌均具有5个核心Rab蛋白,其中,3个Rab蛋白(Rab1、Rab11和Rab8)在胞吐过程中起作用,2个Rab蛋白(Rab5和Rab7)作用于胞吞作用[8]。除上述功能之外,Rab蛋白还能够在自噬及病原真菌侵染等过程中发挥作用[9-11]。目前,在灰霉菌(Botrytis cinerea)[11]、构巢曲霉(Aspergillus nidulans)[12]、稻瘟菌(Magnaporthe oryzae)[13]、玉米黑粉菌(Ustilago maydis)[14]及禾谷镰刀菌(Fusarium graminearum)[15]等丝状真菌中均有报道,如在灰霉菌(Botrytis cinerea)中,将Rab8同源基因Bcsas1敲除后,灰霉菌产孢量显著降低,且菌丝生长速率极为缓慢,对番茄果实的致病力显著下降[11]。但在果生炭疽菌中尚无Rab蛋白的相关报道。基于此,为了更好了解Rab蛋白的生物学功能及其在真菌侵染植物过程中发挥的作用,本研究利用NCBI网站(https:∕∕www.ncbi.nlm.nih.gov∕)公布的果生炭疽菌基因组数据和注释信息,从全基因组水平上鉴定果生炭疽菌中Rab蛋白成员,并采用生物信息学手段果生炭疽菌Rab蛋白进行理化性质、亲疏水性和亚细胞定位等分析,预测Rab蛋白的三级结构,以期为后续果生炭疽菌Rab蛋白的功能研究奠定基础,为阐明果生炭疽菌的致病机制和建立草莓炭疽病的防控新方法指明方向。
1 材料与方法
1.1 材料
果生炭疽菌全基因组数据来自NCBI网站(https:∕∕www.ncbi.nlm.nih.gov∕)。PDA固体培养基:马铃薯200 g,煮沸15 min,葡萄糖20 g,琼脂粉20 g,定容至1 L。PDB液体培养基:马铃薯200 g,煮沸15 min,葡萄糖20 g,定容至1 L。CMC培养基:羧甲基纤维素钠15 g,磷酸二氢钾1 g,七水合硫酸镁0.5 g,硝酸铵1 g,酵母提取物1 g,加蒸馏水到1 L。以上培养基均经高压灭菌后室温保存。
1.2 方法
1.2.1 果生炭疽菌Rab蛋白的生物信息学分析
Rab蛋白的筛选采用李源等[16]的方法,(1)利用已发表的酵母菌(S.cerevisiae)中的11个Rab蛋白的氨基酸序列在果生炭疽菌全基因组数据库中进行BLAST比对分析,E-value设为0.001。(2)利用Rab蛋白质家族数据库(http:∕∕www.rabdb.org∕)对果生炭疽菌基因组编码的Rab蛋白进行分析,E-value设为0.001。最终明确果生炭疽病菌中Rab蛋白的数量、登录号、氨基酸序列等信息。
利用Expasy网站中的ProtParam(https:∕∕web.expasy.org∕protparam∕)及Computer PI∕MW软件对Rab蛋白理化性质进行分析;利用CBS平台的SignalP-5.0 Server(http:∕∕www.cbs.dtu.dk∕services∕SignalP∕)及TMHMM Server v.2.0(http:∕∕www.cbs.dtu.dk∕services∕TMHMM∕)预测Rab蛋白N端信号肽及跨膜结构域;利用Protscale(https:∕∕www.expasy.org∕search∕Protscale)对Rab蛋白进行亲疏水性预测;利用ProtComp v9.0(www.softberry.com)对Rab蛋白进行亚细胞定位分析。
1.2.2 Rab蛋白质二级、三级结构预测
采用Phyre2(http:∕∕www.sbg.bio.ic.ac.uk∕phyre2∕html∕page.cgi?id=index)对Rab蛋白的二级及三级结构进行在线分析。
1.2.3 果生炭疽菌Rab蛋白系统发育树构建及保守结构域分析
利用ClustalX软件对果生炭疽菌Rab蛋白进行氨基酸序列多重比对,利用MEGA7.0中的邻近法进行系统发育树构建,bootstrap值设置为1 000;利用在线着色网站BoxShade(http:∕∕www.ch.embnet.org∕software∕BOX_form.html)对果生炭疽菌Rab蛋白比对的氨基酸同源序列进行序列着色。
1.2.4 丝状真菌Rab蛋白系统发育树构建
利用ClustalX软件对已报道的酵母菌(S.cerevisiae)、构巢曲霉(A.nidulans)、粗糙脉孢菌(Neurosporacrassa)、稻瘟病菌(M.oryzae)、禾谷镰刀菌(F.graminearum)及禾谷炭疽菌(C.graminicola)Rab蛋白氨基酸序列及果生炭疽菌的Rab蛋白氨基酸序列进行多重序列比对,利用MEGA7.0中的邻近法构建系统发育树,bootstrap值设置为1 000。
1.2.5 Rab在病原菌生长和侵染寄主过程中的表达量
在PDA培养基上活化果生炭疽菌菌株,28℃条件下培养5 d,挑取6—8块菌丝至液体PDB培养基中,28℃、180 r∕min,振荡培养5—7 d,过滤收集菌丝,用无菌水进行洗涤,锡箔纸包好,迅速放入液氮。用接种针挑取菌饼接种到含有100 mL CMC液体培养基的150 mL锥形瓶中,28℃、180 r∕min培养4 d。过滤,6 000 r∕min高速离心10 min,收集孢子,迅速放入液氮。
参照柯智健等[17]的方法配制孢子悬浮液,将浓度为106个∕mL的果生炭疽菌野生型菌株的分生孢子悬浮液(孢子悬浮液中加入0.05%Tween)分别倒入喷雾器中,均匀喷洒,直至草莓植株叶片上雾滴滴下为止。28℃下覆膜黑暗保湿24 h后恢复正常光照,光照和黑暗各12 h,湿度大于80%。于接菌后的48 h(叶片出现病斑)采集草莓叶片组织,将其迅速至于液氮中,速冻后置于-80℃备用。
依据Rab基因CDS区序列,利用软件Primer 5.0设计引物,引物名称及序列见表1。引物序列由生工生物工程(上海)股份有限公司合成。内参基因actin作为对照,按照SYBR Premix Ex Taq Kit试剂盒[宝生物工程(大连)有限公司]说明进行荧光定量PCR(qRT-PCR),基因表达量用相对阈值法(2ΔΔCT)计算,使用软件GraphPad Prism 5分析并作图。

表1 qRT-PCR引物信息Table 1 qRT-PCR primer informations
2 结果与分析
2.1 果生炭疽菌Rab蛋白的鉴定
通过与酿酒酵母(S.cerevisiae)中的4个Rab蛋白的氨基酸序列进行BLAST比对分析,并在Rab蛋白质家族数据库(http:∕∕www.rabdb.org∕)中进行搜索,最终共鉴定出果生炭疽菌10个Rab蛋白(表2),分别将其命名为CfRab1、CfRab2、CfRab4、CfRab5A、CfRab5B、CfRab6、CfRab7、CfRab8、CfRab11、CfRabX1(表2)。
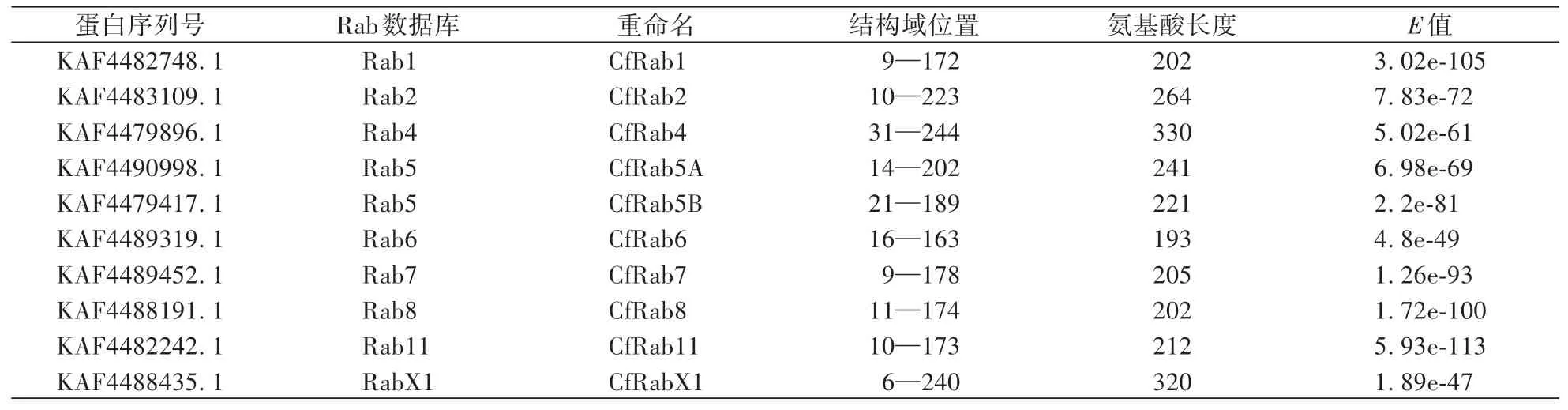
表2 果生炭疽菌Rab蛋白基本信息Table 2 The general information of C.fructicola Rab proteins
2.2 果生炭疽菌Rab蛋白理化性质、信号肽及跨膜结构域预测
利用ProtParam及Computer PI∕MW软件对果生炭疽菌Rab蛋白的理化性质进行分析,结果见表3。Rab蛋白的分子量介于21.08—35.43 ku,等电点在4.87—9.15。CfRab7、CfRab8和CfRabX1为不稳定蛋白,其余均为稳定蛋白。利用SignalP-5.0 Server对果生炭疽菌Rab蛋白的信号肽分析表明,10个Rab蛋白均不含有信号肽。选用TMHMM软件对10个Rab蛋白进行跨膜结构域的预测,10个Rab蛋白均不含有跨膜结构域(表3)。
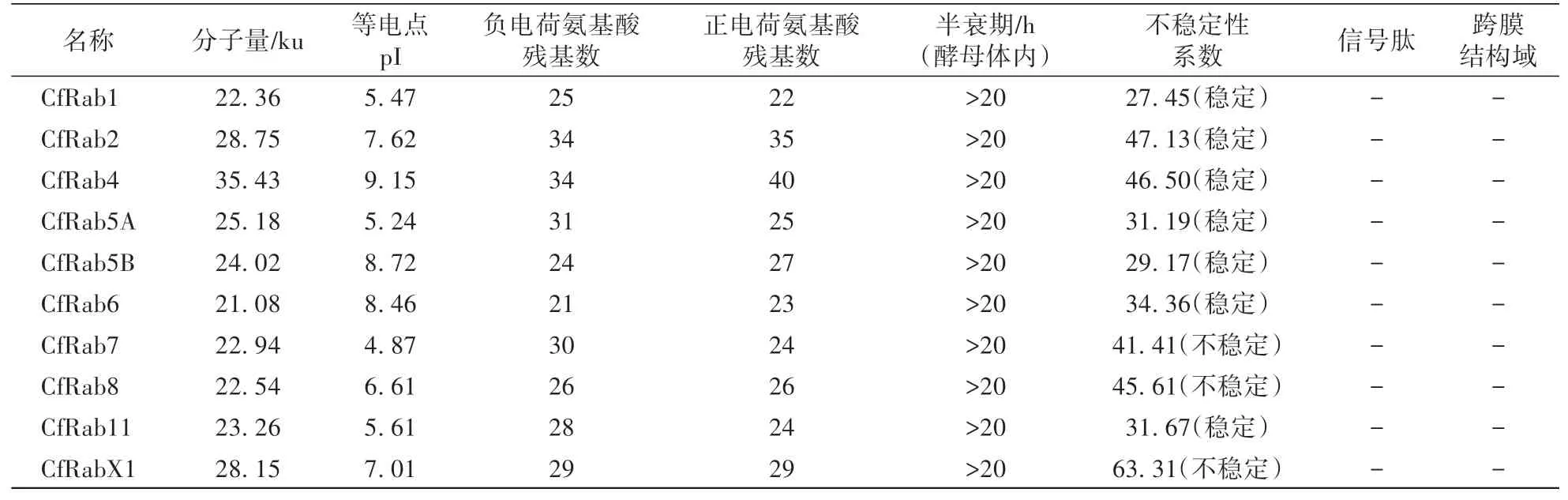
表3 果生炭疽菌Rab蛋白理化性质及信号肽分析Table 3 The basic physicochemical property and signal peptide analysis of C.fructicola Rab proteins
2.3 果生炭疽菌Rab蛋白亲疏水性预测
利用Protscale对10个Rab蛋白进行疏水性分析,结果见表4,CfRab1中位于125位的蛋氨酸(M),其亲水性最强,为-2.433,位于11位的亮氨酸(L),其亲水性最弱,为1.878;CfRab2中位于176位的天冬氨酸(D),其亲水性最强,为-2.756,而位于162位的缬氨酸(V),其亲水性最弱,为2.211;CfRab4中位于299、300位的半胱氨酸(C),其亲水性最强,为-3.511,而位于33位的异亮氨酸(I),其亲水性最弱,为1.844;CfRab5A中位于39位的谷氨酰胺(Q),其亲水性最强,为-2.844,而位于121位的异亮氨酸(I),其亲水性最弱,为2.289;CfRab5B中位于198位的脯氨酸(P),其亲水性最强,为-2.656,而位于27位的甘氨酸(G),其亲水性最弱,为1.878;CfRab6中位于130位的谷氨酸(E)和131位的丙氨酸(A),其亲水性最强,为-2.656,而位于106和107位的异亮氨酸(I),108位的缬氨酸(V)其亲水性最弱,为2.000;CfRab7中位于113位的精氨酸(R)亲水性最强,为-2.300,而位于11位的缬氨酸(V),其亲水性最弱,为2.722;CfRab8中位于181位的天冬酰胺(N),其亲水性最强,为-3.022,而位于13位的亮氨酸(L),其亲水性最弱,为2.522;CfRab11中位于68位的谷氨酰胺(Q)亲水性最强,为-2.233,而位于12位的缬氨酸(V),其亲水性最弱,为2.422;CfRabX1中位于243位的赖氨酸(K)亲水性最强,为-2.437,而位于87位的半胱氨酸(C),其亲水性最弱,为1.867。

表4 果生炭疽菌Rab亲水性及疏水性氨基酸残基位置Table 4 The hydrophobic and hydrophilic amino acid residue position of Rab in C.fructicola
2.4 果生炭疽菌Rab蛋白亚细胞定位分析
利用ProtComp 9.0在线分析果生炭疽菌Rab蛋白的亚细胞定位,结果表明:CfRab1和CfRab7蛋白位于质膜的得分较高,CfRab4蛋白位于线粒体的得分较高。CfRab2、CfRab5A、CfRab5B、CfRab6、CfRab8、CfRab11和CfRabX1这7个Rab蛋白位于高尔基体的得分较高(表5)。但Rab蛋白具体定位情况,还有待后续通过试验进行验证。
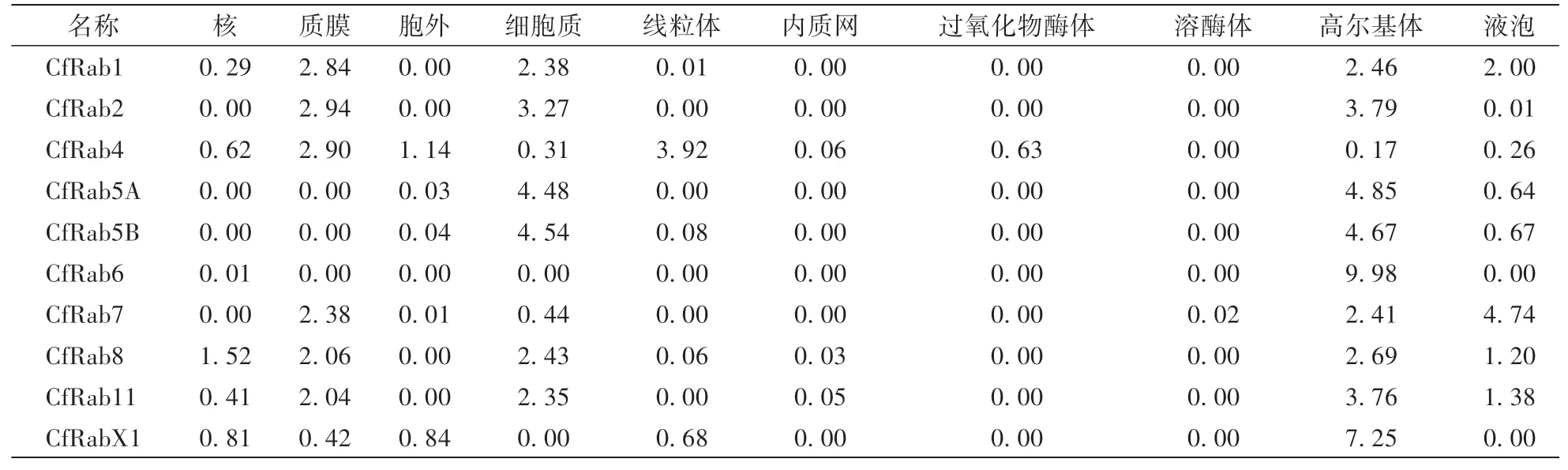
表5 果生炭疽菌Rab蛋白亚细胞定位得分Table 5 Points of subcellular localization prediction of C.fructicola Rab proteins
2.5 果生炭疽菌Rab蛋白二级结构分析
10个Rab蛋白均含有α螺旋结构和β转角结构,10个Rab蛋白所含α螺旋结构均高于β转角(图1)。对三级结构进行预测并进行模拟发现,Rab1及Rab8的蛋白结构与模型d2bcgy1具有很高的相似性,序列覆盖率均为93%,置信度(Confidence)均为100%。Rab2、Rab3、Rab4、Rab5、Rab6和Rab10的蛋白结构与模型c5c2kA蛋白具有很高的相似性,序列覆盖率分别为70%、58%、81%、79%、88%和61%,置信度(Confidence)均为100%。Rab7、Rab9和Rab11的蛋白结构与模型c6jmgA具有很高的相似性,序列覆盖率分别为93%、86%和93%,置信度(Confidence)均为100%(图2)。
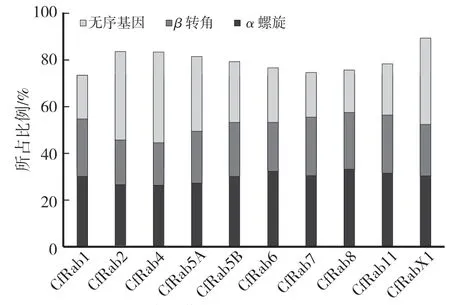
图1 果生炭疽菌Rab蛋白二级结构特征Fig.1 The secondary structure character of C.fructicola Rab proteins
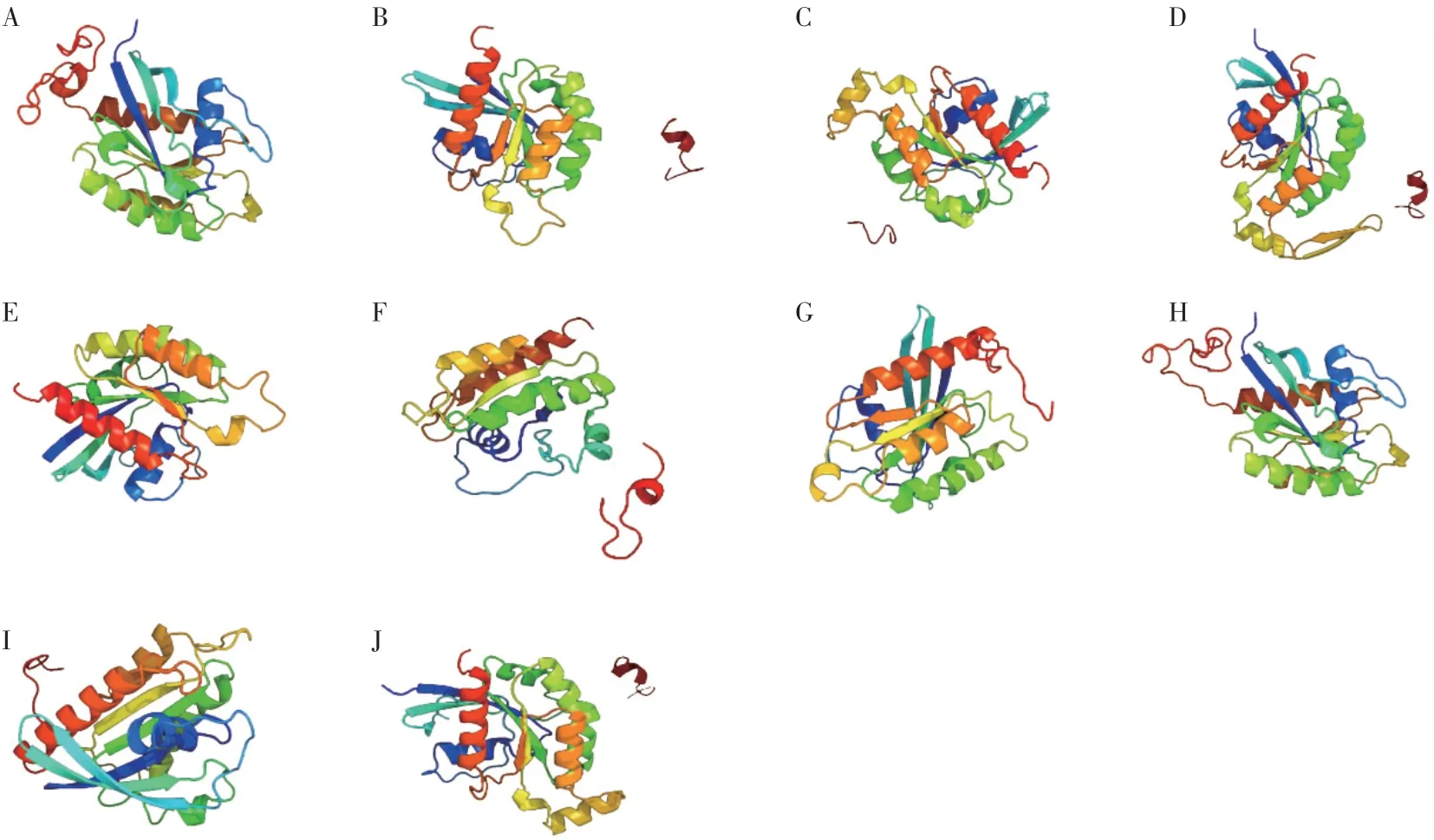
图2 果生炭疽菌Rab蛋白三级结构预测Fig.2 Prediction of C.frucicola Rab protein tertiary structure
2.6 果生炭疽菌Rab蛋白家族的遗传进化关系及保守结构域分析
为了明确果生炭疽菌中Rab蛋白家族的进化关系,对10个Rab蛋白构建系统进化树(图3),发现不同Rab蛋白之间亲缘关系差异较大,其中两两之间亲缘关系最近的为CfRab1和CfRab8,以及CfRab5A和CfRab5B。CfRabX1与其他Rab蛋白的亲缘关系则较远。
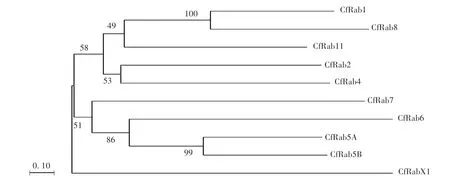
图3 果生炭疽菌中Rab蛋白的进化关系Fig.3 Evolution relationship analysis of C.fructicola Rab proteins
对其氨基酸进行多重序列比对以分析果生炭疽菌Rab蛋白的保守结构域,结果表明,果生炭疽菌中的Rab蛋白均含有GTP结合∕GDP水解结构域,该结构域具有5个有特点的且高度保守基序:G1(GxxxxG K[S∕T],x为任意氨基酸)、G2(分子开关Switch I;x[T∕S]x)、G3(分子开关Switch II;DxxG)、G4([N∕T]KxD)和G5(S∕CAK∕L∕T)。C末端均具有膜定位信号(xxCCx∕xxCxC)。此外,与CfRab5B相比,CfRab5A在G4和G5基序之间有18个氨基酸的插入(图4)。
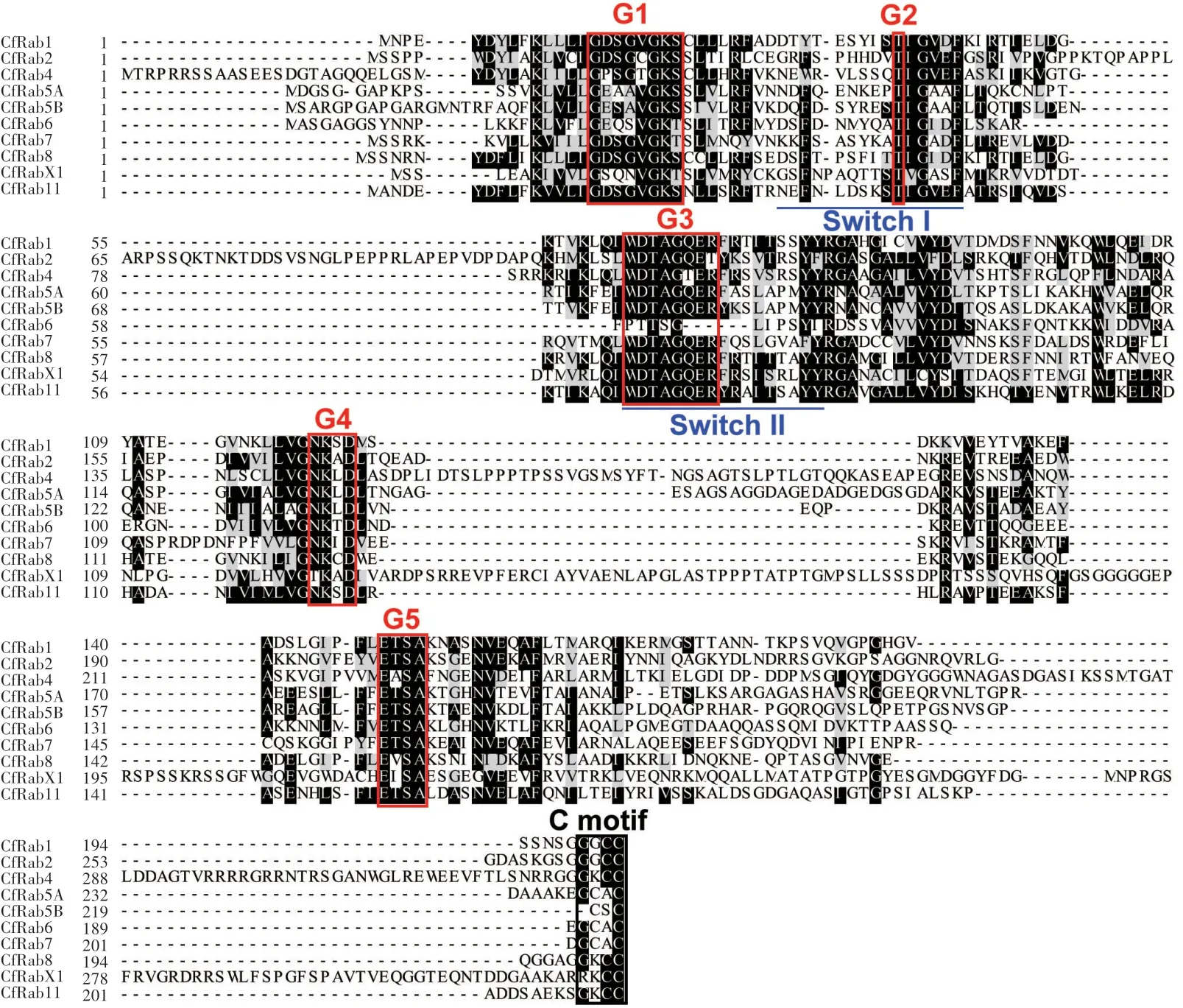
图4 果生炭疽菌中Rab蛋白的保守结构域分析Fig.4 Analysis of the conserved domains of C.fructicola Rab proteins
2.7 果生炭疽菌Rab蛋白在丝状真菌中的遗传进化关系
为了分析禾谷炭疽菌所属丝状真菌各成员Rab蛋白的系统进化关系,对丝状真菌中同源的Rab蛋白比对后构建系统进化树,图5显示:7种真菌(S.cerevisiae、A.nidulans、N.crassa、M.oryzae、U.maydis、C.graminicola及C.fructicola)中同一类的Rab蛋白被分到同一分支,表明丝状真菌各成员间Rab蛋白在进化过程中非常保守,且该分类结果一定程度上与其功能发挥相关。CfRab1与其他真菌Rab1同源,处于同一分支,包括酿酒酵母Ypt1,已被证实参与了细胞内囊泡形成、运输和释放等多个重要的过程;CfRab5A和CfRab5B处于同一分支的两个小分支,两者之间有一定差异,与酿酒酵母的Ypt52、Ypt53和Vps21同源,定位于早期内体,在胞吞和囊泡融合等方面发挥关键作用;CfRab7与酿酒酵母的Ypt7同源,主要定位于晚期内体,参与囊泡运输等功能;CfRab6与酿酒酵母的Ypt6同源,在细胞外吐和细胞自噬过程中发挥功能;值得注意的是,CfRab2、CfRab4和CfRab11相互之间亲缘关系较近,处于同一分支的三个小分支,其中CfRab11与酿酒酵母的Ypt31、Ypt32同源,参与囊泡运输和细胞自噬的发生。C.fructicola、C.graminicola和A.nidulans含有10个Rab蛋白,其他4种真菌中均含有11个Rab蛋白。虽然果生炭疽菌与禾谷炭疽菌均属于炭疽菌属,但是果生炭疽菌中的CfRab5B与MoRab5B、CfRab7与MoYpt7的亲缘关系最近。

图5 果生炭疽菌Rab蛋白在丝状真菌中的系统发育关系分析Fig.5 Phylogenetic relationship of C.fructicola Rab proteins in filamentous fungi
2.8 Rab在病原菌生长和侵染寄主过程中的表达分析
qRT-PCR结果表明,Rab基因在果生炭疽菌生长发育和侵染阶段均有表达(图6)。相对于菌丝阶段表达量,在孢子和侵染阶段均有不同程度提高,其中CfRab5A和CfRabX1在孢子发育阶段表达最高,CfRab1、CfRab2、CfRab4、CfRab5B、CfRab6、CfRab7和CfRab8在果生炭疽菌侵染后48 h表达最高。
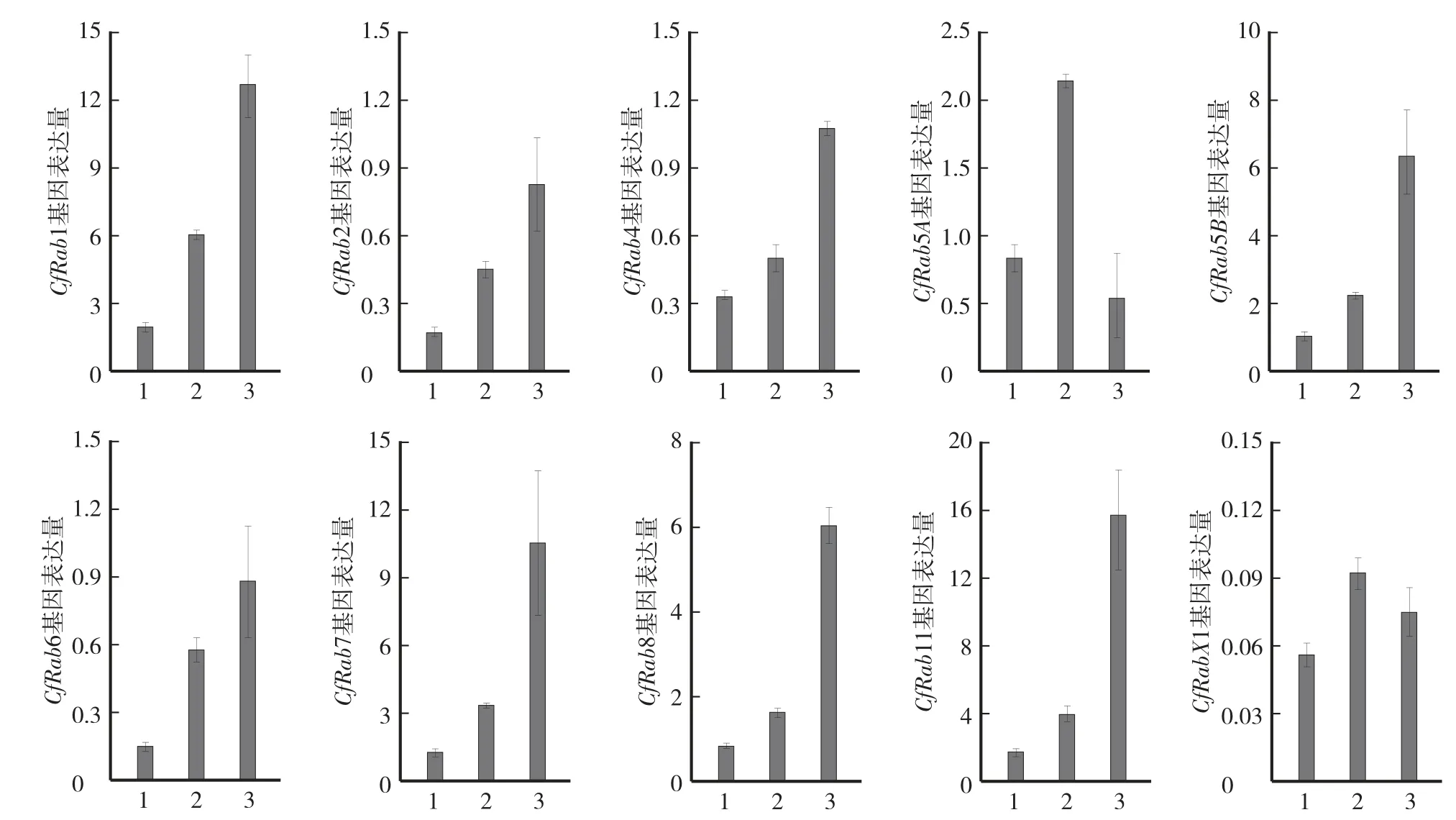
图6 果生炭疽菌Rab蛋白编码基因表达量分析Fig.6 Expression of C.fructicola Rab protein coding genes
3 讨论
植物和病原物互作过程中存在多种机制,在植物寄主和病原物之间建立了能够直接影响病原物毒力和致病性的“分子对话”[18]。病原物通常会分泌一系列的毒力因子进入体内细胞外环境,促进其侵染寄主植物,吸收必需营养素[19]。细胞外分泌依赖于囊泡转运,Rab蛋白则是该过程重要的调节子[20]。已经证明Rab蛋白影响囊泡运输过程中的关键阶段。随着全基因组测序技术的发展,越来越多丝状真菌的全基因组数据得到释放。目前,丝状真菌中大量的Rab蛋白已经得到筛选和鉴定[21]。然而果生炭疽菌中尚无Rab蛋白相关的报道。
本研究利用生物信息学对果生炭疽菌中的Rab蛋白进行了鉴定及分析,最终确定了10个候选的Rab蛋白,这些Rab蛋白均为小分子量的亲水蛋白,不含信号肽和跨膜结构域,其中CfRab2的亲水性最高,CfRab11的亲水性最小。Rab亲水性分析结果有助于了解其蛋白性质,例如是否是可溶蛋白、分泌蛋白或膜蛋白,进一步探索影响Rab亲水性及疏水性的关键氨基酸残基,以及其对真菌致病性的影响。除此之外,7个Rab蛋白预测为稳定蛋白(CfRab1、CfRab2、CfRab5A、CfRab5B、CfRab6、CgRab11),且多数Rab蛋白定位于高尔基体(CfRab2、CfRab5A、CfRab5B、CfRab6、CfRab8、CfRab11和CfRabX1)。二级结构分析表明10个Rab蛋白所含α螺旋结构均高于β转角。通过Phyre2在线分析,搜索到与10个Rab蛋白结构相似的模型。果生炭疽菌中Rab蛋白家族的进化关系表明,CfRab1和CfRab8、CfRab5A和CfRab5B亲缘关系最近。与之相反,CfRabX1与其他Rab蛋白的亲缘关系则较远,说明CfRabX1在进化过程中可能发挥了不同于其他Rab蛋白的功能,具有特异性,并且与其同源的酵母Rab蛋白ScYpt11功能也尚未阐明。果生炭疽菌Rab蛋白在结构上非常保守,均含有5个基序(G1-G5),C末端均具有膜定位信号,推测果生炭疽菌Rab与其他真菌中Rab蛋白功能类似。此外,果生炭疽菌中含有Rab5的两个同源蛋白CfRab5A和CfRab5B,与CfRab5B相比,CfRab5A在G4和G5基序之间有18个氨基酸的插入。有研究表明,真菌中Rab5的同源蛋白,不是简单的冗余蛋白亚型,而是具有不同的功能[22]。稻瘟菌中的MoRab5A基因缺失后,其功能不能通过将MoRab5B基因过表达来实现,反之亦然[23]。将丝状真菌中同源的Rab蛋白与果生炭疽菌进行氨基酸比对后构建系统发育树,发现Rab蛋白在丝状真菌进化过程中比较保守,在细胞内囊泡形成、运输、融合和释放过程中发挥类似的作用。虽然同属于炭疽菌属,但是与禾谷炭疽菌相比,果生炭疽菌中的CfRab5B与MoRab5B、CfRab7与MoYpt7的亲缘关系更近。为了进一步研究果生炭疽菌Rab蛋白的功能,在对其进行生物信息学分析研究的基础上,对Rab蛋白编码基因在果生炭疽菌生长阶段(菌丝和孢子)及侵染过程中(侵染后48 h)中的表达变化进行了分析。相对于菌丝阶段表达量,其中CfRab5A和CfRabX1在孢子发育阶段表达最高,由此推断CfRab5A和CfRabX1可能在发育过程中发挥作用。CfRab1、CfRab2、CfRab4、CfRab5B、CfRab6、CfRab7和CfRab8在果生炭疽菌侵染后48 h表达最高,说明这7个蛋白编码基因在果生炭疽菌侵染过程中发挥重要作用。
尽管编码Rab蛋白基因的功能是保守的,但在不同的生物体中其仍具有一定的差异。SEC4是在酵母中发现的第一个Rab蛋白,并被证明在真菌生长和蛋白质分泌中起着重要作用[24]。SEC4在黑曲霉(A.niger)中的同源基因srgA缺失后发现并未影响该菌的生长[25],而其在豆刺盘孢菌(C.lindemuthianum)中的同源基因CLPT1缺失后,会导致该菌死亡[26]。灰霉菌(B.cinerea)中SEC4的同源基因Bcsas1则在真菌生长、蛋白质分泌和致病力方面均起着至关重要的作用[11]。轮状镰刀菌(F.verticillioides)中FvSec4在菌丝的发育、毒力、毒素的产生和胁迫反应中均发挥着至关重要的作用[26]。本研究下一步将对Rab蛋白在侵染中的表达量和功能进行深入分析,以更好了解Rab蛋白的生物学功能及其在真菌侵染植物过程中发挥的作用。

