裂殖壶菌pks基因启动子的克隆及活性检测
王振东,臧晓南,丛晓梅,朱清
(中国海洋大学 海洋生物遗传育种教育部重点实验室,山东 青岛 266003)
引 言
二十二碳六烯酸(Docosahexaenoic acid,DHA)是一种具有抗炎、保护心脑血管、促进视觉细胞和神经系统发育等重要生理功能的n-3多不饱和脂肪酸。裂殖壶菌是一种单细胞球形真菌,被认为是一种新兴的理想的二十二碳六烯酸(docosahexaenoic acid,DHA)来源。裂殖壶菌能够在脂滴内积累大量的多不饱和脂肪酸(PUFAs),主要是n-3 PUFAs。裂殖壶菌总脂肪酸含量超过其细胞干重的50%,尤其是DHA,含量占总脂的30%~40%[1]。这意味着和DHA合成相关的基因的启动子能高效地启动基因的转录和表达,而裂殖壶菌DHA合成途径中的关键酶基因主要包含在三个基因簇pks1、pks2和pks3中,所以本实验尝试扩增得到pks1及pks3基因的启动子序列,为裂殖壶菌的基因工程操作提供有效的启动子元件。
启动子是一段脱氧核糖核酸序列,一般位于结构基因的5′端上游,可以活化RNA聚合酶,使之与启动子特异性识别并结合,从而起始转录,调控下游基因的表达[2]。启动子自身并不具有基因调控功能,需要和多种转录因子及RNA聚合酶结合后形成转录起始复合体,然后才可以调控基因的表达[3]。启动子是基因的重要组成成分,是基因表达调控过程中的顺式作用元件,影响基因的表达水平,同时启动子也在基因工程载体的研究中发挥着重要的作用。一般按表达方式将启动子分为:组成型启动子、组织特异性表达型启动子和诱导型启动子三类[4]。但这种分类也不是绝对的,某些启动子可能会兼具两种类型的特点[5]。
已经有许多启动子成功应用到了裂殖壶菌的转化体系中。Cheng等人利用18S rDNA作为同源重组位点,将TEF1启动子和ble基因导入裂殖壶菌,使裂殖壶菌具有了Zeocin抗性,说明TEF1启动子成功启动了ble基因的表达,同时也是构建了一种用于裂殖壶菌遗传转化筛选的系统[6]。Kobayashi等人通过由破囊壶菌泛素启动子驱动的脂肪酸Δ5去饱和酶基因的表达来改变破囊壶菌的脂肪酸组成,该基因在裂殖壶菌中进行了功能表达,从而增加了通过Δ5去饱和酶从二十碳四烯酸(ETA)转化成二十碳五烯酸(EPA)的量[7]。Suen等人利用裂殖壶菌微管蛋白启动子启动透明颤菌血红蛋白基因(VHb)在裂殖壶菌中表达,所得重组菌株的总脂肪酸含量比野生型高了44%,虾青素含量提高了9倍[8]。Sun等人将酵母启动子PGKpromoter和绿色荧光蛋白基因(egfp)导入裂殖壶菌基因组中,结果表明PGKpromoter使绿色荧光蛋白成功表达[9]。
目前在裂殖壶菌的基因工程操作中,多采用外源启动子,外源启动子由于物种间的差异,会出现启动活性弱或者没有启动活性等问题,显然无法满足日益发展的裂殖壶菌基因工程操作的需求,因此研究者对裂殖壶菌内源启动子的需求日益强烈。故本实验克隆得到pks基因的5′端序列并检测其活性,以期为裂殖壶菌的基因工程操作提供可能的启动子元件。
1 实验菌株与载体

表1 实验菌株、载体及来源
2 实验方法
2.1 裂殖壶菌基因组DNA的提取及5′侧翼序列的扩增
采用Takara公司提供的酵母基因组DNA提取试剂盒Yeast DNAiso Kit提取裂殖壶菌OUC168的基因组DNA。通过染色体步移法扩增得5′侧翼序列,采用Takara公司的Genome Walking Kit试剂盒进行扩增。
2.2 pks1基因和pks3基因5′侧翼序列的分析
通过PlantCARE[10]及Meth Primer[11]等启动子分析软件对得到的5′侧翼序列进行生物信息学分析。得到结果后,我们将pks1基因的启动子序列用pks1promoter表示,将pks3基因的启动子序列用pks3promoter表示。
2.3 原核表达载体的构建
首先构建克隆载体pEASY-Blunt-T1-pks1promoter、pEASY-Blunt-T1-pks3promoter,然后使用限制性内切酶BamHI和HindIII双酶切克隆载体及载体pAcGFP1-1,最后用T4连接酶分别将pks1promoter和pks3promoter与pAcGFP1-1载体相连接,得到重组表达载体pAcGFP1-1-pks1promoter和pAcGFP1-1-pks3promoter。质粒图谱如图1所示。
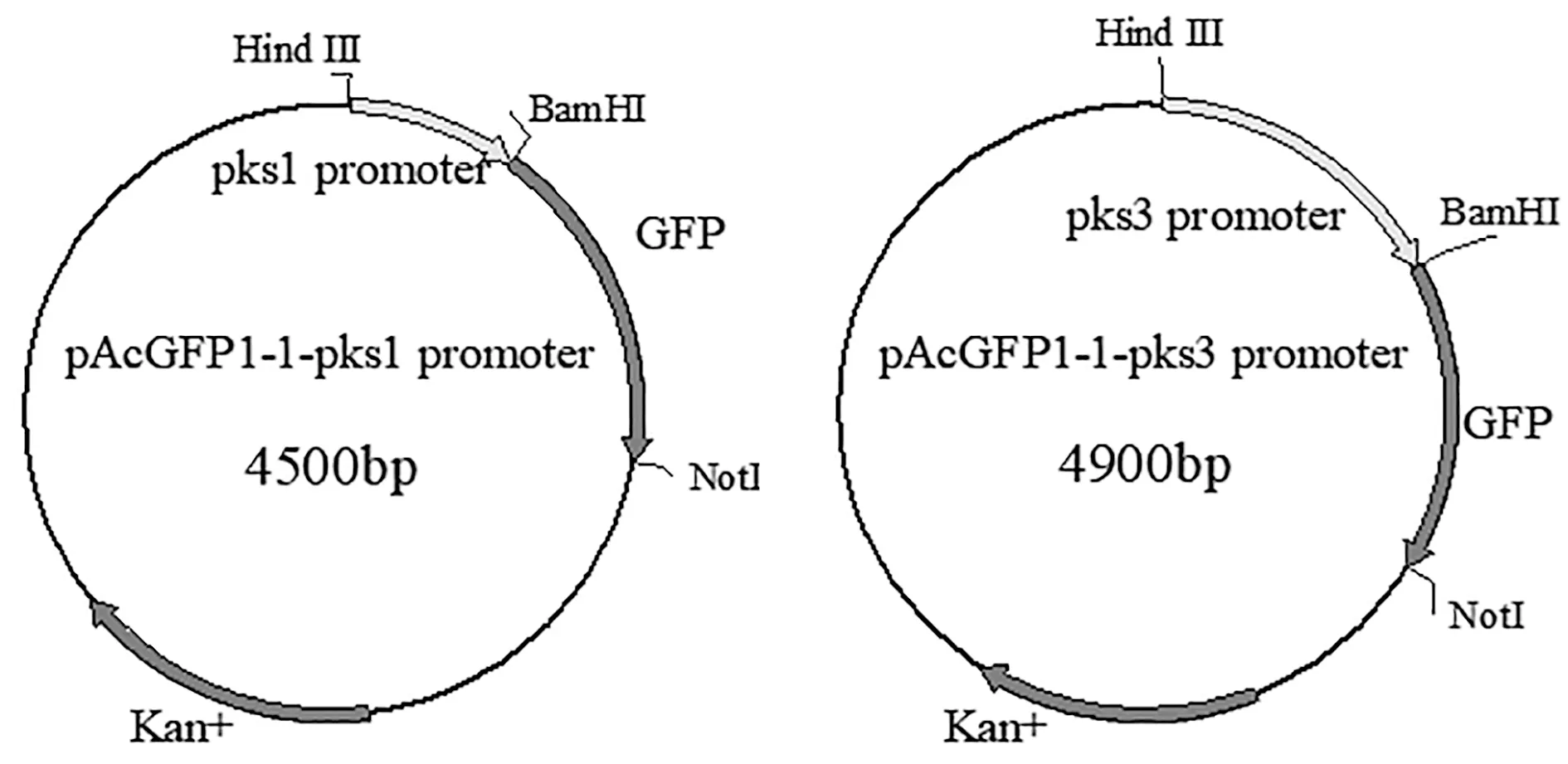
图1 原核表达载体图谱
2.4 真核表达载体的构建
首先使用两组限制性内切酶NotI和HindIII对PYD1载体及原核表达载体pAcGFP1-1-pks1promoter和pAcGFP1-1-pks3promoter进行双酶切,得到pYD1线性载体及片段pks1promoter-GFP和pks3promoter-GFP,然后构建真核表达载体pYD1-pks1promoter-GFP和pYD1-pks3promoter-GFP。质粒图谱如图2所示。

图2 真核表达载体图谱
2.5 重组表达菌株的构建
将提取的原核表达载体及空载体转化大肠杆菌BL21感受态细胞,得到大肠杆菌重组菌株;将构建好的真核表达载体通过酵母转化试剂盒Frozen-EZ Yeast Transformation IITM转化到酵母菌EBY100中,得到酵母菌重组菌株。
2.6 重组菌株的启动子活性检测
根据刘畅[12]的方法,对大肠杆菌及酵母菌重组菌株进行荧光检测及SDS-PAGE蛋白检测,以分析这两段启动子序列在原核表达系统及真核表达系统中的活性。
3 结果分析
3.1 pks基因5′侧翼序列分析
将所得pks1基因和pks3基因的5′侧翼序列用PlantCARE软件进行启动子分析,结果表明(图3),pks1基因和pks3基因的5′侧翼序列均含有CAAT-box和TATA-box顺式作用元件,pks1基因的5′侧翼序列含有MBS区,pks3基因的5′侧翼序列含有Sp1转录因子结合位点。

图3 pks基因5′侧翼序列的序列分析
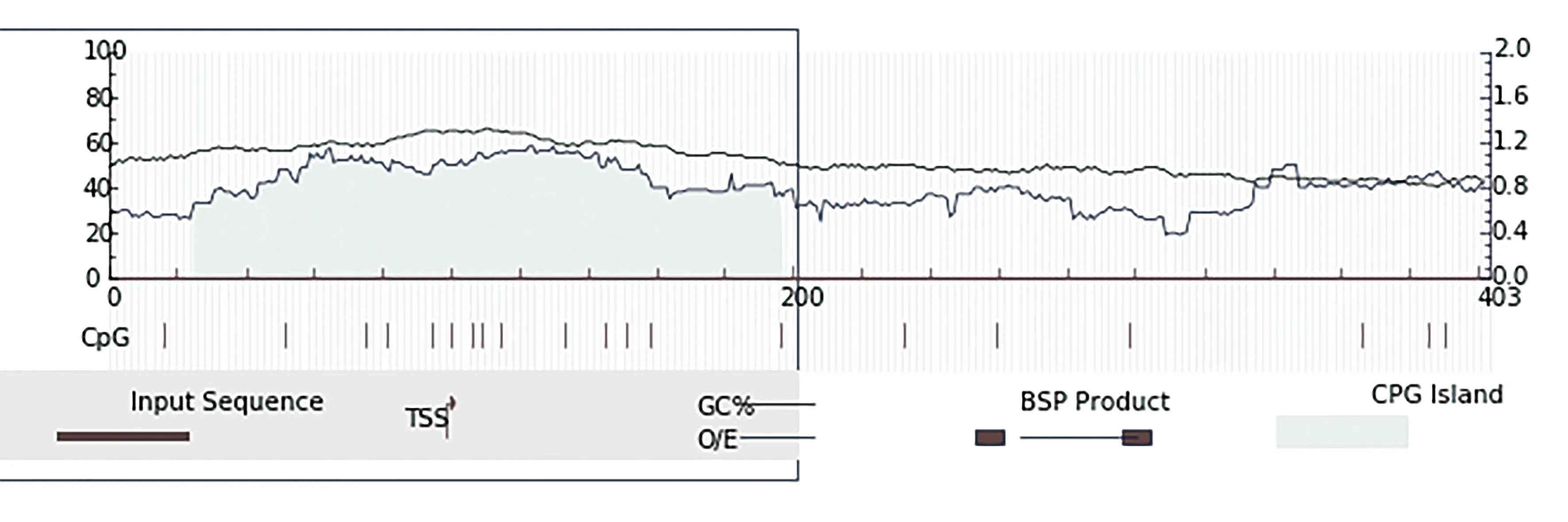
Meth Primer的预测结果如图4所示,在pks1基因5′侧翼序列的49~198 bp之间有一段长为149 bp的CpG区域;在pks3基因5′侧翼序列的317~460 bp之间有一段长为143 bp的CpG区域。经初步分析认为这两段序列具有启动子特征,含有上游调控元件,可能为裂殖壶菌pks1基因和pks3基因的启动子。
(a)
3.2 重组菌株荧光检测分析
对大肠杆菌重组菌株进行荧光光谱检测,结果如图5(a)所示。可以看出,在475 nm波长光的激发下,重组菌株均在505 nm处呈现出荧光峰。与对照组相比,重组菌株中绿色荧光蛋白的特征峰均高于对照组,并且pks3promoter启动的绿色荧光蛋白峰值高于pks1promoter,说明绿色荧光蛋白在原核及真核表达系统中均成功表达,pks1基因和pks3基因的启动子均具有一定的启动活性,且pks3promoter的活性略高于pks1promoter。
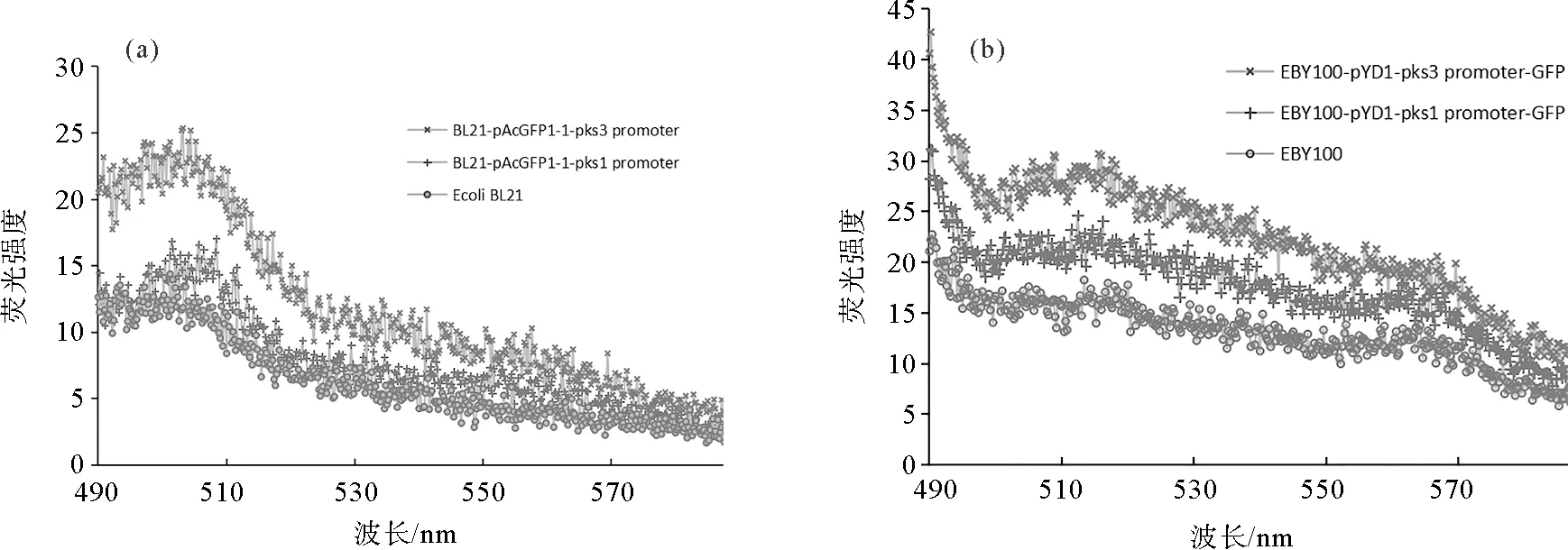
图5 重组菌株荧光检测结果
3.3 重组菌株SDS-PAGE蛋白检测分析
构建得到的大肠杆菌重组菌株经SDS-PAGE检测,结果如图6(a)所示。泳道3为对照菌株BL21,泳道1、2为重组菌株BL21-pAcGFP1-1-pks1promoter,在25~30 kDa之间出现一条略微加深的条带,泳道4为重组菌株BL21-pAcGFP1-1-pks3promoter,在25~30 kDa之间也出现一条略微加深的条带与绿色荧光蛋白(26.7 kDa)大小相符。
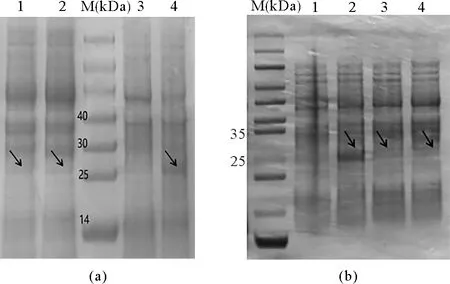
图6 重组菌株的SDS-PAGE检测
构建得到的酵母菌重组菌株经SDS-PAGE检测,结果如图6(b)所示。泳道1为对照菌株EBY100,泳道2为重组菌株EBY100-pYD1-pks1promoter-GFP,在25~30 kDa之间出现一条加深的条带,泳道3、4为重组菌株EBY100-pYD1-pks3promoter-GFP,在25~30 kDa之间也出现一条略微加深的条带,与绿色荧光蛋白(26.7 kDa)大小相符。说明绿色荧光蛋白在原核及真核表达系统中均成功表达,这两段启动子序列是具有启动活性的。
4 讨论
本实验通过染色体步移技术,得到pks1基因和pks3基因的5′侧翼序列,通过PlantCARE及Meth Primer等启动子分析软件进行生物信息学分析,得到pks1promoter和pks3promoter两段启动子序列。pks1基因和pks3基因的5′侧翼序列均含有CAAT-box和TATA-box顺式作用元件,pks1基因的5′侧翼序列含有MBS区,pks3基因的5′侧翼序列含有Sp1转录因子结合位点。pks1基因5′侧翼序列的49~198 bp之间有一段长为149 bp的CpG区域;在pks3基因5′侧翼序列的317~460 bp之间有一段长为143 bp的CpG区域。初步分析认为这两段序列具有启动子活性。然后通过构建原核表达系统及真核表达系统研究这两段启动子序列的活性,以绿色荧光蛋白作为指示剂,对重组菌株进行荧光检测分析,发现其绿色荧光蛋白的特征峰均高于对照组,并且pks3promoter启动的绿色荧光蛋白峰值高于pks1promoter,SDS-PAGE检测也表明,重组菌株均出现一条与绿色荧光蛋白(26.7 kDa)大小相符的条带。可以看出,这两段启动子序列pks1promoter及pks3promoter在原核表达系统及真核表达系统中均具有一定的启动活性。
但是从结果来看,本实验中无论是大肠杆菌重组菌株还是酵母菌重组菌株,其颜色并没有呈现出明显的绿色,绿色荧光蛋白的荧光强度也较低,说明绿色荧光蛋白表达量不高,这两段启动子序列活性不强。李丁等人将烟草叶绿体16SrRNA基因的启动子Prrn与绿色荧光蛋白相连,检测Prrn启动子在大肠杆菌中的活性,结果发现单纯的Prrn启动子无法启动绿色荧光蛋白基因在大肠杆菌中的表达,而在启动子和基因之间引入一段转录调控序列之后,基因得到了有效的表达[13]。分析大肠杆菌重组菌株中两段启动子活性均不高的原因,可能是因为真核启动子在原核中表达添加需要适当的转录调控序列。
然而这两段启动子序列在酵母中的表达活性与在大肠杆菌中相似,重组菌株的荧光检测结果均较弱,说明这两段启动子活性确实不高,推测有可能是因为本实验所扩得的启动子序列不完整,缺少必要的顺式作用元件。一些基因工程中常用的真核启动子,比如磷酸甘油酸激酶基因(PGK)启动子,其序列长度就达到了1498 bp,其启动活性很强[14]。本实验中得到的两段启动子序列长度都较短,pks1promoter为403 bp,pks3promoter为796 bp,所包含的顺式作用元件也较少。因此猜测我们实验获得的两段启动子由于没有完整克隆出其顺式作用元件,从而启动活性较弱。另外,在野生型裂殖壶菌中,pks1和pks3基因启动子的启动活性较强,并且其起始基因的表达是不需要诱导条件的,可能属于组成型启动子,然本实验所得结果显示启动子活性较低,是否这两段启动子序列在酵母展示系统中的表达受到物种限制,或者裂殖壶菌中存在不为我们所知的元件在调控启动子的活性?需要我们继续深入研究。
本文通过绿色荧光蛋白研究了pks基因启动子的活性,为裂殖壶菌的基因工程操作提供了可能的启动子元件,同时也为改造裂殖壶菌获得高产DHA的菌株奠定了实验基础。

