新辅助治疗用于可切除胰腺癌患者的安全性与有效性研究
王成方,王之江,王伟林,2,3,4
1浙江大学医学院附属第二医院 肝胆胰外科,浙江杭州 310009;2 浙江省肝胆胰肿瘤精准诊治研究重点实验室,浙江杭州 310009;3 浙江省肝癌诊治技术研究中心,浙江杭州 310009;4 浙江大学肝胆胰疾病精准诊治临床创新中心,浙江杭州 310009
胰腺癌是一种高度恶性的致死性肿瘤,发病率较高且预后极差。中国国家癌症中心2017 年统计数据显示,胰腺癌在我国男性恶性肿瘤发病率中排名第7 位,在女性中排名第11 位,恶性肿瘤相关死亡率中排名第6 位[1]。局部胰腺癌的根治性切除术仍是唯一可治愈胰腺癌的手段,但胰腺癌患者手术切除率不足20%[2],且即使接受根治性手术的患者,5 年生存率也不到40%[3],甚至低至20%[4]。80%患者术后发生局部复发或远处转移,且大部分发生在术后2 年内,甚至24%~ 51%患者发生在术后1 年[1,5-7]。美国NCCN 和我国2021版胰腺癌指南中建议对合并包括CA19-9 显著增高、瘤体较大、区域淋巴结肿大疑似转移、体质量显著降低和伴有明显疼痛等高危因素病理诊断明确的可切除胰腺癌患者开展术前新辅助治疗[8-9]。但有研究表明,约20%的可切除胰腺癌患者因新辅助治疗失败而出现疾病进展,或因化疗的不良反应和体能下降错失手术机会;术前穿刺明确病理学诊断和置管减黄等均为有创性操作,具有出血、胆管炎、胰瘘和肿瘤播散等潜在风险[10]。因而对可切除胰腺癌患者常规开展新辅助治疗目前仍存在较大争议。本研究拟对浙江大学医学院附属第二医院收治的可切除胰腺癌患者新辅助治疗的安全性和有效性做出初步评估,为临床开展新辅助治疗提供参考。
资料与方法
1 资料 收集2015 年3 月-2021 年7 月于浙江大学医学院附属第二医院肝胆胰外科行胰腺癌根治性切除手术患者共60 例。其中经评估选取出20 例术前行新辅助治疗的可切除胰腺癌患者纳入本研究新辅助治疗组中,再按照倾向性评分匹配1∶2 的比例,并遵照除“行术前新辅助治疗”以外的纳入标准(见下文),选取同时期直接行根治性手术切除的可切除胰腺癌患者共计40 例纳入本研究直接手术组中。倾向性匹配指标为年龄、性别、初始影像肿瘤直径、肿瘤位置。新辅助治疗组年龄(59.60±7.61) 岁,男性11 例,女性9 例,胰头癌9 例;直接手术组年龄(61.54±7.70) 岁,男性22 例,女性18 例,胰头癌18 例。两组一般资料无统计学差异(P均>0.05),见表1。本研究通过浙江大学医学院附属第二医院伦理委员会审批,批件号(2021)伦审研第(0677)号。所有患者均签署知情同意书。
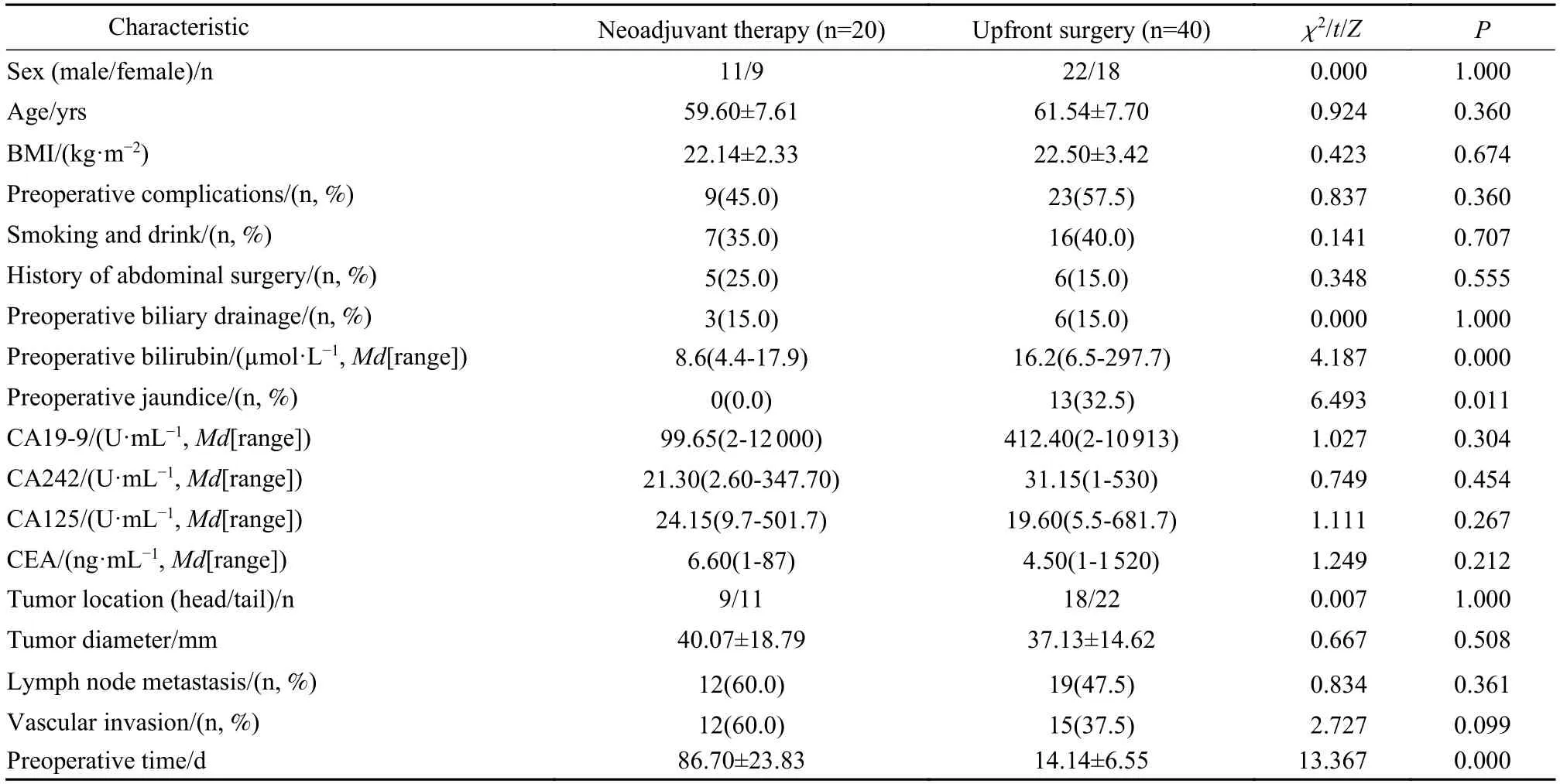
表1 两组胰腺癌患者基线资料比较Tab.1 Comparison of baseline data between the two groups
纳入标准:1) 行胰腺癌根治性手术切除;2)术后病理明确诊断为胰腺导管腺癌;3)术前初始评估为可切除胰腺癌;4) 行术前新辅助治疗。排除标准:1)术中行合并远处转移灶切除的根治性切除术患者;2)新辅助治疗患者未取得术前病理证据;3)临床资料不完整。
2 治疗方法 1)新辅助治疗组:患者均为初始影像学评估为可切除胰腺癌,经多学科综合诊疗团队讨论拟先行新辅助治疗,取得术前穿刺病理明确诊断为胰腺癌,新辅助治疗患者中10 例采用mFOLFIRINOX 方案,9 例采用吉西他滨+白蛋白紫杉醇(AG) 方案,1 例采用吉西他滨单药方案,其中6 例中途更换治疗方案,均为mFOLFIRINOX与AG 方案互换;其中3 例联合行术前辅助放疗。术前进行4(3~ 8)周期[Md(range)] 新辅助化疗。新辅助治疗经评估可行手术后给予患者根治性手术切除治疗。2)直接手术组:初始影像学评估为可切除胰腺癌,未行术前新辅助治疗,经评估后直接行根治性手术切除治疗。两组所有患者均常规推荐行术后辅助治疗。
3 观察指标 1)患者一般资料:性别、年龄、体质量指数(body mass index,BMI)、既往基础疾病史(高血压、糖尿病、心脑血管疾病)、既往腹部手术史等。2)患者围术期资料:术前影像资料,如肿瘤位置、肿瘤直径(若术前不同影像检查测量肿瘤直径不同,选择与术后病理检查更接近的数据)、术前CA19-9 等肿瘤标志物、术前黄疸情况、诊断至手术时间、是否行术前减黄、术前影像学评估新辅助治疗效果[RECIST1.1 标准,评价为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)] 等[11];术中情况,如具体术式、手术时间、术中失血量等;术后资料,如术后住院时间、术后胆瘘、胰瘘等各种并发症,术后非预期二次手术、术后90 d 内死亡等。3) 术后病理:肿瘤直径、切缘情况、淋巴结转移情况、新辅助治疗病理学疗效评估(改良Ryan 方案,评价为0~ 3 分) 等。4)术后辅助治疗情况:术后复发情况和无病生存期(disease-free survival,DFS),随访时间截止至2022 年3 月19 日。
4 相关定义和标准 可切除胰腺癌标准:参照《中国胰腺癌诊治指南(2021)》,肿瘤未触及腹腔干、肠系膜上动脉或肝总动脉,肿瘤未触及肠系膜上静脉或门静脉,或有触及但未超过180°,且静脉轮廓规则[9]。肿瘤的TNM 分期参照美国癌症联合委员会肿瘤临床分期第8 版[12]。对术后腹腔感染、胆瘘、胰瘘、胃排空延迟、术后出血的定义:参照《胰腺术后外科常见并发症诊治及预防的专家共识(2017)》[13]。
5 统计学方法 应用SPSS26.0 统计软件进行分析。正态分布计量资料以表示,两组比较采用t检验;非正态分布的计量资料以Md(range)表示,两组比较采用Mann-WhitneyU检验。计数资料以例数(百分比)表示,组间比较采用χ2或Fisher检验。采用Kaplan-Meier 曲线及log-rank 检验分析两组患者的DFS 数据。P<0.05 为差异有统计学意义。
结 果
1 两组基线资料比较 两组一般资料如性别、年龄、BMI、基础疾病史、烟酒史、既往腹部手术史、术前减黄(本文指胆道支架置入或经皮肝穿刺胆道引流术)均无统计学差异(P>0.05)。两组术前各项肿瘤标志物、肿瘤位置、影像提示淋巴结转移、术前影像提示血管侵犯(脾动脉、脾静脉)、肿瘤直径均无统计学差异(P>0.05)。直接手术组术前黄疸较多(32.5%vs0,P=0.011),术前胆红素水平较高(16.2 μmol·L-1vs8.6 μmol·L-1,P<0.001)。直接手术组诊断至手术时间明显短于新辅助治疗组(14.14 dvs86.70 d,P<0.001)。见表1。
2 新辅助治疗前后各指标变化和不良反应情况患者新辅助治疗后肿瘤直径、CA19-9、CA242、CA125、CEA 等指标呈现下降趋势,但差异无统计学意义(P均>0.05)。新辅助治疗后影像学疗效评价显示,无CR 或PD 患者,8 例(40%)评价为PR,12 例评价为SD。新辅助治疗的不良反应主要为皮疹、恶心呕吐、肝功能异常、骨髓抑制(白细胞减少、血小板减少)、手足麻木,均为1、2 级,无3 级及以上的严重不良反应。见表2。

表2 新辅助治疗前后患者各指标变化及化疗不良反应Tab.2 Changes before and after neoadjuvant therapy and adverse events
3 两组围术期相关指标比较 两组胰十二指肠切除术/胰体尾切除术比均为9/11。两组术中行门静脉及其他大血管切除或重建、联合周围其他脏器切除、腹腔镜手术比例均无统计学差异(P>0.05)。门静脉及其他大血管切除或重建本组包括门静脉切除或重建、肠系膜上静脉重建、腹腔干切除、肝动脉重建;联合周围其他脏器切除指胰体尾切除联合胃部分切除、结肠部分切除,还有1 例联合左肾切除。两组手术时间、术中失血量、术中输血量、术后ICU 住院时间、术后总住院时间等差异均无统计学意义(P>0.05)。两组均未出现术后90 d 内死亡病例。直接手术组术后带管出院比例较高(45.0%vs20.0%),但两组差异无统计学意义(P=0.058)。两组接受术后辅助化疗及手术至辅助化疗的时间无统计学差异(P>0.05)。见表3。
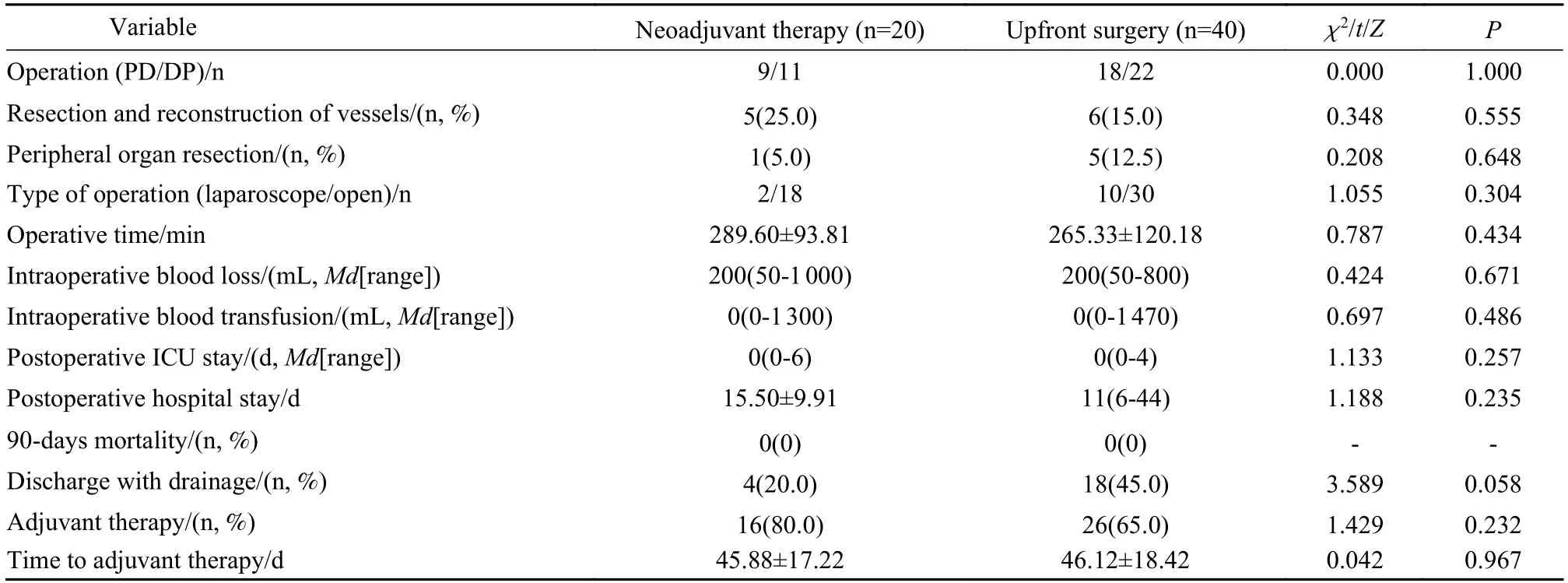
表3 两组围术期相关指标比较Tab.3 Comparison of perioperative characteristics between the two groups
4 两组手术并发症比较 两组术后并发症,如术后腹腔感染、术后胆瘘、术后胰瘘、术后腹腔出血、术后胃排空延迟、术后切口感染、乳糜漏、术后肝肾功能异常、非预期二次手术方面,差异均无统计学意义(P>0.05)。见表4。
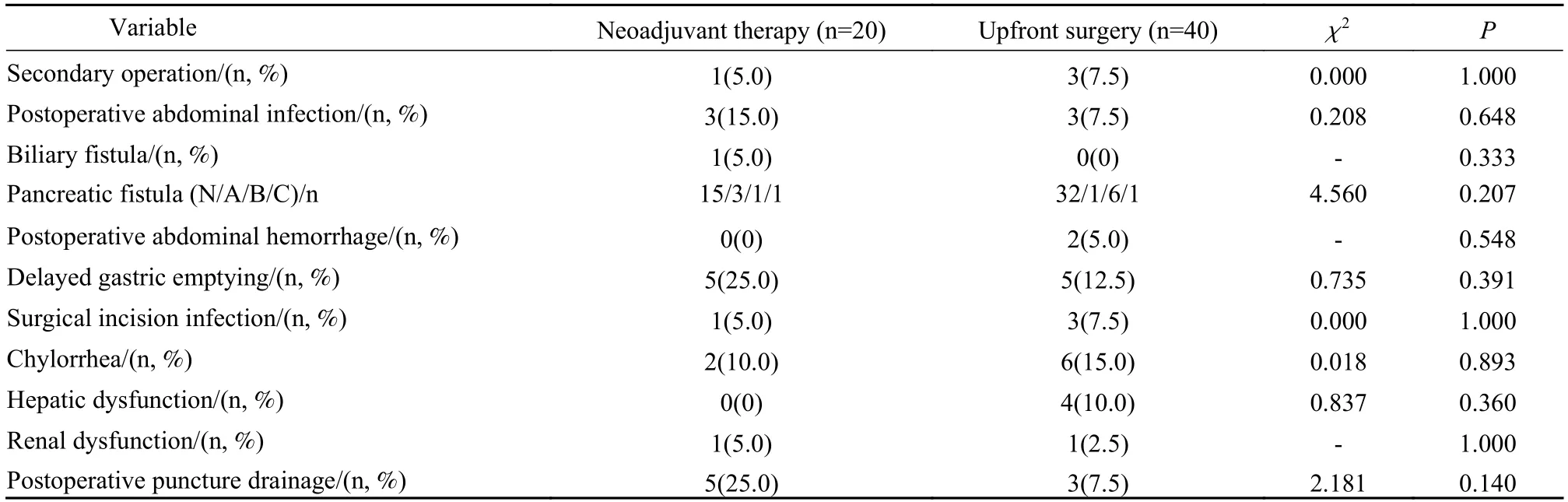
表4 两组手术并发症比较Tab.4 Comparison of postoperative complications between the two groups
5 术后病理情况 两组肿瘤直径、肿瘤分化情况、病理T 分期、切除淋巴结数量、淋巴结阳性数量及阳性率、R0 切除率、神经侵犯、脉管侵犯等均无统计学差异(P>0.05);大血管及周围组织器官侵犯方面,新辅助治疗组1 例肠系膜上静脉受侵、1 例胃后壁受侵,直接手术组1 例肠系膜上静脉受侵、1 例门静脉受侵、1 例胃壁受侵、1 例左肾实质受侵。见表5。
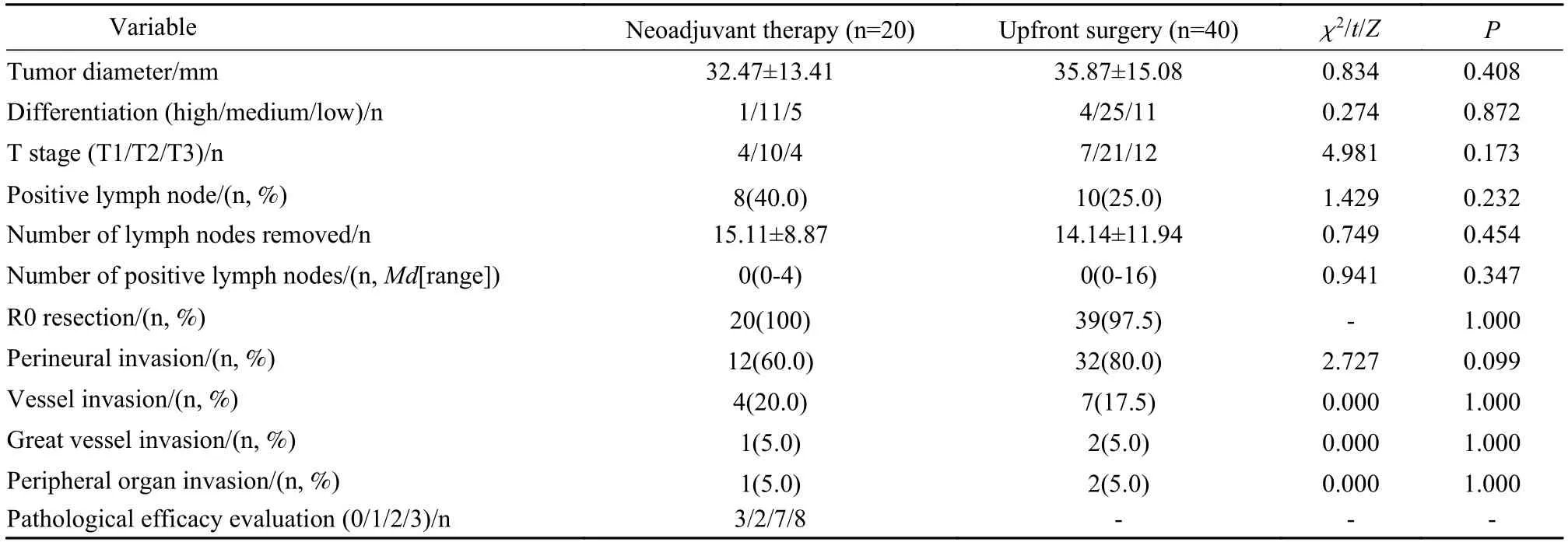
表5 术后病理情况Tab.5 Postoperative pathology results
6 两组术后疗效和无复发生存期比较 新辅助治疗组术后病理疗效评估显示3 例Ryan 评分0 分(PCR),2 例Ryan 评分1 分,总体对新辅助治疗反应率为60%。随访截至2022 年3 月19 日,随访率100%,中位随访时间15(1~ 74)个月。Kaplan-Meier 曲线分析结果显示新辅助治疗组中位DFS 12 个月,直接手术组中位DFS 12 个月,术后两组DFS 无统计学差异(log-rank 检验χ2=0.024,P=0.878)。见图1。
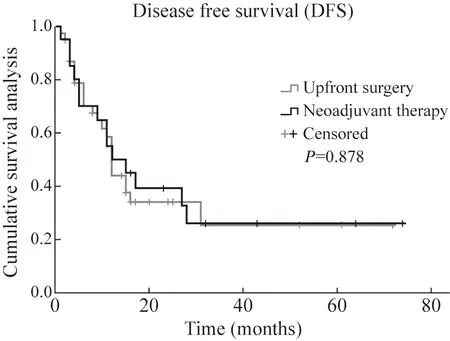
图1 两组无病生存期比较Fig.1 Kaplan-Meier survival curves for disease-free survival
讨 论
胰腺癌根治性切除术,R0 切除率仅有70%~76%[14-15]。研究表明大多数胰腺癌甚至是原位病灶很小的胰腺癌,发现时可能已存在微转移[16]。新辅助治疗可提高胰腺癌R0 切除率、减少淋巴结转移,进而改善患者预后[17]。新辅助治疗的方案选择,目前的指南中多推荐AG 方案或mFOLFIRINOX 方案[8-9,18]。吉西他滨联合替吉奥(GS)方案在日本已成为标准推荐方案,也被我国指南所推荐,对体能状况较差的患者也可行吉西他滨单药方案[18-19]。
本文中两组间各项肿瘤标志物均未显示出统计学差异。直接手术组术前黄疸比例和术前胆红素水平明显更高,这可能是由不同诊疗模式的差异造成。有研究认为CA19-9 可作为新辅助治疗后疗效评估的标志物,新辅助治疗后CA19-9 下降超过50%的患者预后改善明显[20-21]。一项一期临床研究结果显示,新辅助化疗后肿瘤直径、PET/CT 的SUVmax值和CA19-9 明显下降,影像评估为12.9% PR 和9.7% PD[22]。De W Marsh 等[23]的研究中,新辅助治疗后影像评估疗效为5% CR和14% PR,中位肿瘤直径从30 mm 下降至22 mm(P=0.26),CA19-9 从68 U/mL 下降至31 U/mL(P=0.09)。本文结果显示新辅助治疗前后肿瘤直径、CA19-9 等指标均呈现一定程度下降趋势,肿瘤直径缩小,肿瘤标志物下降,但尚未显示出统计学差异。新辅助治疗后影像学评估无CR,40% PR。一方面可能是因为目前常规影像检查在评估胰腺癌新辅助治疗效果方面确实还有着较大的局限性,RECIST1.1 标准在胰腺癌新辅助治疗影像评估中的准确性不高[24]。另一方面反映出新辅助治疗方案对可切除胰腺癌患者的疗效并不让人满意。
一项关于可切除胰腺癌新辅助治疗耐受性和安全性的一期临床研究由于非预期的术中并发症风险增加而被提前终止[25]。本文的研究结果显示,两组在术式与手术切除范围方面匹配度较好,未显示出统计学差异;直接手术组中腹腔镜手术比例稍高,术前黄疸和胆红素水平更高,在此背景下,两组手术时间、术中失血量、术中输血量均无统计学差异,显示出新辅助治疗后胰腺癌根治切除手术术中较高的安全性,并没有增加手术时长、术中失血量及其他术中相关风险。
有研究认为新辅助化疗导致的肿瘤周围纤维化可能降低术后胰瘘的发生率,但化疗的不良反应可能影响术后切口愈合并增加术后腹腔感染发生率[18]。De W Marsh 等[23]的研究中,可切除胰腺癌新辅助治疗后11.8% 患者术后90 d 内死亡。还有研究表明,新辅助治疗增加了胰体尾切除术后C 级胰瘘和胃排空延迟的发生率[26]。也有研究认为新辅助治疗可降低术后B/C 级胰瘘和出血的发生率,降低术后住院时间与死亡率[26-28]。Vento 等[22]和Tajima 等[29]的研究显示,新辅助治疗并没有增加术后并发症发生率和死亡率,且无Ⅳ级或Ⅴ级严重并发症发生。本研究结果显示两组术后并发症、术后住院时间、术后辅助化疗率及时间等方面均无统计学差异,体现出在术后恢复方面,新辅助治疗并没有表现出劣势,具有良好的安全性。
阳性切缘和淋巴结转移被认为是胰腺癌根治性切除术后预后不佳的重要因素[30-31]。本文结果中42.1% 的淋巴结阳性率,100% 的R0 切除率,与既往文献基本相符[32-33]。但在R0 切除率、淋巴结阳性率、阳性淋巴结数量方面,新辅助治疗并没有体现出获益,两组术后病理肿瘤直径也几乎相同。Versteijne 等[34]的多中心临床研究中,新辅助治疗同样没有改善可切除胰腺癌的R0 切除率。
在新辅助治疗疗效评估方面,Vento 等[22]和Tajima 等[29]的研究中,无1 例表现出术后病理评估的明显治疗反应,新辅助治疗呈现出较差的效果。本文术后病理评估12 例(60%)新辅助治疗患者表现出了不同程度的肿瘤坏死,3 例(15%)术后病理提示PCR,5 例(25%) 达到了明显治疗反应。一方面说明新辅助治疗起到了一定程度的治疗效果,但尚无法达到我们的预期;另一方面结合本文影像学评估结果,再次提示目前影像学评估新辅助治疗效果的不足。本文的PCR 比例偏高,可能与样本量相对较少有关,有待更大样本量的验证。
新辅助治疗的另一个重要目的是杀灭微小转移病灶,减少术后早期复发,改善患者生存期。但目前现有文献中,可切除胰腺癌新辅助治疗相比直接手术具有生存获益的报道较少。荷兰的多中心三期临床研究中,中位DFS 和中位OS 在新辅助治疗组与直接手术组患者中几乎相同(9.3 个月vs9.2 个月,14.6 个月vs15.6 个月)[34]。Barbier等[32]、Suzuki 等[35]和Kurata 等[36]的研究同样未发现两组患者OS 和DFS 有统计学差异,未显示出生存获益,上述研究并不推荐对可切除胰腺癌患者行新辅助治疗。本研究中两组术后DFS 无统计学差异(12 个月vs12 个月),且两组均存在术后1 个月复查即提示复发转移的病例。
新辅助治疗患者DFS 无明显改善,可能是由于本文的病例中一部分非高危患者接受了新辅助治疗。可切除胰腺癌与交界可切除或局部晚期胰腺癌并不相同,后两者本身分期较晚,很难获得良好的根治切除且同时合并远处微转移灶的可能较大,所以新辅助治疗可以取得较良好的效果。但在初始可切除胰腺癌患者中,可能只有高危复发转移的患者能真正潜在获益,凸显了可切除胰腺癌再分层的必要性。
对可切除胰腺癌患者来说,新辅助治疗目前还有很长的路要走:1) 目前一线推荐的治疗方案,本身有效率不够高,新辅助治疗的疗效无法让我们满意,新的药物和药物组合亟待研发;2)新辅助治疗的治疗周期、手术时机选择、是否联合放疗或其他手段等都有待进一步研究;3)目前指南中可切除胰腺癌术后复发的高危因素尚显粗糙和笼统,没有明确的量化分类分级手段;4)我们目前缺乏胰腺癌药物敏感度或耐药性的生物标记物、靶点等,或是其他可有效预测药效的手段,无法对新辅助治疗方案进行精准与个体化的选择;5) 新辅助治疗前需取得病理学证据,但反复多次活检仍有约25%患者无法明确病理学证据[37]。
本研究为单中心小样本回顾性研究,尚需高质量的大样本多中心随机对照研究进一步验证。
综上所述,虽然新辅助治疗并没有明显增加手术相关风险,具有良好的安全性,但同样也没有在肿瘤降期、提高R0 切除率、降低淋巴结阳性率等局部控制方面体现出优势,在术后无病生存期上也没有体现出长期生存优势。因此,我们进入全面的可切除胰腺癌新辅助治疗阶段为时尚早,可以对高危复发转移的可切除胰腺癌患者尝试性开展。
利益冲突:所有作者均声明不存在利益冲突。

