三七总皂苷肠溶微丸的含量测定及体外释放度考察
文 丽,刘华钢,罗 轶,赖 玲,陆仕华,秦艳娥(.广西壮族自治区食品药品检验所/国家药品监督管理局中药材质量监测与评价重点实验室,广西 南宁 500;.广西壮族自治区药品监督管理局,广西 南宁 5009;.广西医科大学,广西 南宁 500;.南宁市第一人民医院,广西 南宁 50000)
三七总皂苷(Panax notoginseng saponins,PNS)是五加科植物三七Panax notoginseng(Burk.)F.H.Chen的主要有效活性成分,治疗心血管疾病效果较为显著,临床上有多种以PNS为主要成分的制剂用于治疗心血管疾病如冠心病、高血压病、心力衰竭等[1]。PNS肠溶微丸能够避开胃酸及酶对三七总皂苷的破坏,同时增加其在肠道的吸收,因PNS中三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1的含量最高,是质量控制中的主要指标成分[2-9],故实验选择该3种皂苷为指标测定和评价对象,建立PNS肠溶微丸的含量测定方法,并对PNS肠溶微丸进行体外释放度考察[10-18],为该制剂的质量控制奠定基础。
1 材料与仪器
1.1 药品与试剂PNS(梧州制药集团股份有限公司,批号:101124);PNS肠溶微丸(自制,批号:110601,110603,110605);三七皂苷R1对照品(批号:110745-201619)、人参皂苷Rg1对照品(批号:110703-201731)、人参皂苷Rb1对照品(批号:110704-201625)(中国药品生物制品检定所,供含量测定用);甲醇(批号:206409)、乙腈(批号:197164)(美国Fisher Scientific公司,色谱纯);高纯水(自制);Acryl-EZER丙烯酸树脂肠溶包衣剂(上海卡乐康包衣技术有限公司,批号:050323);空白微丸(上海华高药用丸芯有限公司,批号:101201)。
1.2 仪器LC-20AD型UHPLC,配备SPD-20A型紫外检测器(日本岛津公司);XB-C18色谱柱(美国日旭公司);BP210S电子天平(德国赛多利斯公司);DHG-9146A电热恒温鼓风干燥箱(上海精宏实验设备有限公司);FE28台式酸度计(梅特勒-托利多集团);BGB5-10C高效包衣机(瑞安市东方制药有限公司);BJ-3智能崩解实验仪(天津市旭阳仪器设备有限公司);标准筛(上海筛网厂)。
2 方法与结果
2.1 PNS肠溶微丸(胶囊型)的制备 取三七总皂苷90 g,羟丙基甲基纤维素4.5 g,低取代羟丙基纤维素4.5 g,混匀,用60%乙醇溶解,置恒流泵中,开启浆叶不断搅拌。将空白微丸置包衣机中滚动预热,喷浆液上药,至长大成丸。完成上药后再滚转25 min,喷丙烯酸树脂肠溶包衣剂进行包衣,至微丸增重20%,停止喷液,继续滚转25 min,取出,45℃下干燥6 h,将筛选出的微丸装入普通胶囊,即得。
2.2 溶液的制备
2.2.1 对照品溶液的制备 分别精密称取减压干燥至恒重的三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1各20 mg,置于20 mL容量瓶中,用甲醇溶解并定容至刻度,摇匀,制成贮备液。4℃冷藏保存。
2.2.2 供试品溶液的制备 取装量差异项下的本品内容物,混匀,研细,取0.19 g(约含PNS 20 mg),精密称定,至100 mL容量瓶中,加水80 mL,超声处理15 min,用水稀释至刻度,摇匀,滤过,取续滤液即得。
2.2.3 空白辅料溶液的配制 按处方组成,取除PNS以外的所有辅料,按制备工艺要求,制成不含PNS的微丸(胶囊型),按供试品溶液制备项下的方法,制成空白辅料溶液。
2.3 色谱条件与系统适用性试验 色谱柱:XB-C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈(A)-水(B),梯度洗脱,流脱程度为:0 min~17 min,25%A;17~18 min,25%A→45%A;18~25 min,45%A→25%A;流速:1.0 mL·min-1;检测波长:203 nm;柱温:30℃;进样量:20 μL。按上述色谱条件测定,三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1的分离度分别为5.95、4.73、12.09,分离效果良好。理论塔板数按三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1峰计算分别为10852.3、12536.3、18825.7。
2.4 方法学考察
2.4.1 专属性考察 分别精密吸取对照品溶液、供试品溶液和空白辅料溶液各20 μL,于上述色谱条件下进样,记录色谱图。结果供试品色谱峰与对照品色谱峰保留时间一致。空白辅料溶液在相应保留时间无色谱峰,表明空白辅料对主成分无干扰。(见图1)
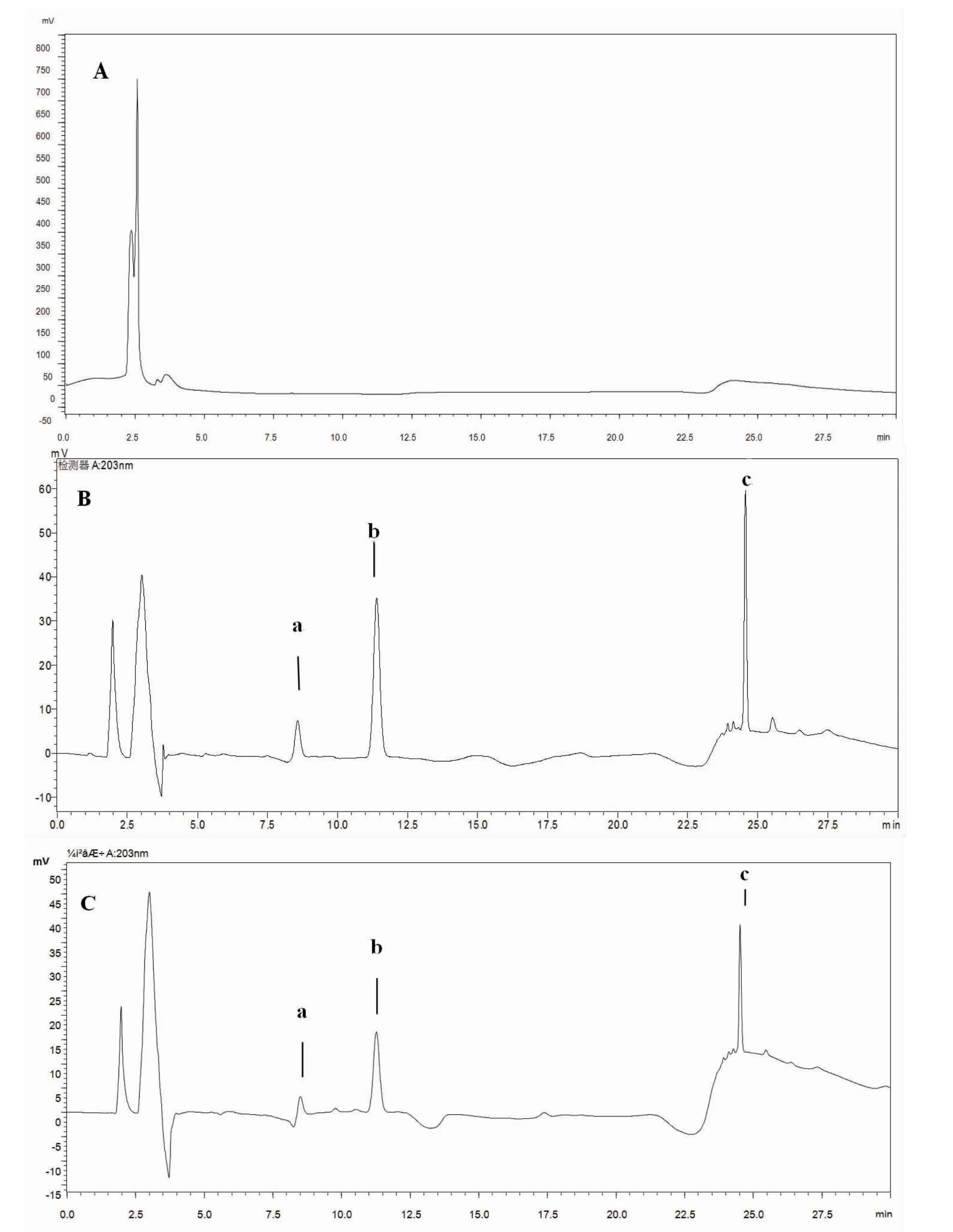
图1 HPLC色谱图
2.4.2 线性关系考察 精密称取空白辅料6份,再分别精密量取三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1对照品贮备液适量,按“2.2.2”项下处理,获得一组标准工作液,精密吸取20 μL,注入超高效液相色谱仪,测定,即得。以浓度峰面积A为横坐标,以峰面积C为纵坐标进行线性回归,得到标准曲线方程、相关系数r和线性范围。结果三七皂苷R1:C=0.0002A-3.8741(r=0.9995),线性范围3.477~111.250 μg·mL-1,人参皂苷Rg1:C=0.0002A-1.6865(r=0.9999),线性范围4.517~114.985 μg·mL-1,人参皂苷Rb1:C=0.0002A-0.8396(r=0.9998),线性范围4.783~152.100 μg·mL-1,线性关系良好。
2.4.3 精密度试验 取同一浓度的PNS供试品,重复进样6次,测得峰面积值。结果三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1的RSD分别为0.53%、1.08%、1.37%。表明该方法精密度良好。
2.4.4 检测限与定量限 检测限和定量限由信噪比法确定,在上述色谱条件下,三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1的检测限分别为0.584、0.631、0.565 μg·mL-1,定量限分别为1.752、1.893、1.695 μg·mL-1。
2.4.5 稳定性试验 取PNS肠溶微丸,按“2.2.2”项下处理,供试品溶液于室温下放置,分别于0、4、8、12、24、48 h测定,考察室温条件下3种皂苷的稳定性。结果显示:三七皂苷R1在0、4、8、12、24、48 h含量分别为18.68、18.66、18.59、18.57、18.51、18.42 μg·mL-1,RSD为0.52%;人参皂苷Rg1在0、4、8、12、24、48 h含量分别为117.48、117.27、117.09、116.56、116.08、115.34 μg·mL-1,RSD为0.67%;人参皂苷Rb1在0、4、8、12、24、48h含量分别为67.11、67.03、66.77、66.48、66.04、65.48 μg·mL-1,RSD为0.99%。表明供试品溶液在室温放置48 h,其3种皂苷稳定性良好。
2.4.6 加样回收率试验 取已知含量的供试品9份,每份约20 mg,精密称定,置100 mL量瓶中,精密量取“2.2.2“项下的对照品贮备液,分别加入高、中、低(1.2、1.0、0.8)浓度的三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1对照品溶液,每个浓度分别按“2.2.2”项下方法制备3个供试品溶液,测定各组分含量,计算加样回收率。三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1平均回收率率分别为101.61%、100.89%、100.23%、RSD分别为1.82%、2.36%、1.45%。表明此测定方法准确度较好。(见表1)

表1 加样回收率试验结果(n=9)
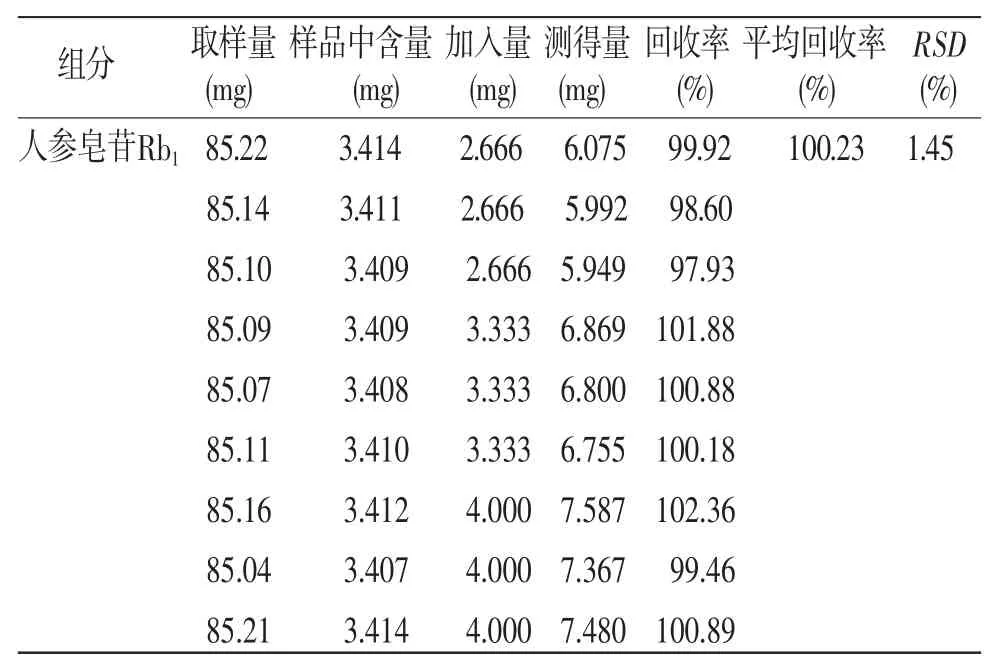
续表1:
2.4.7 样品含量测定 分别称取3批肠溶微丸10 g,研细,精密称取粉末0.17 g(约含PNS 20 mg)置于100 mL容量瓶中,按“2.2.2”项下方法制备供试品溶液。取供试品溶液20 μL进行分析,按上述的色谱条件测定,计算三七皂苷R1、人参皂苷Rb1和人参皂苷Rg1的含量,结果3批肠溶微丸中三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1含量分别为12.62、65.39、40.06 mg·g-1,在PNS中三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1的含量分别为10.40%、53.01%、32.49%。(见表2)
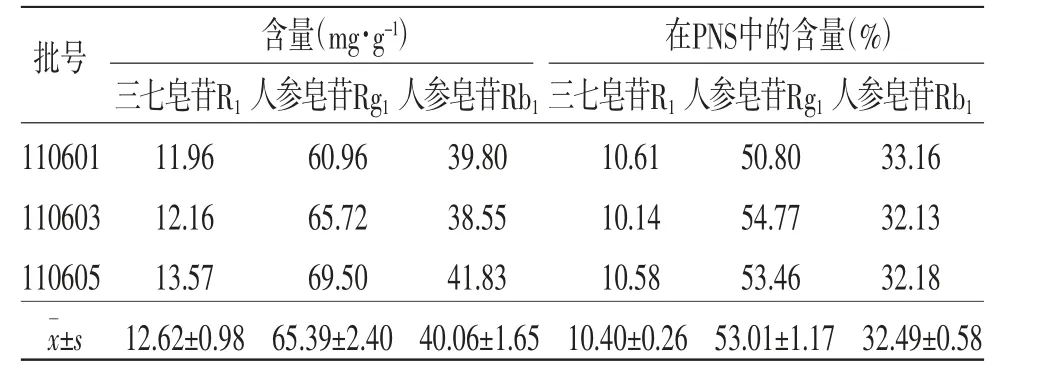
表2 三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1的含量
2.5 PNS肠溶微丸体外释放度 释放度测定法根据2020年版《中华人民共和国药典》通则0931溶出度与释放度测定法检测。
2.5.1 酸中释放度 取0.1 mol/L盐酸溶液900 mL,注入每个溶出杯中,待溶液温度恒定在(37.0±0.5)℃,取供试品6粒分别投入溶出杯中,启动仪器,2 h后在规定取样点吸取溶出液适量,滤过,自取样至滤过应在30 s内完成。按上述色谱条件测定。
2.5.2 缓冲液中释放度 弃去上述各溶出杯中盐酸溶液,立即加入温度为(37±0.5)℃的磷酸盐缓冲液(pH值=6.8)900 mL,启动仪器,分别于5、15、30、45、60、90 min规定取样点吸取溶出液适量,滤过,自取样至滤过应在30 s内完成。按上述色谱条件测定。(见表3、图2)
表3 3批制剂在酸中、磷酸盐缓冲液中的释放度(±s,%,n=6)
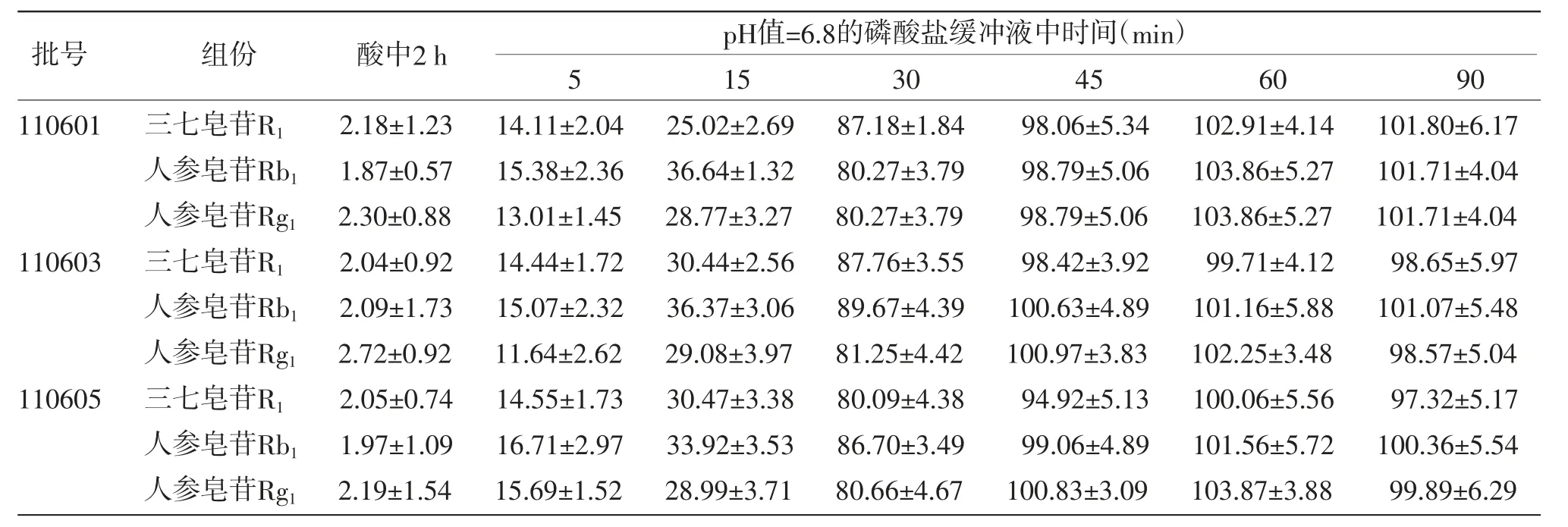
表3 3批制剂在酸中、磷酸盐缓冲液中的释放度(±s,%,n=6)
批号 组份 酸中2 h pH值=6.8的磷酸盐缓冲液中时间(min)515 30 45 60 90110601 三七皂苷R1 2.18±1.23 14.11±2.04 25.02±2.6987.18±1.84 98.06±5.34102.91±4.14101.80±6.17人参皂苷Rb1 1.87±0.57 15.38±2.36 36.64±1.3280.27±3.79 98.79±5.06103.86±5.27101.71±4.04人参皂苷Rg1 2.30±0.88 13.01±1.4528.77±3.2780.27±3.79 98.79±5.06103.86±5.27101.71±4.04110603 三七皂苷R1 2.04±0.92 14.44±1.72 30.44±2.5687.76±3.55 98.42±3.92 99.71±4.12 98.65±5.97人参皂苷Rb1 2.09±1.73 15.07±2.32 36.37±3.0689.67±4.39100.63±4.89101.16±5.88101.07±5.48人参皂苷Rg1 2.72±0.92 11.64±2.6229.08±3.9781.25±4.42100.97±3.83102.25±3.48 98.57±5.04110605 三七皂苷R1 2.05±0.74 14.55±1.73 30.47±3.3880.09±4.38 94.92±5.13100.06±5.56 97.32±5.17人参皂苷Rb1 1.97±1.09 16.71±2.97 33.92±3.5386.70±3.49 99.06±4.89101.56±5.72100.36±5.54人参皂苷Rg1 2.19±1.54 15.69±1.5228.99±3.7180.66±4.67100.83±3.09103.87±3.88 99.89±6.29
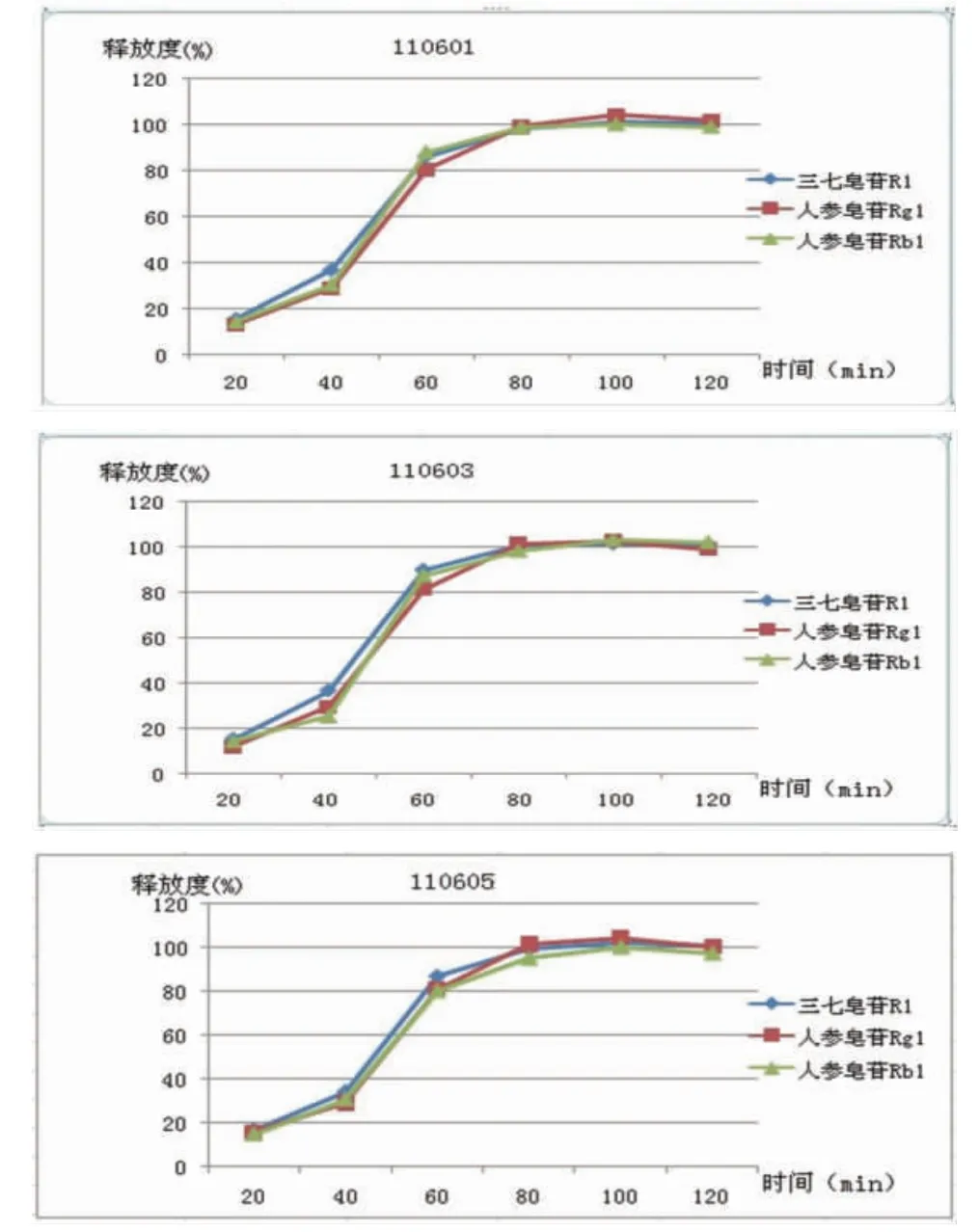
图2 3批制剂在缓冲液中的释放度(pH值=6.8)
结果表明,三七皂苷R1、人参皂苷Rg1和人参皂苷Rb1在酸中释放量小于标示量的10%,在pH值=6.8的缓冲液中45 min累积释放量大于标示量的70%,符合制剂要求。
3 讨论
据前期研究发现[7-9],三七总皂苷口服给药在酸性条件下会降解为苷元,而小肠是其最佳吸收部位,为提高三七总皂苷的口服生物利用度,笔者将其制备成肠溶微丸[19-20]。试验中考察了加热回流和超声提取两种方法,两种方法提取效率相当,考虑超声提取更快捷方便,故采用超声法提取该制剂中的皂苷类成分。参考相关文献[18-20]及2020年版《中华人民共和国药典》,采用HPLC法用乙腈-水梯度洗脱,能同时检测三七皂苷R1、人参皂苷Rg1和人参皂苷Rb13个指标成分,且分离度良好,辅料无干扰,检测时间短,可以准确、快速地实现PNS肠溶微丸的定量测定。在体外释放度考察中,三七总皂苷肠溶微丸中的三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1即使在酸液中有溶出释放,也易被破坏降解而难以检测出来,因此选择磷酸盐缓冲液(pH值=6.8)作为释放介质测定三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1的体外释放量。笔者以三七总皂苷的胃肠道吸收特性研究为基础,进行了肠溶制剂的研究,并建立PNS肠溶微丸的指标成分三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1的HPLC含量测定方法,并对3批PNS肠溶微丸进行体外释放度考察。根据前期研究[7-9],三七皂苷R1、人参皂苷Rb1和人参皂苷Rg1在PNS原料中的含量分别为9.16%、57.90%与32.57%,制成PNS肠溶微丸后在PNS中的含量为分别为10.40%、53.01%与32.49%,差异不明显,说明PNS主要有效成分的含量在制备过程中无明显变化。释放度测定结果表明,3批制剂的体外释放度良好,三七皂苷R1、人参皂苷Rb1、人参皂苷Rg1的释放行为无明显差异,符合《中华人民共和国药典》对肠溶制剂的要求,上述研究结果减少了制剂开发的盲目性,为今后三七总皂苷口服给药途径的研究提供了重要实验依据。

