卵巢癌组织中差异lncRNAs的筛选及其lncRNA ZEB2-AS1的表达分析
董 辉,王婷婷,马晓红,马盛宗,丁永慧
(宁夏医科大学总医院 1.医学科学研究院; 2.临床医学院; 3.妇科,宁夏 银川 750004)
卵巢癌(ovarian cancer,OC)是严重威胁女性健康的常见恶性肿瘤之一,由于缺乏有效的筛查手段,导致5年生存率低于50%[1]。2018年全球癌统计数据报告显示全球女性肿瘤中OC的发病率和病死率排在第7位,分别为7.0/10万和3.8/10万[2]。中国OC的发病率仅次于子宫颈癌和子宫体癌位居第3位,而病死率却排在妇科肿瘤的第1位[3]。OC根据组织发生来源不同,可以分上皮性卵巢癌(epithelial ovarian cancer,EOC),生殖细胞肿瘤,性索间质-支持细胞肿瘤,转移性肿瘤,其中EOC约占卵巢恶性肿瘤的90%以上[4]。由于卵巢组织体积小,且位于盆腔深部,患病后往往症状隐匿,缺乏早期筛查和诊断的方法,且卵巢表面无腹膜覆盖,早期即容易发生转移,即使采取非常积极的治疗手段,OC的复发转移率仍然很高,预后极差。OC发生及转移的分子机制一直是肿瘤生物学家研究的热点和难点。近年来的研究表明,长链非编码RNA(long non-coding RNA,lncRNA)以RNA的形式在多种层面上调控了基因的表达水平,参与调节机体生理、病理过程[5]。本文通过对OC组织样本进行差异lncRNAs的表达分析,筛选关键lncRNA,以期为OC中lncRNA的研究奠定基础。
1 材料与方法
1.1 主要试剂
Trizol® Reagent(Invitrogen公司);RNeasy Mini Kit(74104)(Qiagen 公司);Baseline-ZEROTMDNase(EPICENTRE公司);Quick Amp Labeling Kit、SYBR® Green real-time quantitative PCR Master Mix(Agilent公司);Thermo Scientific Revert Aid First Strand cDNA Synthesis Kit(Fermentas公司);卵巢癌组织芯片(HOvaC154Su01)、多器官组织芯片(HOrgC-120PG04)(上海芯超生物科技有限公司);LncRNA锌指E-box结合同源异型盒2反义RNA 1(zinc finger E-box binding homeobox 2 antisense RNA 1,ZEB2-AS1)BaseScope 探针(Advanced Cell Diagnostics公司);BaseScopeTM二代红色试剂盒(Advanced Cell Diagnostics公司)。
1.2 方法
1.2.1 临床样本的收集: 收集宁夏医科大学总医院2018年1月至2019年6月在妇科住院的卵巢癌患者标本36份,以及正常卵巢组织22份。正常组织作为对照组(normal),癌组织作为实验组(test),其中各取3份组织送上海康成生物工程有限公司进行芯片检测。本研究得到宁夏医科大学总医院伦理委员会的支持(2019-177)。患者均告知并签署了知情同意书。纳入标准:原发上皮性卵巢癌,未经过放射和化学治疗,术中切除的标本经过病理科免疫组化确诊。正常卵巢组织来源于因子宫良性疾病行子宫双附件切除的患者。
1.2.2 LncRNA表达谱芯片分析:组织破碎采用组织破碎仪进行研磨,Trizol法提取总RNA,NanoDrop ND-2000进行质量检测,合格的总RNA标本采用Baseline-ZEROTMDNase进行DNA消化,RNeasy Mini Kit 进行RNA纯化回收,使用Arraystar RNA Flash Labeling Kit对样本进行标记,标志物采用Cyanine-3-CTP,再次以RNeasy Mini Kit进行RNA纯化回收,NanoDrop ND-2000完成质量检测,使用Agilent SureHyb进行杂交实验,芯片采用Arraystar人类lncRNA芯片(v4.0),芯片经过洗涤后,使用以Agilent DNA Microarray Scanner完成扫描。
Arraystar人类lncRNA芯片(v4.0)能够检测40 173条lncRNAs和20 730条源自UniProt(Universal Protein Resource)的蛋白质编码转录本,芯片上也包括了阳性探针(看家基因)和阴性探针,以进行杂交质控监测。
1.2.3 Real-time PCR 验证分析:以Fold Change≥5作为删选条件,进一步精确至10个lncRNA的差异表达,以荧光定量分析其在收集的36份癌与22份正常组织中的表达情况,组织破碎采用组织破碎仪进行研磨,Trizol法提取总RNA,NanoDrop ND-2000进行质量检测,以Thermo Scientific Revert Aid First Strand cDNA Synthesis Kit合成第一链cDNA,以SYBR® Green real-time quantitative PCR Master Mix试剂盒说明书完成荧光定量上机检测,机器采用ViiA 7 real-time PCR System。引物见表1,以β-actin作为内参,各样品的目的基因和内参基因分别进行real-time PCR反应。根据PCR产物绘制梯度稀释标准曲线,各样品目的基因和内参基因的浓度结果直接由机器生成,每个样品的目的基因浓度除以其管家基因的浓度,即为此样品此基因的校正后的相对含量。

表1 LncRNA real-time PCR检测引物
1.2.4 原位杂交:因检测发现的lncRNA ZEB2-AS1在癌组织中表达最高,因此,以此lncRNA作为研究对象,采用RNA杂交检测其在组织标本中的表达。组织芯片选用多器官组织芯片(HOrgC120PG04),ZEB2-AS1探针为BaseScopeTM系统,偶联可见红光,以BaseScopeTM二代红色试剂盒说明书完成石蜡切片的杂交实验,卵巢癌及其他癌组织标本的石蜡切片采用组织芯片,以正置荧光显微镜进行拍照。
1.2.5 组织cDNA芯片表达分析:real-time PCR检测方法见1.2.3,组织芯片选用生存期卵巢癌组织芯片(HOvaC160Su01),合计160例卵巢肿瘤。其中,良性肿瘤2例,生存期卵巢癌158例(癌旁3例原发灶141例/转移灶14例),随访5~9年。结果分析中排除因例数太少无法统计的,以及临床病理资料不全的及无实验数据的样本位点,即良性肿瘤2例,癌旁3例,癌转移灶12例,非上皮来源癌原发灶3例,仅对上皮来源癌原发灶130例位点的结果进行统计分析。病理分型分组为Ⅰ型(低级别浆液性癌/子宫内膜样癌/透明细胞癌/黏液癌等)、Ⅱ型(高级别浆液性癌/肉瘤/未分化癌等)。Ⅰ型包括低级别浆液性癌、子宫内膜样癌、透明细胞癌及黏液癌,通常由癌前病变逐步进展而来。Ⅱ型则包括高级别浆液性癌、肉瘤和未分化癌,Ⅱ型常见于疾病进展期,恶性程度更高。以130例位点ZEB2-AS1的表达水平中位数1.575作为界限,≤1.575分为低表达组,>1.575分为抗体高表达组。
1.3 数据分析
使用Agilent Feature Extraction软件(v11.0.1.1)获得芯片图,并读值,得到原始数据。使用Gene Spring GX v12.1软件(Agilent Technologies)对原始数据进行Quantile标准化和随后的数据处理。原始数据标准化后经过筛选高质量探针(某探针在6个样品中至少有3个被标记为Present或Marginal)进行进一步分析。两组样品间具有统计学意义的差异表达lncRNA或差异表达mRNA通过P-value/FDR筛选,两个组间差异表达lncRNAs或差异表达mRNAs通过Fold Change筛选。
2 结果
2.1 LncRNA与mRNA在卵巢癌中的差异表达
挑选的3对上皮性卵巢癌组织和正常卵巢组织RNA提取质检合格,A260/280在1.87~2.01质检,浓度在214.36~607.36 mg/L质检,在用DNA酶消化后进行了采用变性琼脂糖凝胶电泳进行RNA完整性和gDNA污染测试,显示无DNA污染,条带大小均匀的分为28、18和5.8 s,无降解。
相比于对照组,实验组共有4 982个差异表达的lncRNA,其中1 941个lncRNA表达上调,3 041个lncRNA表达下调(图1)。
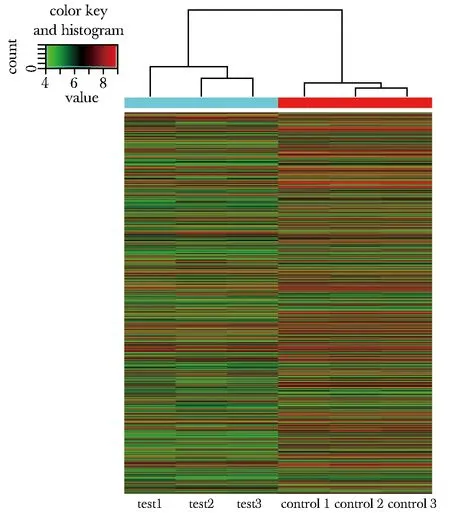
图1 LncRNA聚类分析图
2.2 LncRNA 荧光定量表达验证
相比于对照组,实验组ENST00000428814、KRT8P41、ZEB2-AS1、DUXAP8高表达,差异显著(P<0.05),ENST00000609183、ST13P4、GSTM2P1、CXADRP3、LINC00899、FAM153B低表达(P<0.05)(图2)。
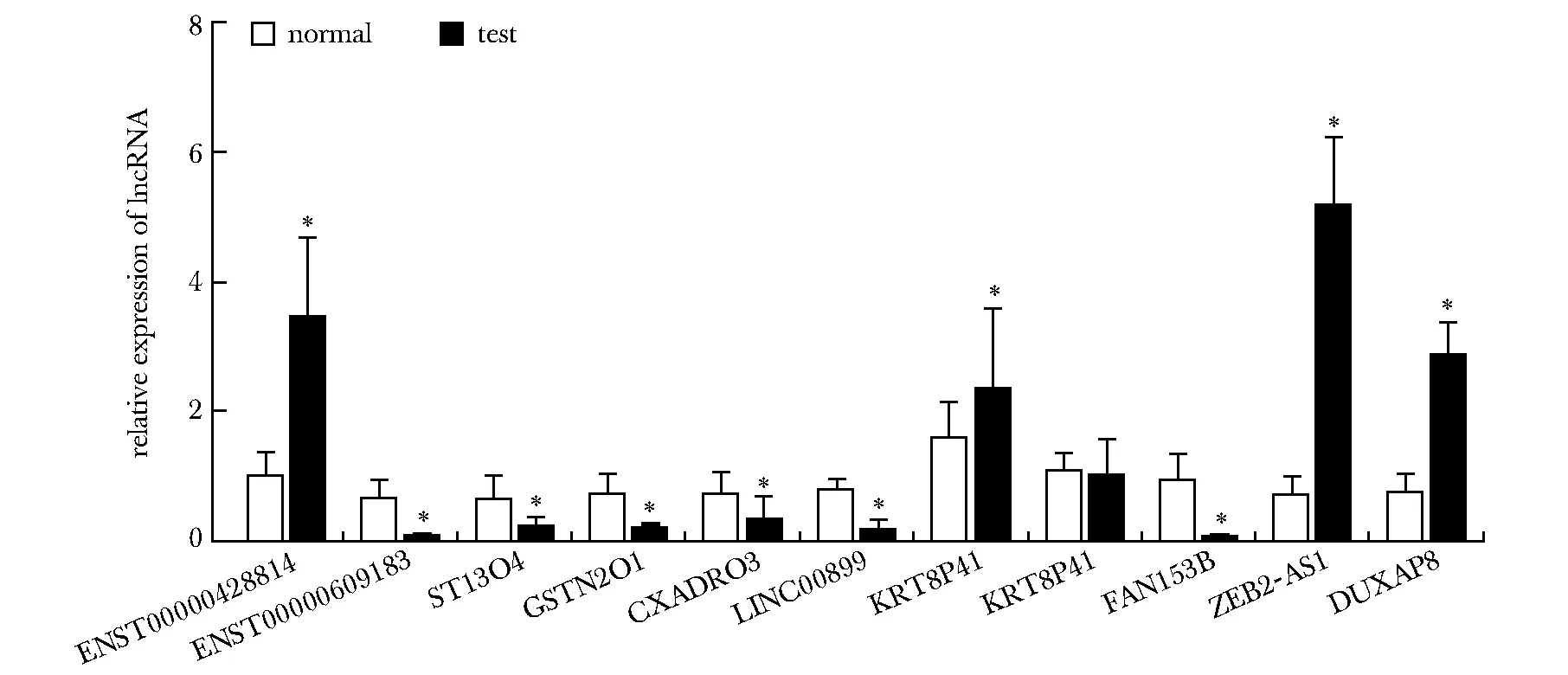
*P<0.05 compared with control group
2.3 ZEB2-AS1的原位杂交表达验证
ZEB2-AS1在癌组织中高表达,用RNA杂交检测提示ZEB2-AS1在肺癌、肝癌、结肠癌、肾癌、胃癌和OC组织标本中高表达(图3)。
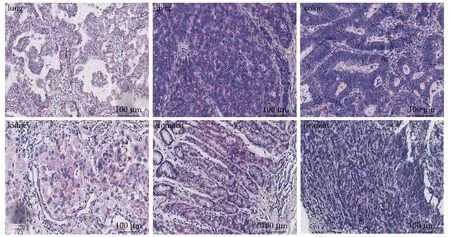
图3 LncRNA ZEB2-AS1在多个癌组织中的表达
2.4 OC组织cDNA芯片real-time PCR结果
ZEB2-AS1的表达水平与肿瘤大小、病理分级、病理分型、T、N、M分期以及临床分期均有相关性(P<0.05)。ZEB2-AS1高表达58例,低表达72例,与总生存期显著相关(P<0.05),与无病生存期显著相关(P<0.05),均体现在ZEB2-AS1高表达的生存期低(图4)。
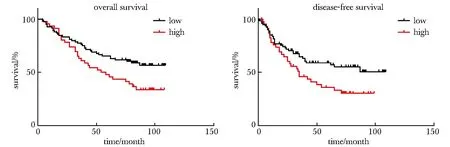
图4 LncRNA ZEB2-AS1的表达与生存期的相关性
2.5 LncRNA ZEB2-AS1的生物信息学分析
LncRNA ZEB2-AS1属于antisense lncRNAs,来源于ZEB2基因的反义序列,ZEB2-AS1的序列与ZEB2部分完全重合, 位于2号染色体, 始于145 277 180位点,终止于145 278 465位点,全长430 bp。芯片数据中差异antisense lncRNAs与相应mRNAs联合分析表明,ZEB2-AS1同ZEB2基因的表达趋势一致,均高表达。lncLocator预测发现ZEB2-AS1定位于细胞质,miRcode 预测发现ZEB2-AS1具有13个microRNA(miRNA)结合位点,包括miR-142-3p、146a、145、204等。
3 讨论
LncRNA是一类转录本长度大于200 bp,但因其缺乏完整的开放阅读框架而不具编码蛋白质的序列,具有致癌或抑癌的功能[6]。本文通过微阵列芯片筛选发现4 982个lncRNA在OC中有表达差异。进一步扩大OC标本,以real-time PCR验证差异最高的10个lncRNA,发现ZEB2-AS1表达差异最为显著。OC患者ZEB2-AS1表达水平的研究仅有一篇报道,结果显示 ZEB2-AS1在癌组织中的表达水平明显升高[7],这与本文的结果一致。
ZEB2-AS1的失调可导致肿瘤发生和发展,可以作为人类癌的诊断标记或治疗靶标[8]。研究显示在结直肠癌中ZEB2-AS1表达上调,ZEB2-AS1的高表达与总生存率低有关[9]。人肺癌中ZEB2-AS1的转录水平显着上调,ZEB2-AS1通过促进其增殖或抑制细胞凋亡对肺癌进展的影响[10]。肝癌组织中ZEB2-AS1高表达,与原发肿瘤的大小,肝内转移和肿瘤淋巴结转移阶段显着相关[11]。本文以多器官组织芯片进行ZEB2-AS1的原位杂交,结果显示其在包括卵巢、肝、胃等多个癌组织中过表达,这与相关研究结果一致。通过对OC中ZEB2-AS1的表达和临床病理资料及生存等相关性分析发现,与肿瘤大小、病理分级、病理分型、肿瘤大小(T)、淋巴结受累情况(N)、远处转移(M)以及临床分期均有相关性,均体现在ZEB2-AS1高表达的患者总生存期和无病生存期低。文献证实,ZEB2-AS1在OC组织中的表达与临床病理特征及预后密切相关[7],这与本文的结果一致。
LncRNA 可通过内源竞争RNA(competing endogenous RNAs,ceRNAs)机制、结合生物大分子等调节基因表达,在肿瘤细胞内发挥调控作用[12]。报道显示ZEB2-AS1过表达对胃癌细胞增殖和侵袭的影响是通过miR-143-5p /HIF-1α介导的[13]。胰腺癌中ZEB2-AS1负调控miR-204的表达,靶向HMGB1基因介导促癌作用[14]。ZEB2-AS1吸附miR-27bb介导膀胱癌细胞的增殖和侵袭作用[15]。ZEB2-AS1与EZH2结合可增强骨肉瘤细胞的增殖和侵袭能力,并抑制细胞凋亡[16]。这均与ceRNA调控机制、与生物大分子相互作用方面息息相关。本文数据显示 ZEB2-AS1与相应的邻近基因ZEB2之间表达相关,ZEB2作为致癌基因具有推动上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)发生的作用,那么 ZEB2-AS1与ZEB2之间是否有相互关系,是否通过miRNA形成ceRNA机制,或者二者结合发挥调控作用?均需要进一步的实验验证。
尽管ZEB2-AS1在多个肿瘤中被鉴定为致癌lncRNA,但其在OC中的作用机制未见报道。总之,本文发现ZEB2-AS1在OC中的异常表达,提示其具有重要的研究价值,可能具有作为治疗靶点或诊断预后标志物的潜能。

