缺氧诱导巨噬细胞来源外泌体的提取与鉴定
张 蓉,阎春英,高淑娟,王 雪,单 虎,商博鑫*
(1陕西省人民医院消化内科,西安 710068;2西安交通大学第二附属医院呼吸内科;*通讯作者,E-mail:shangboxinshb@163.com)
巨噬细胞作为人类免疫系统重要组成部分,参与机体内许多正常生理过程和病理过程,与感染、动脉粥样硬化、肥胖、肿瘤、哮喘等众多疾病密切相关[1]。机体发生炎症后会造成局部组织缺氧,缺氧进一步诱导炎症反应,促使局部炎症微环境中大量的巨噬细胞浸润[2,3],低氧状态下通过依赖于低氧诱导因子促进细胞外泌体的释放。外泌体是由正常的或包含癌细胞在内的所有病变类型细胞分泌的细胞外微小囊泡,存在于所有体液和体外培养的细胞系中,其直径大小约30~150 nm[4-6]。外泌体通过与周围细胞之间相互交换信号分子进行细胞间信息传递,不仅能诱导炎症反应而且能调节某些免疫反应,包括免疫的激活和免疫的抑制[7],参与许多疾病的病理生理过程,如免疫反应、维持干细胞、组织修复、心血管疾病的病理过程、神经退行性变、肿瘤发生和炎症[8]。巨噬细胞来源的外泌体在胰岛素抵抗、炎症性肠病、感染、肿瘤等很多疾病的发病机制中起着重要的作用。关于缺氧诱导巨噬细胞释放的外泌体的特征及生物学特性目前研究甚少。因此,本研究主要观察缺氧能否诱导巨噬细胞产生外泌体,进一步对外泌体的形态特征进行鉴定分析,为后续探索该外泌体在消化道炎症性疾病及相关肿瘤中的生物学作用奠定基础。
1 材料与方法
1.1 试剂与仪器
人单核细胞系THP-1及RPMI-1640培养基购自武汉普诺赛生命科技有限公司,胎牛血清购自美国的Gibco公司,能诱导THP-1细胞分化成巨噬细胞的佛波酯(phorbol 12-myristate 13-acetate,PMA)购自美国的MedChemexpress生物科技公司,总的外泌体提取试剂盒购自美国的Invitrogen生命技术有限公司,CD63兔抗人多克隆抗体购自武汉爱博泰克生物科技有限公司,HSP70鼠抗人单克隆抗体购自英国的Abcam公司,Histone作为核内参蛋白在此处作为外泌体蛋白的阴性对照,Histone H3鼠抗人单克隆抗体购自北京博奥森生物技术有限公司。BCA蛋白浓度测定试剂盒购自上海碧云天生物技术有限公司,缺氧培养箱Heal force HF100,透射电子显微镜JEM1230;纳米颗粒跟踪分析仪Nanosight NS300。
1.2 方法
1.2.1 巨噬细胞诱导培养 用含有10%胎牛血清的RPMI-1640培养基(含1%的青霉素和链霉素)培养人THP-1单核细胞,在37 ℃、5% CO2的培养箱中培养,取对数生长期的细胞,制成单细胞悬液,接种至培养皿,待细胞密度达到80%后,采用含有PMA(0.1 mmol/L)的细胞培养基孵育培养24 h,促使THP-1细胞分化成为巨噬细胞。
1.2.2 缺氧诱导巨噬细胞的培养 将上述诱导分化好的巨噬细胞转入25 ml培养瓶,加入含20%胎牛血清的RPMI-1640培养液5 ml,置于37 ℃、5% CO2细胞培养箱中培养12 h,然后在缺氧(37 ℃,5% CO2,93% N2,2% O2)培养箱中继续培养0,12,24 h,收集细胞培养上清液,分别收集20 ml细胞上清液进行后续实验。
1.2.3 缺氧诱导巨噬细胞分泌外泌体 将收集到的细胞培养上清液经2 000g离心30 min,以去除细胞、碎片等物质,按照外泌体提取试剂盒说明书,以2 ∶1的体积加入细胞上清及外泌体提取液,将混合液于4 ℃孵育过夜,在4 ℃、10 000g离心1 h,所得沉淀即为所需外泌体,用PBS缓冲液重悬外泌体,分装保存于4 ℃及-80 ℃,用于外泌体的下一步鉴定。
1.3 缺氧诱导巨噬细胞分泌外泌体的鉴定
1.3.1 外泌体蛋白含量的测定 使用BCA试剂盒按照说明书进行,将标准品进行适当稀释,制成蛋白浓度为1,0.8,0.6,0.4,0.2 mg/ml的标准蛋白,将待测蛋白样品及标准蛋白分别加入96孔板内,设置3个平行孔,每空加入20 μl,待反应结束后,用DG-3022A酶标仪测定OD568值,根据标准蛋白浓度和相应的OD值计算直线回归方程,根据蛋白样品OD值,利用回归方程计算出样品蛋白浓度。
1.3.2 Western blot测定外泌体中CD63、HSP70及Histone蛋白的表达 首先制备5%的浓缩胶和12%的分离胶,将提取的外泌体蛋白进行变性处理,在上样孔中分别加入40 μg的蛋白样品及Marker,先后以80 V和120 V的恒定电压进行电泳分离,取出电泳凝胶根据Marker切下目标条带,用湿转法将凝胶中的蛋白转移至PVDF膜上,再与CD63(1 ∶1 000)、HSP70(1 ∶1 000)、Histone(1 ∶20 000)一抗和相应二抗(1 ∶10 000,1 ∶10 000,1 ∶600)依次进行孵育。最后使用ECL试剂进行显影曝光,扫描胶片,用BandScan软件分析胶片灰度值。
1.3.3 透射电子显微镜观察外泌体的形态和特征 将20 μl外泌体悬液滴于铜网表面,静置3~5 min取出铜网,用滤纸条吸除多余的液体,采用3%磷钨酸溶液进行室温复染3~5 min,继续使用滤纸吸除多余的液体,白炽灯下晾干。采用透射电子显微镜观察并拍照记录。
1.3.4 外泌体粒径的测定 取20 μl外泌体悬液,用纯水稀释后通过针筒注入样品池中,再把样品池推入主机内,使用Nanosight NS300仪分析外泌体的粒径大小。
1.4 统计学方法
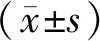
2 结果
2.1 佛波酯诱导THP-1分化成巨噬细胞
THP-1细胞呈圆形或类圆形,待细胞培养生长密度达80%时,采用0.1 mmol/L的PMA诱导培养24 h,细胞分化成为梭形的巨噬细胞(见图1)。

A.THP-1细胞 B.分化形成的巨噬细胞图1 PMA诱导THP-1细胞分化成巨噬细胞 (×100)Figure 1 THP-1 cells and macrophages after PMA induction (×100)
2.2 外泌体的含量测定
以不同蛋白标准品的浓度为横坐标,将各浓度蛋白标准品在568 nm处的吸光度值作为纵坐标绘制标准曲线,根据标准曲线计算出待测外泌体的浓度(见图2)。结果显示,缺氧0,12,24 h干预条件下,所得的20 ml细胞上清培养液分别提取的外泌体蛋白浓度约为(3.22±0.22)mg/ml,(3.24±0.22)mg/ml和(3.86±0.18)mg/ml。缺氧干预24 h所得的外泌体蛋白含量明显高于缺氧干预0 h及12 h,差异有统计学意义(P=0.009,0.01),然而,缺氧0 h与缺氧干预12 h相比,产生的外泌体蛋白含量之间的差异无统计学意义(P=0.939)。

图2 BCA标准曲线检测外泌体蛋白浓度Figure 2 The protein concentration of exosome detected by BCA standard curve
2.3 缺氧诱导巨噬细胞外泌体的标记蛋白表达
CD63、HSP70在各种细胞的外泌体中均有表达,是外泌体特征性的标记蛋白,而Histone作为外泌体的阴性对照蛋白。本研究经Western blot分析显示,缺氧干预巨噬细胞分泌的外泌体中存在HSP70、CD63蛋白表达(见图3),而Histone蛋白无表达。缺氧0 h与缺氧12 h相比,HSP70蛋白水平的表达无差异(P=0.451),相反,缺氧24 h诱导巨噬细胞分泌的外泌体中HSP70蛋白水平均明显高于其他两组(P分别为0.007,0.018);此外,缺氧12 h和缺氧24 h诱导巨噬细胞产生的外泌体中CD63蛋白水平均显著高于缺氧0 h(P分别为0.02,0.001),并且随着缺氧干预时间延长,CD63蛋白水平明显增加(P=0.042)。综上得出,缺氧干预24 h诱导巨噬细胞产生的外泌体含量最高,因此,后续的透射电镜及NTA实验进一步分析了缺氧诱导干预24 h产生外泌体的形态特征。
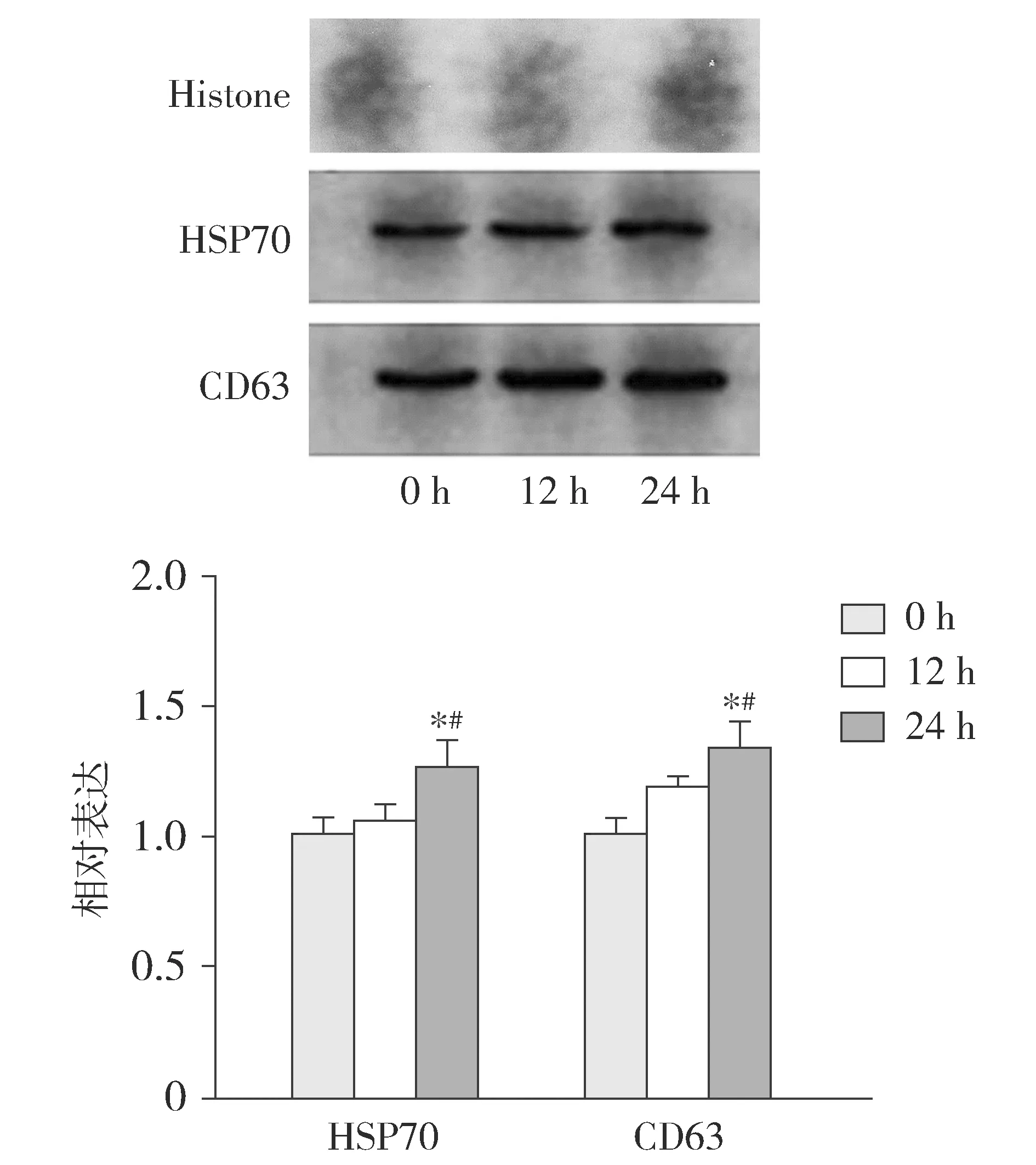
与缺氧0 h组相比,*P<0.05;与缺氧12 h组相比,#P<0.05图3 外泌体中HSP70、CD63、Histone蛋白水平随时间的变化Figure 3 The protein levels of HSP70, CD63 and Histone in exosome over time
2.4 缺氧诱导巨噬细胞分泌外泌体的形态特征表现
透射电子显微镜结果显示,缺氧诱导巨噬细胞分泌的外泌体呈形态均一的类圆形,表面有完整的双层模型结构,其内部含有低密度物质,多呈单个散状分布(见图4A)。采用NTA检测系统进一步分析外泌体颗粒的粒径大小,结果显示,外泌体的粒径集中在(150±44)nm,大多数外泌体颗粒的粒径集中在154 nm左右(见图4B)。

A.外泌体在透射电镜下呈现双膜结构 (×60 000)B.NTA检测外泌体颗粒的粒径大小图4 外泌体的形态特征Figure 4 Morphological characteristics of exosome
3 讨论
巨噬细胞主要来源于单核细胞系统,是人体免疫系统的关键组分,通过吞噬作用识别和清除细菌、真菌和病毒等入侵病原体及调节血管生成,维持机体内稳态[3,9,10]。当机体受到某种慢性损伤等因素刺激时,这种内稳态环境被破坏,从而导致许多疾病发生。缺氧就是其中的一种损伤,主要存在于炎症及肿瘤组织中。研究证明,当巨噬细胞在体外经历缺氧时,能够促使VEGF、TNF-α、IL-8等基因表达上调,进而发挥促炎、促血管生成、诱导细胞凋亡及招募更多的巨噬细胞或炎症细胞等生物学作用[3]。巨噬细胞活化后释放的外泌体,如miRNA等,被受体细胞接收后,可以介导许多炎症相关性疾病及肿瘤的发生。如溶血卵磷脂刺激巨噬细胞来源的外泌体能够显著增加心脏成纤维细胞的增殖、迁移和分化能力[11]。当巨噬细胞受到肿瘤坏死因子样弱凋亡诱导因子(tumor necrosis factor-like weak inducer of apoptosis)刺激后产生的外泌体能抑制卵巢癌细胞的侵袭和迁移[12]。多项研究显示,脂肪组织巨噬细胞来源的外泌体可以调节胰岛素抵抗[13-15]。巨噬细胞来源的外泌体miR-223通过靶向激活PI3K/AKT信号通路促进胃癌细胞发生侵袭和转移[16]。此外,另一项研究显示,缺氧诱导的巨噬细胞上清液通过VEGF促进胃癌细胞的增殖和侵袭[17],考虑到此细胞上清液为外泌体提取的前体物质,可推测出该上清液的促肿瘤作用可能也是通过外泌体的作用实现。
本研究采用缺氧干预巨噬细胞,收集培养上清液后,采用外泌体提取试剂盒分离提取外泌体。目前对于外泌体的鉴定方法主要有蛋白免疫印迹分析外泌体特异性蛋白分子、透射电子显微镜观察外泌体形态及外泌体粒径测定等[18]。一般用高尔基标记蛋白GM130、内质网标记蛋白Calnexin及细胞核标记蛋白Histone等特定细胞器蛋白作为鉴定外泌体蛋白表达的阴性对照。本研究得出,相比缺氧0 h及12 h,缺氧干预24 h后所获得的外泌体蛋白含量较高,能满足后续实验的需求。
与常氧条件相比,缺氧能有效促进外泌体的标记蛋白HSP70、CD63表达,而Histone阴性对照蛋白无表达,相比缺氧干预12 h,缺氧干预24 h的外泌体蛋白分子含量更高,差异有统计学意义。因此,后续实验采用缺氧干预24 h为目标时间进行形态学分析,进一步采用透射电子显微镜观察外泌体的形态特征。结果显示,外泌体呈形态均一的类圆形,表面有完整的双层模型结构,多呈单个散状分布;采用NTA检测系统分析出大多数外泌体颗粒的粒径集中在154 nm左右。该研究显示,缺氧能够诱导巨噬细胞产生外泌体,符合外泌体的粒径范围[4]。证实采用试剂盒提取的外泌体纯度较高,能将外泌体提取完全,能够满足后续实验的要求。通过以上结果进一步证实了缺氧干预的巨噬细胞具有分泌外泌体的功能,为后续进一步研究外泌体的生物学作用奠定基础。
本研究采用缺氧干预巨噬细胞,利用试剂盒方法成功从细胞培养上清液中分离提取出外泌体,通过检测其特异性标志蛋白及形态学分析显示提取的外泌体含量及纯度较高,为后续研究缺氧诱导巨噬细胞来源的外泌体在消化道炎症性疾病及肿瘤等病变中的生物学作用奠定了实验基础,保证今后相关实验的顺利开展。

