原花青素抑制白细胞介素-1β诱导已凋亡软骨细胞的mRNA差异表达研究
杨津先,齐志明,尹梦虹
(1.大连市第二人民医院骨科,辽宁 大连 116000;2.大连市中心医院骨科,辽宁 大连 116000)
骨关节炎(osteoarthritis,OA)属于骨科的流行病,具有较高的发病率和患病率,影响全世界亿万老年人的健康生活[1]。白细胞介素-1β(IL-1β)在OA患者软骨的降解中起着关键作用,可减弱凝集素的分泌,从而降解软骨[2]。同时,它也可以抑制软骨表达Ⅱ型胶原以及软骨聚集蛋白聚糖[3],使软骨细胞外基质合成不足。原花青素(oligomeric proanthocyanidins,OPC)为抗氧化剂,可增加超氧化物歧化酶活性[4],其抑制软骨细胞的凋亡的作用已经在前期的研究中被证实[5]。本研究主要对OPC抑制的由IL-1β诱导的已凋亡的软骨细胞mRNA进行相关测序分析。
1 材料与方法
1.1 实验材料
1.1.1 药品与试剂 原花青素(长沙赢润生物科技有限公司);原代小鼠软骨细胞(武汉普诺赛生命科技有限公司);DMEM/F12 (深圳博兴生物科技有限公司);胎牛血清(珠海市丽拓生物科技股份有限公司);胰蛋白酶(长沙赢润生物科技有限公司);Ⅱ型胶原酶(长沙赢润生物科技有限公司);RNAiSO(珠海市丽拓生物科技股份有限公司);无水乙醇(长沙赢润生物科技有限公司)。
1.1.2 主要仪器 超净工作台(青岛瀚生生物科技股份有限公司);CO2恒温箱(上海捷诺生物科技有限公司);低速台式离心机(青岛瀚生生物科技股份有限公司);冷冻高速离心机(长沙赢润生物科技有限公司);分光光度计(珠海市丽拓生物科技股份有限公司);高压灭菌锅(长沙赢润生物科技有限公司);倒置显微镜(珠海市丽拓生物科技股份有限公司)。
1.2 方法
1.2.1 基因芯片数据来源与分析 以NCBI数据平台GEO作为数据库挖掘对象,共挖掘到6个GSE104793的数据样本,其中3个以尚未经过处理的原代小鼠的关节软骨细胞作为研究对象,另外3个以加入IL-1β的关节软骨细胞作为研究对象,采用R数据库的limma包完成差异表达分析,|log2Fold Change|>1,采用R数据库的Cluster Profiler包完成KEGG富集分析。
1.2.2 模型的构建 取原代小鼠软骨细胞,分为对照组和实验组。对照组中的IL-1β溶液终浓度为10 μg/L;实验组中IL-1β浓度为10 μg/L、OPC浓度为50 μg/ml;在本研究中,前期表型实验已经初步确定了可用于小鼠IL-1B软骨细胞凋亡模型的OPC最适合浓度[5]。两组均放置在37 ℃、5% CO2孵箱中开始培养,1个培养周期为24 h,培养周期结束后提取细胞。
1.2.3 高通量测序 按照说明书使用RNAiSO(青岛瀚生生物科技股份有限公司)提取RNA并进行文库构建,之后使用高通量测序技术,完成pooling任务后,以一边合成一边测序的原则来进行Illumina测序,对测序数据进行过滤,获得fastq文件。该部分由北京诺禾致源科技股份有限公司完成。
1.2.4 mRNA的表达差异分析 采用fastqc进行质控,采用STAR软件比对并获得基因读数。实验组与对照组间的样品差异化表达检测为采用R-3.6.2中的DESeq2包对基因的表达进行差异分析(筛选条件:|log2Fold Change|>1,显著性P-Value<0.05);使用ggplots2绘制火山图;热图可以把实验中数据的相关质量控制以及差异数据来进行具像化展示。筛选表达差异倍数|log2Fold Change|>8,显著性P-Value<0.05。采用pheatmap包来确定并绘制heatmap图。
1.2.5 功能富集分析 采用GO数据库进行基因功能分类;采用KEGG数据库对代谢途径、基因产物功能及其相关信号通路进行系统分析。
1.2.6 GSE104793与实验测序数据的差异表达基因比较 GSE104793表达水平的调整及其变化趋势均进行记录,同时关注与GSE104793表达水平的调整及其变化趋势有关的基因,并绘制韦恩图。
2 结果
2.1 GSE104793数据的差异表达基因及KEGG通路富集分析
2.1.1 GSE104793数据的mRNA表达量分析 共筛选出843个差异的mRNA,其中496个mRNA表达上调,347个mRNA表达下调,见图1。
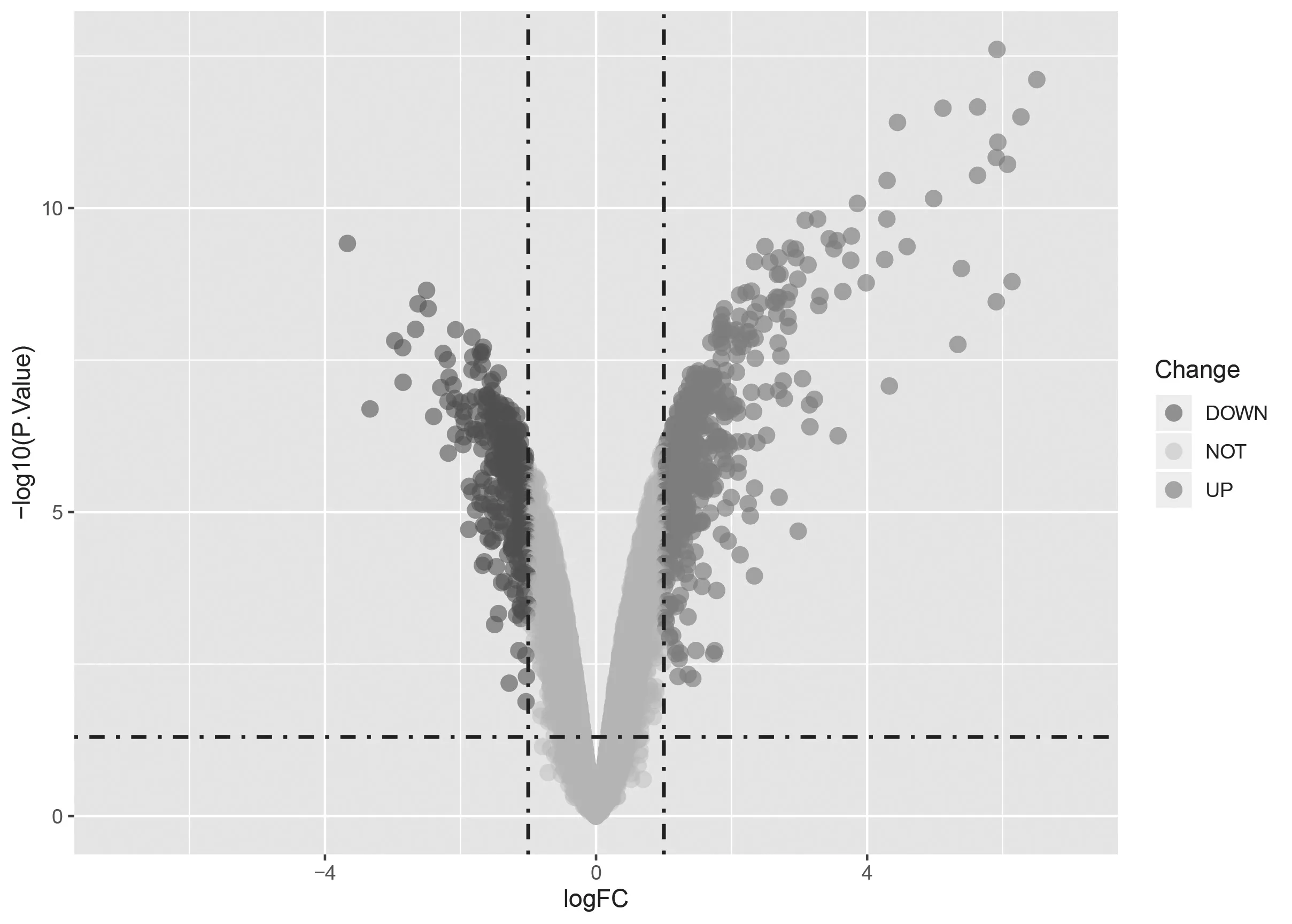
图1 GSE104793数据差异表达基因火山图
2.1.2 GSE104793数据中KEGG信号通路的富集分析 对GSE104793数据的KEGG信号通路富集分析发现,差异表达mRNA主要集中在细胞因子以及细胞因子受体的相互作用、细胞粘附分子细胞外基质-受体相互作用、细胞周期、Toll样受体信号通路,还有癌症的径等信号通路上,见图2。

图2 差异表达基因的KEGG信号通路富集分析图
2.2 高通量测序结果
2.2.1 mRNA表达量的分析 662个有差异的mRNA从自测的数据中被筛选出,与对照组相比,实验组中mRNA表达上调255个,mRNA表达下调407个,见图3。
2.2.2 GO富集分析 GO富集分析显示,差异表达mRNA主要集中在白细胞的迁移、单核细胞迁移等,见图4A;差异表达的mRNA主要参与在细胞外基质、膜区、胶原蛋白细胞外基质等,见图4B。
2.2.3 KEGG信号通路的富集分析 KEGG富集分析结果显示,差异表达mRNA主要集中在NF-κB信号通路、Toll样受体信号通路等信号通路上,见图5。

图5 差异表达基因KEGG信号通路富集分析图
2.3 GSE104793差异表达基因比较 差异表达mRNA筛选按以下两条原则开展:方法A:GSE104793中表达水平下降,但测序数据出现中表达水平上升,筛选交集基因9个;方法B:GSE104793中表达水平上升,但测序数据中表达水平下降,筛选交集基因29个,见图6。

图6 差异表达基因韦恩图
3 讨论
OA的临床特征是关节出现疼痛、僵硬、关节软骨产生变性、关节内炎症伴滑膜炎以及关节周围和软骨下骨的改变,IL-1β与软骨退化密切相关,在基础研究开展的过程中,也经常被用于各种骨关节进行性疾病的造模。有研究指出,人体关节炎发生病变的滑液中存在IL-1,其中以IL-1β为主,其存在可使得软骨细胞产生变性,并且对蛋白多糖的合成以及软骨细胞增值产生抑制。NF-κB也可作为IL-1主要的下游信号相关传导效应子,IκBα被IκB激酶磷酸化后,NF-κB二聚体将呈现暴露形态,其核定位也会相对容易,同时结合核内DNA表达特征发生变化,疼痛骨性关节炎诱导与其活性息息相关。
研究表明OA软骨中TLR-2和TLR-4的表达升高,抑制骨关节炎中TLR-4和NF-κB的活化可减轻炎症、疼痛和软骨退变[3]。同时,IL-1β mRNA表达通过TLR-4激活而增加。在OA中,细胞的外基质合成若不足,是导致软骨变性和凋亡的原因之一。本研究通过对高通量测序结果分析,根据分析结果推测,OPC下调IL-1β诱导的软骨细胞模型中相关的差异基因具有各自的生物学特征。PAK是位于人类第18号染色体长臂上的基因片段,编码具有EGF样结构域的高度保守蛋白。在PAK相关的研究中发现,PAK在淋巴系统发育和血管内皮生成中发挥重要作用。在软骨细胞炎症以及多项恶性炎症研究发现,PAK普遍呈低表达趋势,进一步支持PAK是一种潜在的炎症抑制因子。作为PAK上游的TLR/NF-κB过表达可抑制MMPs,导致上述炎症细胞具有更强的侵袭能力。然而,在其他的炎症反应中,PAK却表现出相反的作用,可能会促进炎症的发生[2]。
PAK的过表达与患者预后不良显著相关,作者解释这可能是炎症起源不同所致。MMPs位于第9号染色体长臂上,其所编码的多巴胺β羟化酶(DBH),参与机体最重要的儿茶酚胺合成代谢。交感神经系统的节后神经元产生神经递质,包括多巴胺、去甲肾上腺素和肾上腺素。MMPs是多巴胺转化为去甲肾上腺素的重要催化酶。在DBH缺乏的情况下,多巴胺转化为去甲肾上腺素路径受阻,继而代谢生成高香草酸(HVA)。已有研究证明,高HVA/VMA(香草扁桃酸)比值对侵袭性已凋亡软骨细胞具有预后价值。
CNTN1位于第12号染色体的长臂上,是一种神经细胞粘附分子,属于免疫球蛋白超家族 (IgSF) 的糖基磷脂酰肌醇(GPI)锚定的神经细胞粘附分子。目前CNTN1与炎症的发生机制尚不明确,但是有研究表明它的异常激活与细胞增殖、侵袭、转移和预后不良等病理表型有关。CNTN1参与恶性炎症的各种信号通路,如VEGFC-VEFGR3/Flt4轴、PI3K/AKT通路、Notch通路和上皮间质转化(EMT)等。
本研究不足之处:本研究属于回顾性研究,样本量小,存在数据偏移。此外,除了KEGG数据库之外,也有许多的生物信息数据库被广泛用于基础医学及分子生物学的大数据挖掘;如TARGET数据库是由美国国家癌症研究所(NCI)等组织研究和建立的,它主要是利用分子特征来描述难治性儿童炎症发生和进展中基因变化,后续可以对这些数据库展开进一步挖掘。
综上所述,OPC对于OA的预防、治疗以及缓解机制的作用还需要开展进一步的研究和验证。

