胶东地区设施栽培奥尼尔和米斯蒂蓝莓花色苷代谢研究
刘笑宏,张丽丽,王春燕,慈志娟,于海军,李公存,顾亮,赵玲玲
(1.山东省烟台市农业科学研究院,山东 烟台 265500;2.中华全国供销合作总社济南果品研究所,山东 济南 250000;3.海阳市果业发展服务中心,山东 海阳 265100)
蓝莓是我国主要生态经济林浆果,营养物质含量丰富,风味独特,被评为“人类五大健康食品之一”[1],列入世界第3代水果行列[2]。花色苷是蓝莓重要的品质性状,其生物合成受内部因素(合成途径关键酶活性及相关基因表达量等)和外界环境因子(温度、空气湿度、光照等)的共同影响[3-5]。研究表明,苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)是花色苷合成过程的起始酶,起限速作用;查耳酮合酶(chalcone synthase,CHS)可催化生成柚皮素查尔酮;查耳酮异构酶(chalcone isomerase,CHI)可显著提高花色苷合成速率;黄烷酮3-羟化酶(flavanone 3-hydroxylase,F3H)是花色苷合成途径的中枢酶;二氢黄酮醇4-还原酶(dihydroflavonol 4-reductase,DFR)对花色苷积累起限制因素;花色素合成酶(anthocyanidin synthase,ANS)是花色苷合成和原花青素合成枢纽的关键酶,决定花色苷合成途径的走向;类黄酮糖基转移酶(UDP-glucoseflavonoid 3-O-glucosyltransferase,UFGT)是花色苷合成的最终作用酶;糖苷水解酶(glycoside hydrolases,GLH)和多酚氧化酶(polyphenol oxidase,PPO)对花色苷的分解氧化起重要作用[6-10]。基因是决定酶活性的关键因素,环境因素则通过影响酶活性影响花色苷的最终合成。环境因素中,光照是花色苷合成的重要前提[11,12],适量光照可有效提高花色苷的合成量,而强光则会降低花色苷的含量[13];温度是影响花色苷代谢的第二因素[14,15],高温能降解花色苷[16,17],低温则抑制花色苷的合成[18];空气湿度对花色苷的积累同样重要,较高的空气相对湿度可降低蒸腾速率、提高光合产物积累,从而为花色苷代谢提供充足的合成底物[19,20]。
胶东半岛气候温暖湿润,是我国重要的蓝莓生产区[21],传统以栽植北高丛蓝莓为主。近年来,南高丛蓝莓由于品质优、适应性强、丰产性高等特点,被大规模引种,但因花期较早,易受霜冻危害,在胶东地区较为适合设施栽培。奥尼尔和米斯蒂均为引入的优良南高丛蓝莓品种,奥尼尔果个大、香气浓郁,米斯蒂有特殊香气,均深受消费者喜爱,表现出较高的商品价值。但引种后生长环境的改变容易导致蓝莓果实中营养物质成分及含量变化,从而对其品质造成一定影响。花色苷作为蓝莓的主要活性物质,其含量改变明显影响蓝莓果实品质,因此,了解生长环境条件对花色苷积累和代谢的影响对于改善蓝莓品质具有重要意义。
本试验以胶东地区设施栽培的奥尼尔和米斯蒂两个品种蓝莓为研究对象,分析转色期各阶段花色苷积累及代谢途径相关酶基因表达的情况,并探究设施环境因子对花色苷积累的影响,以期为蓝莓花色苷代谢研究及生产管理提供理论依据。
1 材料与方法
1.1 试验地概况
试验于2021年在山东省烟台市福山区蓝莓生产基地进行。福山区位于胶东半岛北部,属暖温带东亚季风区大陆性气候,夏季温暖湿润,冬季寒冷干燥,年平均降水729.2 mm,平均气温11.8℃,平均日照2672.2 h,空气相对湿度65%,适合蓝莓生长发育。
1.2 试验材料
供试蓝莓品种为奥尼尔和米斯蒂,均于2017年定植于东西向暖棚内,供试品种南北向种植,株距0.8 m,行距1.8 m,栽培管理措施一致。每个小区由4个种植行组成,按种植行从东到西、植株从南到北的次序,每一种植行顺次选择5株蓝莓(即第一行的5株在种植行的南边、第二行5株接着第一行的次序向北数、第三行和第四行顺次进行),共计20株设置为一小区,重复3次,总计60株。
1.3 试验方法
1.3.1 环境因子测定 于果实转色前每小区中间部位放置两个温湿度及光照记录仪,悬挂于植株中部外测5~10 cm处,待果实总体转色完成后取下记录仪,数据用于设施环境因子分析。
1.3.2 蓝莓果实样品采集 根据试验区内蓝莓果实总体转色情况,分别于转色初期、花盘转色期、转色中期、转色后期、转色完成期采摘果实样品,每个品种每小区采集50粒,带回实验室后液氮冷冻,存于-80℃冰箱供相关指标测定。转色期各阶段果实采集标准见图1。
图1 试验材料采收标准
1.3.3 花色苷含量及其代谢相关基因表达量测定 蓝莓果实花色苷含量参照张美娇等[22]的方法测定。总RNA提取参照郑嘉伟等[23]的方法,利用北京康为试剂公司的UltraSYBR Mixture进行qRT-PCR检测,相关基因表达量检测引物序列如表1所示。基因相对表达量数据均以各品种转色初期的表达量为对照。

表1 蓝莓花色苷代谢相关基因表达量检测的引物及序列
1.4 数据处理与统计分析
采用Microsoft Excel 2010对数据进行处理及作图,采用DPS 7.05进行方差分析(P<0.05)。
2 结果与分析
2.1 两种蓝莓果实转色期花色苷含量变化动态
由图2可见,奥尼尔的花色苷总量在转色初期至花盘转色期均较低,变化不显著;转色中期始花色苷快速积累,含量增加显著,为花盘转色期的5.30倍;转色后期花色苷含量为转色中期的3.38倍,至转色完成期,花色苷含量达5.95 mg/kg,比转色后期显著提升30.86%。米斯蒂的花色苷快速积累期稍有延后,转色中期前积累很少,含量变化不显著;转色后期花色苷快速积累至3.00 mg/kg,为转色中期的8.82倍,至转色完成期花色苷含量达到5.03 mg/kg。由此可见,奥尼尔的花色苷快速积累期在花盘转色期至转色后期,米斯蒂的快速积累期则在转色中期至转色后期;奥尼尔的花色苷快速积累持续时间更长,转色完成时,花色苷含量也更高。
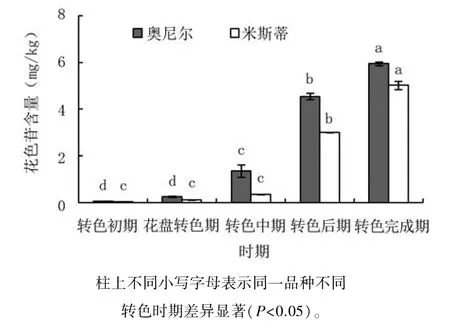
图2 两种蓝莓果实转色期花色苷含量变化动态
2.2 两种蓝莓果实转色期花色苷代谢途径相关基因表达量变化
2.2.1 奥尼尔的相关基因表达量变化 对奥尼尔花色苷代谢途径相关基因不同时期表达量分析可见(图3),花色苷合成基因VcPAL、VcCHS、Vc-CHI、VcANS、VcUFGT表达量在整个测定期呈现上升趋势,转色中期表达量骤升为花盘转色期的2.77~3.63倍,其中,VcPAL、VcCHS、VcANS和VcUFGT表达量在转色后期至转色完成期依旧显著上升,即合成酶继续发挥合成作用。VcF3H和VcDFR表达量呈现先上升后下降的趋势,其中,VcF3H在转色后期表达量最高,转色完成期表达量显著下降至转色后期的45.32%;VcDFR表达量则在转色中期达最高峰,转色后期至转色完成期表达量分别显著下降4.59%、20.51%。氧化酶基因VcGLH和VcPPO表达量在整个转色期均较低,呈现转色初期较高、之后下降、转色完成期再显著回升的趋势,其中,VcGLH表达量在花盘转色期比转色初期显著下降79.39%,花盘转色期至转色后期无显著变化,转色完成期显著提升至转色后期的2.08倍;VcPPO的表达量在转色初期至花盘转色期有所降低,但差异不显著,转色中期显著下降52.32%,转色后期与转色中期水平相当,转色完成期骤升至转色后期的6.83倍。
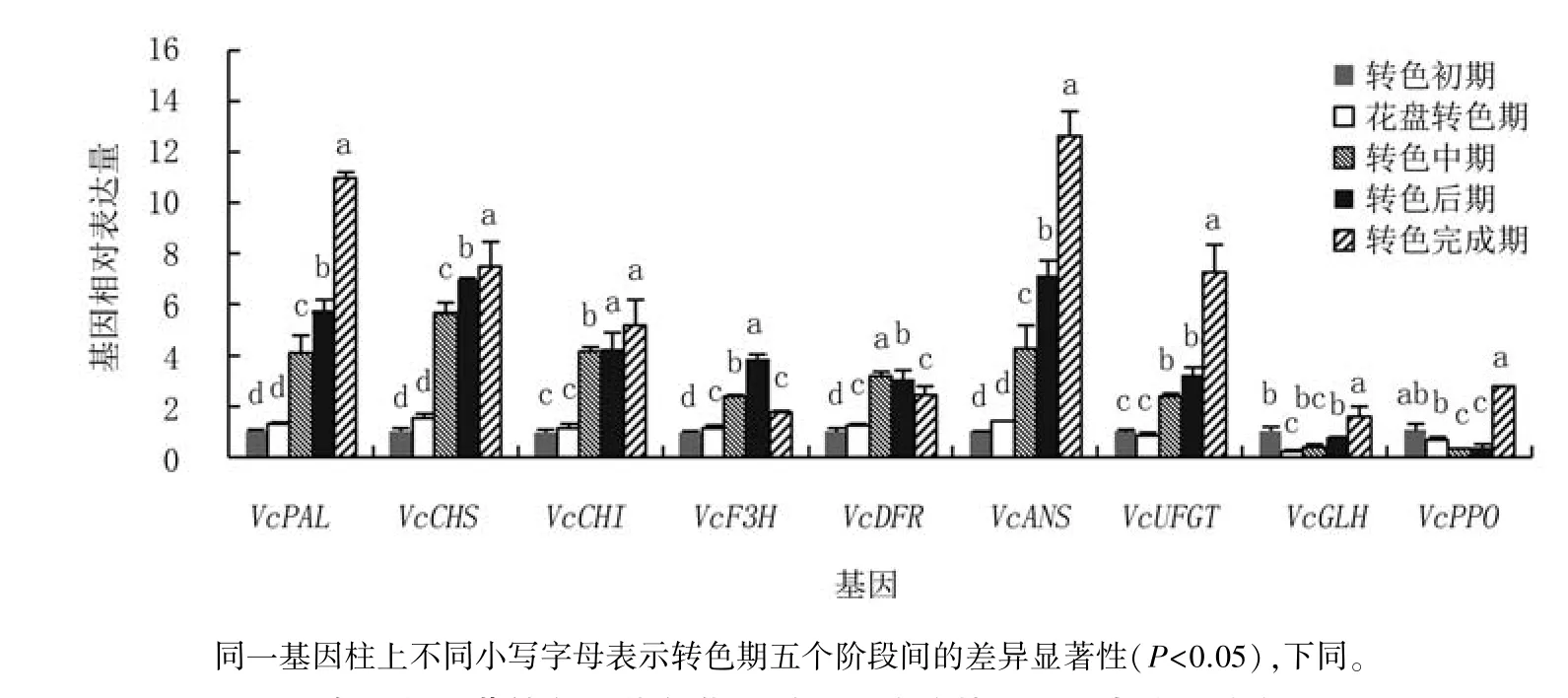
图3 奥尼尔蓝莓转色期花色苷代谢相关酶的基因相对表达量动态分析
可 见,奥 尼 尔 的VcPAL、VcCHS、VcCHI、VcANS、VcUFGT等合成酶基因在果实转色期持续发挥作用,且表达量较高,而氧化酶基因VcGLH、VcPPO在整个转色期表达量均较低,尤其合成酶基因表达高峰期极低,这更利于果实花色苷的合成与积累。
2.2.2 米斯蒂的相关基因表达量变化 对米斯蒂花色苷代谢途径相关基因不同时期表达量分析可见(图4),VcPAL、VcCHS、VcCHI、VcF3H、VcDFR的基因表达量均呈现先上升后下降的趋势,转色中后期表达量骤升,转色后期表达量最高,而VcUFGT仅在转色后期表达量骤升;至转色完成期上述基因的表达量又显著下降82.00%~91.30%,与花盘转色期的表达量相当。VcANS的表达量在花盘转色期显著升高至转色初期的8.25倍,之后表达量无显著变化。VcGLH和VcPPO相较于其他基因,表达量一直处于较低水平。
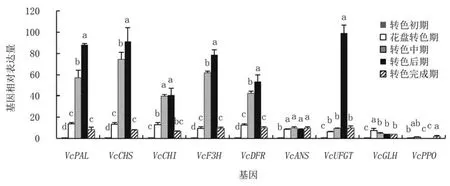
图4 米斯蒂蓝莓花色苷代谢相关基因相对表达量动态分析
由此可见,米斯蒂各基因的表达趋势一致性较强,且调控花色苷合成的基因表达高峰出现在转色中期和转色后期,以转色后期表达量更高,转色完成时,各基因的相对表达量与花盘转色期水平相当,但VcANS的相对表达量在花盘转色期上升后,一直保持在转色初期的17倍左右。
2.3 果实微环境对花色苷积累的影响
2.3.1 光照 从转色期光照强度(图5)来看,4月11日至21日设施大棚内的光照强度主要集中在20~40 klx,最强光照为40~60 klx,最高达65.25 klx,此时大部分蓝莓果实处于转色初期;4月22日至25日光照强度显著下降,大多在10 klx左右,最大光照强度为46.40 klx;4月26日至5月1日光照强度波动较大,主要分布在10~40 klx,但出现超过60 klx的强光照天气数增多,即转色中后期光照强度相对较强。
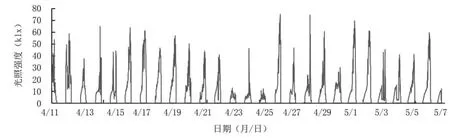
图5 蓝莓果实转色期光照强度动态分析
2.3.2 气温 由图6可见,4月11日至21日,设施内气温相对稳定,大部分维持在15~35℃,温差较小;4月26日以后,棚内温差较大,气温波动较大,35℃以上高温和10℃以下低温同日出现,甚至出现5℃以下低温。即蓝莓花盘转色期棚内温差较小,转色中后期温度相对稳定,后期昼夜温差增大,促进花色苷合成与积累。由日平均温度曲线可见,设施内日平均温度维持在15~25℃,前期维持在20~25℃,后期降至15~20℃。
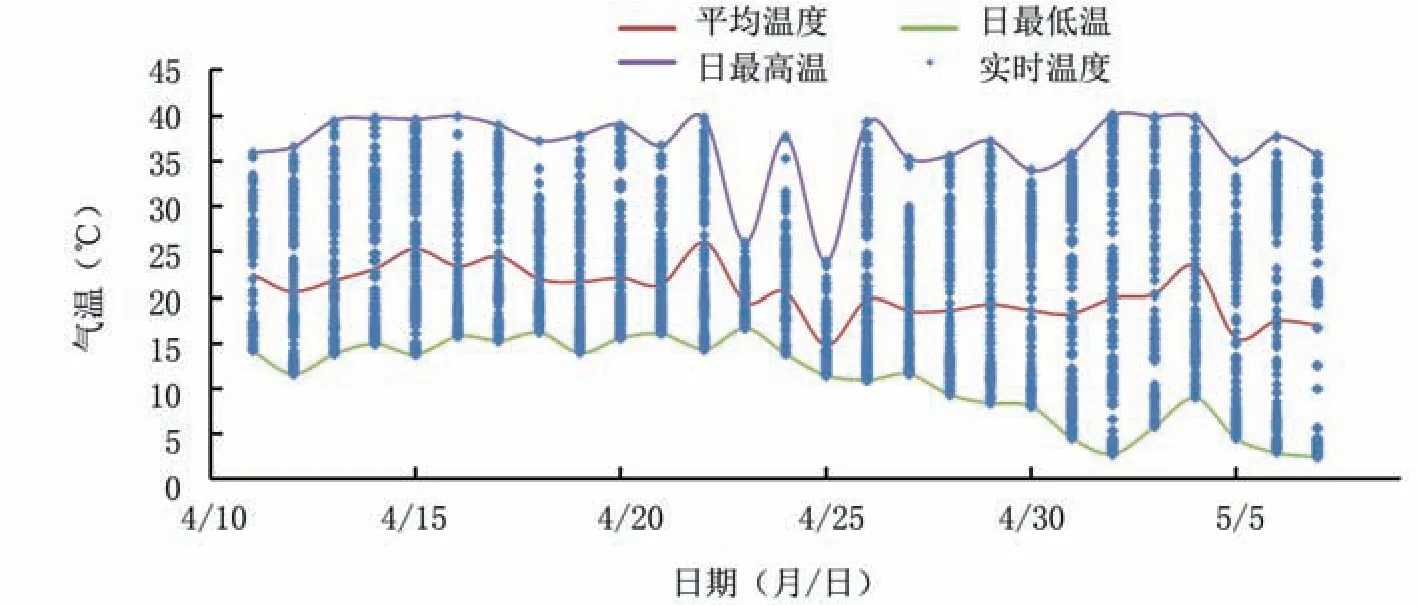
图6 蓝莓果实转色期气温变化动态
2.3.3 空气湿度 从图7来看,设施内空气湿度大部分在10%以上,4月25日左右湿度全天较高,维持在50%以上,即果实转色中期生长环境湿度较大,这有利于减少光合产物消耗及为花色苷代谢提供充分的底物;4月28日以后湿度未达到100%,且10%及以下湿度出现几率增加,5月2日至4日湿度波动范围较小,最高湿度在70%左右。
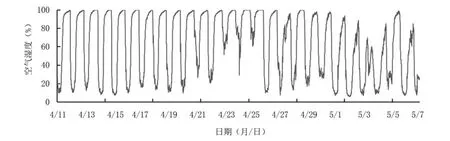
图7 蓝莓果实转色期空气湿度变化动态
综合气象数据可见,棚内前期光照较弱、平均气温较高且温差较小、空气湿度较大,适宜果实营养物质的积累,以便为花色苷合成提供充分的底物;后期光照相对较强,平均温度较低、温差较大、湿度较小、光照较强,加之前期的底物累积,更利于果实花色苷合成。
3 讨论与结论
品种是影响花色苷含量的重要因素,直接决定花色苷基因型[24]。本试验结果表明,引种的南高丛蓝莓品种奥尼尔和米斯蒂在胶东地区设施栽培时的花色苷积累规律不同,奥尼尔的花色苷合成呈稳定增长模式,而米斯蒂的花色苷合成属于激增式。奥尼尔花色苷代谢相关基因中,前端合成基因VcPAL、VcCHS、VcCHI及后端合成基因VcANS、VcUFGT的相对表达量在果实转色前期至后期逐步升高,且在转色后期至转色完成期的基因表达量增幅较高,合成中端基因VcF3H和VcDFR表达量先升高再降低,VcGLH、VcPPO表达量先降低再升高,这与花色苷在转色中期开始大量累积趋势一致。米斯蒂花色苷合成相关基因表达量在转色前期和花盘转色期均较为平稳,转色中期至转色后期表达量激增,之后又断崖式下跌,这与花色苷含量在转色后期大量积累的规律一致。两个蓝莓品种花色苷代谢相关基因表达量的差异可能是由品种差异造成的,也可能是由于不同品种的基因表达对外界因素如温度、湿度及光照等的响应不同[25]。通过对蓝莓生长环境的气温、湿度及光照强度分析可见,花色苷合成的不同阶段其外界条件不同,前期棚内日平均气温较高、温差较小、湿度较大、光照强度相对较低,可能更适合奥尼尔花色苷相关基因的表达;而中后期,棚内日平均温度下降、温差较大、湿度下降、光照强度增大,可能更适合米斯蒂花色苷相关基因的表达。
综合上述分析,米斯蒂的花色苷基因表达高峰期稍晚,集中表达特点更为显著,但奥尼尔花色苷总量在整个转色过程中均高于米斯蒂。造成这种差异的原因首先可能是品种间差异,其次可能是米斯蒂合成途径中的VcANS表达量相对较低,限制了花色苷的合成[26]。

