不同浓度游离脂肪酸对HA-VSMC增殖活性的影响*
杨兴文,马小芳,李德红,颜 丽,袁秀梅,杨晓燕,杨 阳,司玉春
1.甘肃省人民医院检验中心,甘肃兰州 730000;2.兰州大学第一医院麻醉手术科,甘肃兰州 730000
游离脂肪酸(FFA)又称非酯化脂肪酸,大部分FFA与清蛋白结合存在于血液中,正常情况下血清FFA含量很少。血清中FFA水平与脂类代谢、糖代谢、内分泌功能有关。在某些病理状态(如糖尿病、代谢综合征和脂代谢紊乱)下,血清FFA水平升高。过高的FFA水平引起的高FFA血症与代谢综合征、动脉粥样硬化、急性冠脉综合征、心力衰竭等疾病的发生和发展显著相关[1]。FFA是导致氧化应激的物质之一[2],其水平升高引起的氧化应激是心血管疾病尤其是糖尿病大血管病变的主要原因。有研究发现,FFA通过多种途径诱导血管内皮细胞功能紊乱和血管平滑肌细胞(VSMC)增生,促进血管疾病的发生发展[3-4]。本研究通过培养的人主动脉血管平滑肌细胞(HA-VSMC),了解不同浓度FFA和不同作用时间对HA-VSMC增殖活性的影响。
1 材料与方法
1.1材料来源 正常HA-VSMC购买自美国ATCC细胞库;胎牛血清购买自杭州四季青生物公司;DMEM培养基、棕榈酸和MTT试剂购买自美国Sigma公司;0.25%胰蛋白酶和磷酸盐缓冲液(PBS)购买自北京索莱宝生物公司;无游离脂肪酸胎牛血清清蛋白购买自上海生工生物公司;5-乙炔基-2′脱氧尿嘧啶核苷(EdU)荧光染色试剂盒购买自广州锐博生物公司;DMSO购买自碧云天生物公司。Thermo®RMK3型酶标仪购买自上海普林斯顿生物科技发展有限公司;RIX71-A12FL/PH型荧光倒置显微镜购买自日本Olympus公司。
1.2方法
1.2.1HA-VSMC的体外培养 将HA-VSMC接种于含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基的100 mm细胞培养皿中,于37 ℃、50%CO2饱和湿度条件下培养,根据细胞生长状况每1~2天更换培养液1次,当细胞在对数生长期时,用于实验。
1.2.2MTT法检测细胞存活率 (1)0.25%胰蛋白酶消化对数生长期的HA-VSMC;(2)PBS吹打,收集于15 mL离心管中以1 000 r/min离心5 min;(3)弃去PBS后加入含10%胎牛血清的DMEM培养液吹打成单细胞悬液后细胞计数;(4)以1.4×105个/毫升密度接种于96孔板,空白组只加培养液和DMSO,对照组和实验组加培养液、MTT、DMSO,每组设5个复孔,待细胞贴壁后,在实验组中加含不同浓度FFA(25、50、100、200、300、400、500、600 μmol/L)的DMEM完全培养液孵育24、48 h;(5)每孔加20 μL 5 mg/mL的MTT溶液后继续孵育4 h,弃培养液,每孔加150 μL DMSO,振荡10 min;(6)用酶标仪在490 nm波长处测吸光度(A)值,计算细胞存活率,细胞存活率=(A实验组-A空白组)/(A对照组-A空白组)。以上步骤1~4均在无菌条件下进行。
1.2.3EdU荧光染色法检测细胞增殖活性 (1)96孔板接种和处理细胞同1.2.2所述;(2)每孔加入100 μL 50 μmol/L的EdU培养基孵育2 h,弃培养基;(3)PBS清洗2次,每次5 min;(3)每孔加入50 μL 4%多聚甲醛室温固定30 min,弃固定液;(4)每孔加入50 μL 2 mg/mL甘氨酸,脱色摇床孵育5 min,弃甘氨酸液;(5)每孔加入100 μL渗透剂(0.5%Triton X-100的PBS)渗透10 min;PBS洗1次,5 min;(6)每孔加入100 μL 1×Apollo®488荧光染料避光、室温、孵育30 min后,弃染色反应液;(7)每孔加入100 μL渗透剂(0.5%Triton X-100的PBS)脱色摇床清洗3次,每次10 min,弃渗透剂;(8)每孔加入100 μL甲醇清洗2次,每次5 min;PBS清洗1次,每次5 min;(9)每孔加入100 μL Hoechst33342反应液避光、室温孵育30 min,弃染色反应液;(10)每孔加入100 μL后PBS清洗1~3次后用荧光显微镜(蓝光激发)观察并拍照记录结果。

2 结 果
2.1不同浓度FFA对HA-VSMC形态学的影响 不同浓度FFA对HA-VSMC形态学的影响见图1,100、200和400 μmol/L组较对照组HA-VSMC浓密,紧贴细胞瓶底,细胞间连接紧密且有剂量依赖性;500、600 μmol/L组较对照组HA-VSMC稀疏,开始出现凋亡的形态学改变。
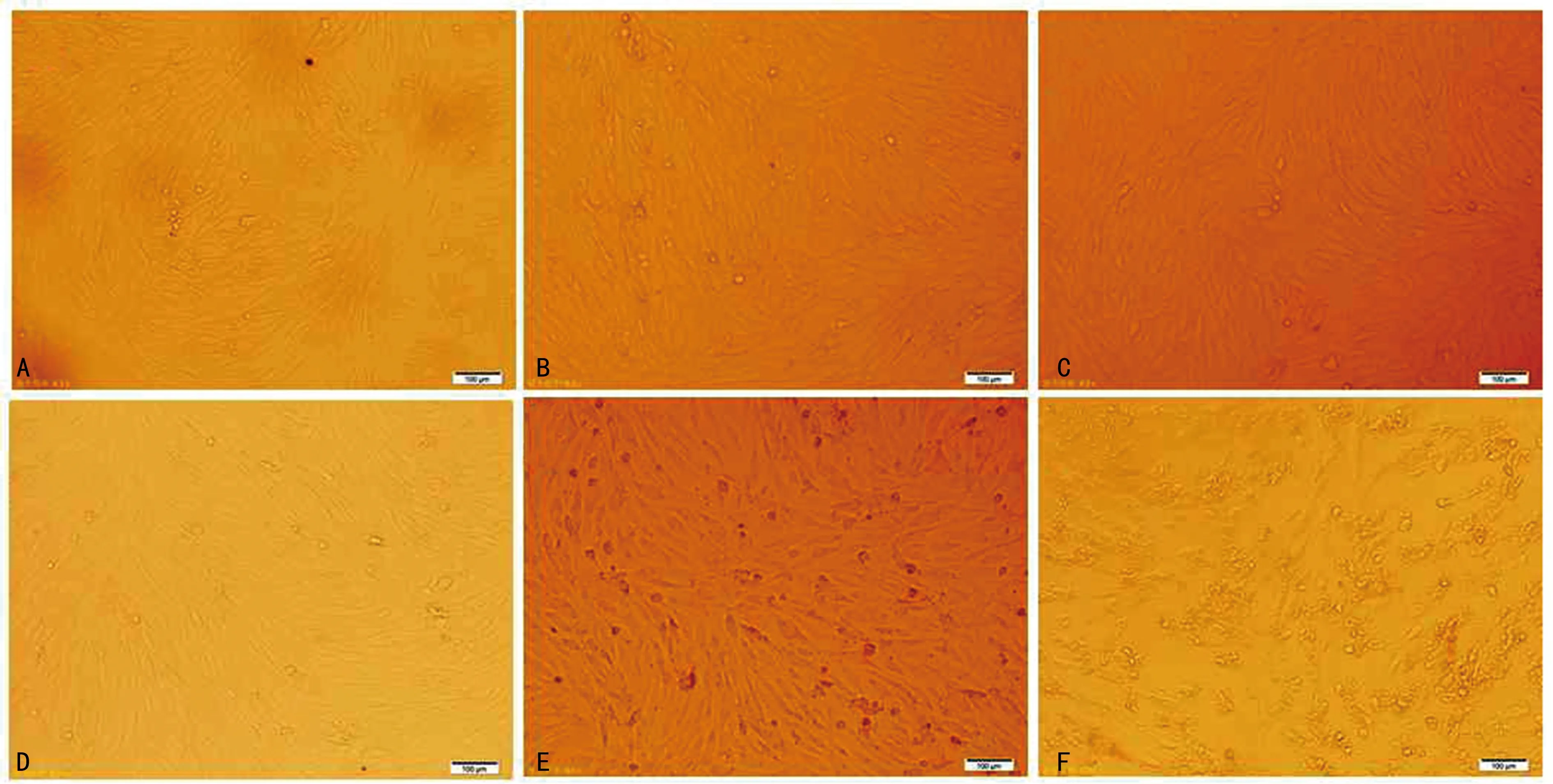
注:A~F分别表示对照组及100、200、400、500、600 μmol/L组HA-VSMC培养48 h形态。
2.2不同浓度FFA处理后HA-VSMC存活率 采用不同浓度FFA处理HA-VSMC 24和48 h后检测细胞存活率,结果显示,处理24 h后,100、200、300、400、500、600 μmol/L组存活率均高于对照组(P<0.01);处理48 h后,50、100、200、300、400、500、600 μmol/L组存活率均高于对照组(P<0.01)。两个时间段400 μmol/L组存活率均最高。见表1。

表1 不同浓度FFA处理后HA-VSMC存活率(%)
2.3EdU荧光染色法检测不同浓度FFA对HA-VSMC增殖活性的影响 EdU荧光染色法结果显示,100、200和400 μmol/L组较对照组HA-VSMC增殖活性明显增强;500和600 μmol/L组较对照组HA-VSMC增殖活性明显减低;各实验组中400 μmol/L组HA-VSMC增殖活性最强。见图2。
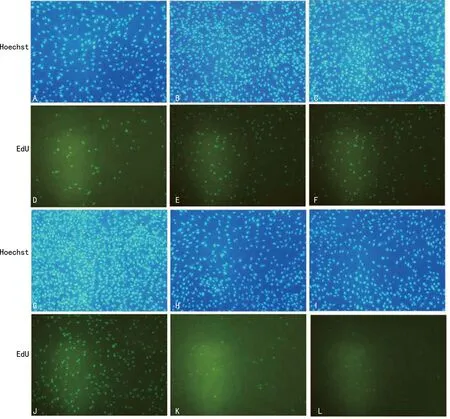
注:A、B、C、G、H、I分别为对照组及100、200、400、500、600 μmol/L组Hoechst染色结果;D、E、F、J、K、L分别为对照组及100、200、400、500、600 μmol/L组EdU染色结果。
3 讨 论
心脑血管疾病已成为危害中国及世界人口健康的“第一杀手”,如何提高心脑血管疾病的诊治和预防水平已成为迫切需要解决的重大医学和社会问题。近年来研究发现,FFA与血管病变的发生、发展紧密相关[5],FFA在诱导血管炎症和动脉粥样硬化中起重要作用,脂代谢紊乱产生大量FFA参与动脉粥样硬化的形成[6-7],2型糖尿病、糖耐量减低、肥胖、代谢综合征等患者血清FFA水平显著升高[8]。FFA水平的升高刺激血管壁细胞发生一系列应答反应,其中引起的内皮细胞活化和VSMC增殖和迁移是最显著的[9]。VSMC开始增殖并朝着血管内腔迁移,从而引起血管壁的增厚及狭窄产生动脉粥样斑块,可导致冠心病及中风等严重临床后果[10]。
本实验采用不同浓度的FFA处理HA-VSMC,尝试在体外建立FFA对血管作用模型,用MTT法和EdU荧光染色法来观察HA-VSMC存活率和增殖活性。MTT法是一种检测细胞存活和生长的方法,其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒,并沉积在细胞中,而死细胞无此功能。EdU是一种胸腺嘧啶核苷类似物,其炔羟基团在天然化合物中很少见,在细胞增殖时能够插入正在复制的DNA分子中,基于EdU与染料的共轭反应可以进行高效快速的细胞增殖检测分析,可以有效地检测处于S期的细胞数。EdU荧光染色法可直接通过DNA复制检测细胞增殖,该方法简单、灵敏、快速、准确,适合各种细胞系和动物体内组织器官的细胞增殖检测,目前在细胞增殖方面的应用逐渐增多[11]。本研究发现,低浓度的FFA(≤400 μmol/L)能诱导HA-VSMC增殖,且有时间和剂量依赖性,随着浓度的增高和时间的延长,细胞增殖活性增强;高浓度的FFA(>500 μmol/L)能使HA-VSMC增殖减弱并出现凋亡的形态改变。
近几十年中,心脏病学家在研究动脉粥样硬化、冠心病机制及冠心病预防的临床试验中发现,多种炎症细胞、炎症介质参与了动脉粥样硬化和血栓形成[10]。研究认为,血管病变是一种慢性炎症反应性疾病。炎症过程中涉及多种因素以不同的形式参与血管疾病的发生、发展[10]。高啸波等[12]也发现,FFA能引起HA-VSMC表达单核细胞趋化蛋白-1(MCP-1),TLR4/核因子(NF)-κB信号通路介导了软脂酸诱导的HA-VSMC的MCP-1基因表达。以上研究结果说明,FFA引起的HA-VSMC增殖可能与FFA引起的血管无菌性炎症有关,这为临床通过抗炎治疗动脉硬化等血管疾病提供了新思路和实验依据,具体机制有待进一步研究。

