hnRNPU基因敲减小鼠preB A70细胞株的构建及鉴定
张岱权,黄黎,金棕杰,唐诗琪,罗佳瑞,李林,赵雷,曹新梅
1.西南医科大学附属医院中医科(泸州646000);2.西南医科大学基础医学院重大疾病的免疫机制及治疗泸州市重点实验室(泸州646000);3.西南医科大学基础医学院(泸州 646000)
体液免疫的基础是B 细胞受体(B cell receptor,BCR)的多样性,BCR多样性主要由BCR基因V(D)J重组形成,V(D)J重组发生于B细胞发育的早期阶段,首先是proB 细胞的BCR 重链可变区基因发生V(D)J 重组,随后preB 细胞发生BCR 轻链重组。V(D)J 重组是由重组激活基因(recombination activating gene,RAG)产物RAG1和RAG2介导的。通过重组,将基因组中原本分隔的V、D和J基因连接在一起。V、D和J基因都带有一段保守的DNA 序列—重组信号序列(recombination signal sequences,RSSs)。RAG1/2 能够识别RSSs 并且在此处切割DNA,形成一个发卡状的编码末端和一个信号末端[1]。断裂的DNA由DNA依赖性蛋白激酶、Ar⁃temis、Ku70、Ku86、X 射线修复交叉互补蛋白5(X-ray repair cross-complementing protein 5,XRCC5)和XRCC4等非同源末端连接(nonhomologous end joining,NHEJ)因子进行修复[2-3]。其中,编码末端的发卡结构被打开,重新连接,形成编码连接(coding joint,CJ);信号末端直接连接形成环状,即信号连接(signal joint,SJ),并从基因组中删除[1]。
为了保证重组后形成有功能的BCR基因,同时防止破坏基因组DNA,V(D)J 基因重组有着严密的调控机制,如RAG表达的时空性[4]以及RAG1在细胞核的分布[5],染色质可及性[6],转录因子[如E2A[7]、成对盒5(paired box 5,Pax5)[8]等],以及基因转录[9-10]在BCR基因V(D)J 重组中发挥重要的调控功能。此外,黏连蛋白介导的DNA环挤压[11]也会影响VH-DHJH重组[12-13]。
不均一核糖核蛋白U(heterogeneous nuclear ribonu⁃cleoprotein U,hnRNPU),即核基质结合因子A(scaffold attachment factor A,SAFA),属于不均一核糖核蛋白亚家族成员,是核基质的主要成分之一,其结构分为:N端的DNA 结合区、中间区和C 端的RNA 结合区[14-15]。hnRNPU 具有多种生物学功能,主要包括:调控染色质结构和基因转录[16],参与RNA 代谢[17-18],修复DNA 的氧化损伤[19],调控有丝分裂[20]和细胞增殖[21],调控mi⁃croRNA的胞外囊泡运输[22]等。Ye等[17]的研究显示,条件性敲除小鼠心脏中的hnRNPU基因,小鼠发生严重的扩张性心肌病,并在出生后2 周死亡。国外学者发现,hnRNPU突变的儿童表现为发育迟缓、智力障碍、癫痫及小脑症等[23-24]。有趣的是,在小鼠模型中,淋巴细胞发育异常时,神经系统的发育也受到影响[25]。hnRNPU是否调控V(D)J重组及B细胞发育,尚未见相关报道。本研究旨在构建和鉴定hnRNPU-KD 的preB细胞株,从而为后续研究hnRNPU对早期B细胞V(D)J重组的调控作用奠定实验基础。
1 材料与方法
1.1 细胞、主要材料与仪器
1.1.1 细胞株 A70 细胞(v-Abl 小鼠preB 细胞)用含10%胎牛血清(fetal bovine serum,FBS)(BasalMedia)、β-巯基乙醇、青霉素、链霉素的RPMI 1640 培养基(ATCC 改良型)(BasalMedia)培养。HEK293T 细胞用含10%FBS(BasalMedia)、青霉素、链霉素的DMEM 培养基(BasalMedia)培养。所有细胞均培养于37 ℃、5%CO2。
1.1.2 主要材料 pLKO.1-EBFP-PURO 质粒和感受态细胞DH5α购于中国擎科生物公司。Age I、EcoR I购于上海宝生物公司。T4 DNA ligase 购自美国NEB 公司。针对小鼠hnRNPU基因的shRNA序列(gaccggtCCGGCC TGGGAAATACAACATTCTTTTCAAGAGAAAGAATGT TGTATTTCCCAGGTTTTTGgaattcc)由擎科生物公司合成。rabbit anti-hnRNPU 购自abcam 公司,mouse anti-GAPDH 购 自proteintech 公司,goat anti-rabbit IgG 和goat anti-mouse IgG 购自Thermo 公司。包装慢病毒的质粒pMDL、VSVG和pRSV-Rev,由本课题组保存。
1.1.3 主要仪器 PCR 仪、高速冷冻离心机(美国Thermo 公司)、荧光倒置显微镜(德国莱卡公司)、凝胶成像仪(美国Biorad公司)。
1.2 方法
1.2.1hnRNPUshRNA 表达质粒的构建 利用Age I、EcoR I双酶切pLKO.1-EBFP-PURO 质粒和靶向hnRNPU基因的shRNA 干扰序列。酶切的质粒经电泳检测酶切成功后,回收纯化。纯化的质粒和插入片段,经T4 DNA ligase,室温连接10 min。连接产物转化感受态细胞,接菌,37 ℃培养过夜。挑取单克隆、摇菌,测序检测。测序正确的单克隆(命名为pLKO.1-hnRNPUshRNA-EBFP-PURO)用于后续实验。
1.2.2 表达hnRNPUshRNA的慢病毒的包装HEK293T细胞接种于10 cm 培养皿。当细胞融合度达到70%左右,用聚醚酰亚胺(polyetherimide,PEI)进行转染,其中质粒(μg): PEI(μg)=1∶2,每一皿细胞转染的质粒为pLKO.1-hnRNPUshRNA-EBFP-PURO 或者pLKO.1-EBFP-PURO(μg)∶pMDL(μg)∶pRSV-Rev(μg)∶VSVG(μg)=8∶4∶4∶4。转染4~6 h后,弃去转染试剂,补充含10%FBS 的DMEM 的完全培养基。细胞培养48 h后,收集含病毒的培养基,将其置于4 ℃,以500 g 离心4 min。吸出上清,用0.45 μm 的过滤器过滤后分装,冻于-80 ℃。
1.2.3hnRNPU-KD 的A70 细胞株的构建 收集A70 细胞2管,每管1×106。取冻存的表达hnRNPUshRNA和空载的病毒上清各1 mL,在冰上融化后,加入polybrene至终浓度5 μg/mL,混匀。吸出病毒混悬液,分别加入到两管A70 细胞,混匀,将其吸出至6 孔板。将其置于室温,以1 800 rpm 离心90 min。随后,细胞培养于37 ℃、5%CO2。第2 d换成完全培养基,继续培养72 h。用倒置荧光显微镜观察细胞是否有蓝色荧光,判断感染效果。将细胞培养基换成含2 μg/mL 嘌呤霉素的培养基,继续培养7 d左右(每2 d换1次液),直至阴性细胞全部死亡。Western blot 检测hnRNPU 表达的情况。将细胞进行有限稀释,接种于96 孔板,每孔1 个细胞,用含2 μg/mL嘌呤霉素的培养基继续培养,直至形成单细胞克隆。每个单细胞克隆取一部分进行Western blot检测,其余的冻存于-80 ℃。hnRNPU-KD 的细胞克隆则继续培养扩增,并用于后续实验。
1.2.4 Western blot检测hnRNPU蛋白的表达 用1×蛋白上样缓冲液裂解细胞,100 ℃煮10 min。再将其置于4 ℃,以13 000 rpm 离心20 min。吸取上清,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sul⁃fate polyacrylamide gel electrophoresis,SDS-PAGE)。随后转PVDF膜,室温快速封闭15 min,加入一抗(rabbit anti-hnRNPU、mouse anti-GAPDH)4 ℃孵育过夜。TBST 洗3 次后,加入二抗(goat anti-rabbit IgG、goat anti-mouse IgG)室温孵育1 h。TBST洗3次。膜上滴加显影液后,利用凝胶成像仪曝光。
2 结果
2.1 电泳检测pLKO.1-EBFP-PURO质粒双酶切产物
pLKO.1-EBFP-PURO 质粒经Age I、EcoR I双酶切后电泳。结果显示质粒已被切开,见图1,可以用于后续实验。

图1 pLKO.1-EBFP-PURO质粒双酶切产物的鉴定Figure 1 Identification of double digested production of pLKO.1-EBFPPURO
2.2 测序鉴定重构的pLKO.1-hnRNPU shRNAEBFP-PURO质粒
重构的pLKO.1-hnRNPUshRNA-EBFP-PURO 质粒转化感受态细胞,涂板,培养过夜。挑取细菌单克隆测序。结果显示目的片段已经插入到质粒中,见图2,提示pLKO.1-hnRNPUshRNA-EBFP-PURO构建成功,可以用于包装病毒。
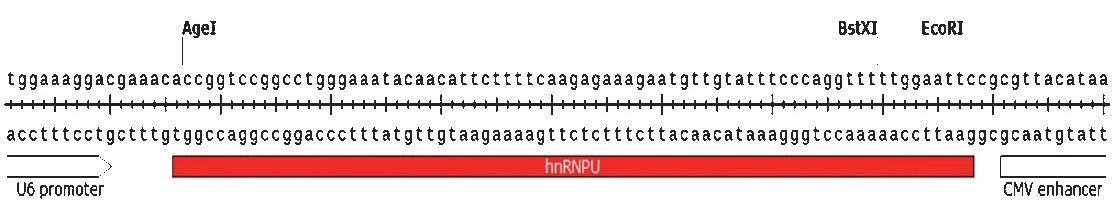
图2 pLKO.1-hnRNPU shRNA-EBFP-PURO质粒的测序结果Figure 2 The sequencing result of pLKO.1-hnRNPU shRNA-EBFPPURO
2.3 荧光显微镜检测感染病毒的A70细胞
慢病毒感染A70 细胞72 h后,细胞内可以观察到蓝色荧光,见图3,说明病毒已经成功感染细胞。
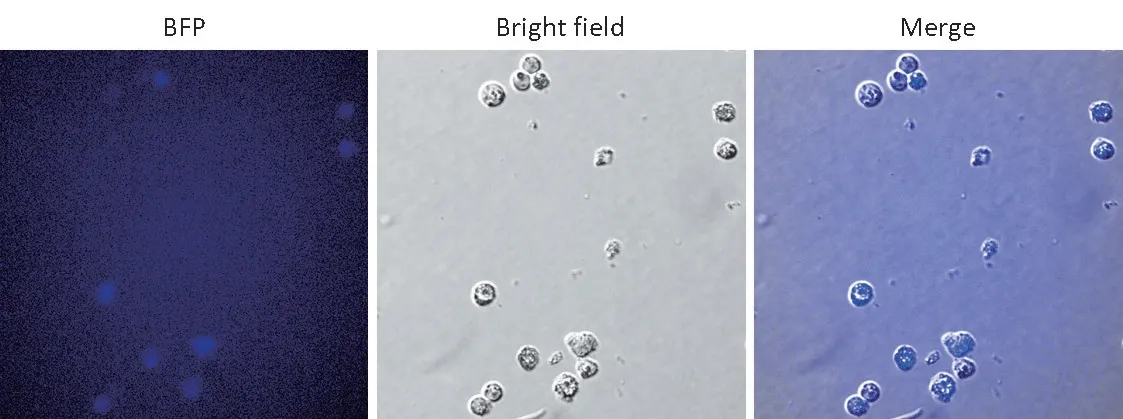
图3 感染病毒的A70细胞的检测(×400)Figure 3 Identification of A70 cells infected by viruses(×400)
2.4 hnRNPU蛋白的检测
病毒感染A70 细胞72 h后,用嘌呤霉素筛选阳性细胞,提取总蛋白,利用Western blot检测hnRNPU的表达。如图4A、B所示,虽然各组间hnRNPU表达的差异性未达到统计学意义(P>0.05),但与对照组相比,实验组的hnRNPU 减少了大约一半。将实验组的细胞进行有限稀释,培养成单细胞克隆,利用Western blot 检测hnRNPU 的表达。结果显示,细胞克隆1和克隆2的hnRNPU抑制率达到60%~70%,见图5A、B,可以用于后续实验。
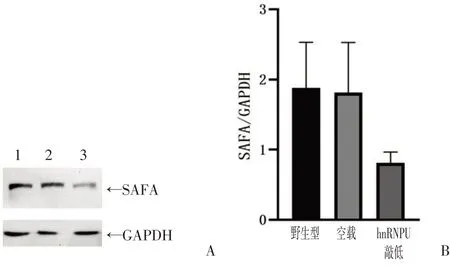
图4 hnRNPU蛋白表达的检测Figure 4 Identification of hnRNPU expression

图5 hnRNPU基因稳定敲低的细胞株的筛选Figure 5 Selection of stable hnRNPU-KD cell lines
3 讨论
早期研究表明,在proB 细胞中,增强子Eμ可以引导DHJH基因群的转录[9]。Eμ引导的基因转录,可能对于DHJH区域染色质的开放至关重要[26]。OSIPOVICH等[10]发现,转换/蔗糖不发酵复合物(switching/sucrose nonfermenting,SWI/SNF)是启动整个Igh基因反义转录的基础,当proB 细胞缺失SWI/SNF时,Igh基因不发生转录,VH、DH和JH基因片段也不能重组。以上研究均提示,V(D)J重组与基因转录息息相关。hnRNPU能够结合actin和Pol II等,在转录的起始和延伸阶段发挥调控作用[16,27]。因此,我们假设hnRNPU 可能调控V(D)J重组。
本研究成功构建了靶向小鼠hnRNPU基因的shRNA 的表达载体及慢病毒。但由于hnRNPU具有多种生物学功能[14,16,20,28],对于细胞的生存至关重要[29],在用嘌呤霉素筛选稳定细胞株时,我们没有获得hnRNPU-knockout 的单细胞克隆,只筛选到hnRNPUKD的克隆。
4 结论
本研究成功构建了hnRNPU基因稳定敲减的A70细胞株,为探讨hnRNPU在V(D)J重组及早期B细胞发育中的调控奠定了实验基础。
(利益冲突:无)

