1,2 - 二苯基 - 1H - 咪唑[4,5 - f][1,10]邻菲罗啉新型缓蚀剂对低碳钢的缓蚀性能研究
吕艳丽,陈娟霞,王艳秋,李 晓,汪 琦,,金 辉
(辽宁科技大学 a. 化学工程学院, b. 材料与冶金学院, 辽宁鞍山 114051)
0 前 言
据报道,世界上每年因腐蚀而报废的金属设备和材料相当于其年产量的20%~40%。侯保荣院士在“The cost of corrosion in China”[1]中明确指出2014年我国行业腐蚀总成本为21 278亿元人民币(3 100亿美元),占GDP的3.34%,平均每人需要承担的腐蚀成本约为1 555元人民币。
将缓蚀剂添加到腐蚀介质中,通过其在金属与腐蚀介质界面上的物理和化学作用,可以降低金属的腐蚀速率,减少金属的腐蚀[2]。1,10 - 邻菲罗啉具有含氮六元杂环结构,接受π电子能力强,易与各种金属离子形成稳定的配位化合物,在诸多领域都有应用。邻菲罗啉及其衍生物作为缓蚀剂最早是1989年Banerjee等[3]发现1,10 - 邻菲罗啉可减缓低碳钢在硫酸溶液中的腐蚀速率开始的,后来,1,10 - 邻菲罗啉抑制碳钢、冷轧钢和铝在不同腐蚀介质中的缓蚀性能相继报道[4-6]。Obi - Egbedi等[7,8]、Obot等[9,10]报道了邻菲罗啉衍生物——菲并咪唑系列,该类化合物均能有效地抑制低碳钢在酸性介质中的腐蚀。2015年,Lei等[11]设计合成新的咪唑[4,5 - f][1,10]邻菲罗啉衍生物,考察了其作为缓蚀剂在酸性介质中对低碳钢的缓蚀性能。
本工作基于邻菲罗啉及其衍生物良好的缓蚀性能,从分子设计角度出发,增加分子体积和平面结构,设计并合成了带π电子的咪唑环和邻菲罗啉环的1,2 - 二苯基 - 1H - 咪唑[4,5 - f][1,10]邻菲罗啉(HIP)新型缓蚀剂,可以提供多吸附位点从而增强化合物分子在金属表面的吸附能力,得到优越的缓蚀性能。采用失重法、电化学、热力学等研究了HIP在盐酸介质中对低碳钢的缓蚀性能。采用扫描电镜(SEM)技术分析试片表面的腐蚀形貌,通过量子化学计算探究了HIP的缓蚀机理。
1 试 验
1.1 1,2 - 二苯基 - 1H - 咪唑[4,5 - f][1,10]邻菲罗啉(HIP)
HIP以邻菲罗啉为原料按文献[12,13]合成,产率为62%,其化学结构式见图1。
FT - IR (cm-1): 1 610, 1 725, 3 422。
1H NMR (500 MHz, DMSO):δ13.77 (s, 1 H), 9.05~9.04 (m, 2 H), 8.94~8.92 (m, 2 H), 8.32~8.30 (t, 2 H), 7.86~7.81(m, 2 H), 7.65~7.62 (t, 2 H), 7.56~7.53 (t, 1 H)。
1.2 试验材料和腐蚀体系
试验材料为低碳钢试片(50 mm×25 mm×2 mm),其化学组成见表1。

表1 试片的化学组成
腐蚀体系为1 mol/L盐酸溶液,每次测试试验时需重新配制。
1.3 缓蚀性能测试
将低碳钢试片表面用不同等级的水砂纸(200, 400, 600,800, 1 000号)进行打磨后用丙酮和无水乙醇清洗,置于干燥器中备用。
失重法:将处理过的低碳钢试片悬挂于添加了缓蚀剂的盐酸溶液中,浸泡6 h后取出,同时用不加缓蚀剂的空白盐酸溶液进行对比试验。试片取出后用去离子水、乙醇、丙酮依次洗涤,冷风吹干,置于干燥器中,精确称重(称量精度为0.000 1 g)。
电化学测试:室温,瑞士万通电化学工作站,三电极体系。工作电极为低碳钢电极(工作面积1 cm2),参比电极为饱和甘汞电极,辅助电极为铂片电极(工作面积1 cm2)。动电位极化曲线扫描速率为0.2 mV/s,扫描范围-1 000~0 mV;交流阻抗振幅为10 mV,测试频率范围1.0×(105~10-1) Hz。
试片腐蚀形貌采用自带能量色散X射线光谱(EDX)的Zeiss - IGMA HD扫描电镜观察。
量子化学计算采用Gaussion 09 程序运用密度泛函理论(DFT)中的 B3LYP 方法,在6-31G(d,p)基组水平上对分子进行几何构型优化,并在同一基组水平下进行频率计算。
2 结果与分析
2.1 失重法
将低碳钢试片浸在不同缓蚀剂浓度的1 mol/L盐酸中,同时进行空白试验(未添加缓蚀剂),温度为30 ℃。缓蚀剂浓度为0.2~1.0 mmol/L(浓度梯度为0.2 mmol/L),进行3组平行试验,其结果见表2。
表2 不同HIP浓度时的缓蚀效率和腐蚀速率
Table 2 Inhibition efciency and corrosion rate with different concentration of HIP
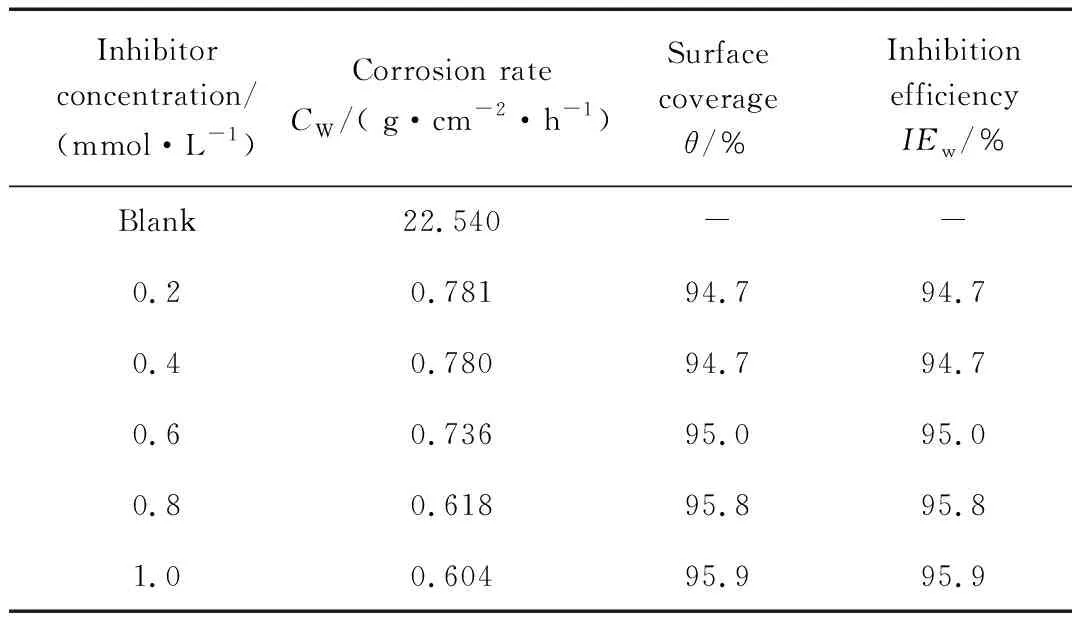
表2 不同HIP浓度时的缓蚀效率和腐蚀速率
Inhibitor concentration/(mmol·L-1)Corrosion rateCW/( g·cm-2·h-1)Surface coverageθ/%Inhibition efficiencyIEw/%Blank22.540--0.20.78194.794.70.40.78094.794.70.60.73695.095.00.80.61895.895.81.00.60495.995.9
从表2可以看出,HIP在试验浓度范围内均具有较高的缓蚀效率,在较低浓度(0.2和0.4 mmol/L)时的缓蚀效率达到94.7%;随缓蚀剂浓度的增大,缓蚀效率呈增大趋势,当HIP浓度为0.8 mmol/L时缓蚀效率达到95.8%,之后基本趋于稳定(1.0 mmol/L时,缓蚀效率为95.9%)。出现该现象的原因是缓蚀剂在低碳钢表面的吸附随其添加量的增大逐渐增加;当吸附达到饱和后,缓蚀剂在低碳钢表面的吸附膜趋于完整,缓蚀剂在金属表面的吸附就不再进行,对应的腐蚀速率和缓蚀效率基本保持不变[14]。HIP缓蚀效率高于目前文献报道的邻菲罗啉衍生物的缓蚀效率(见表3)。
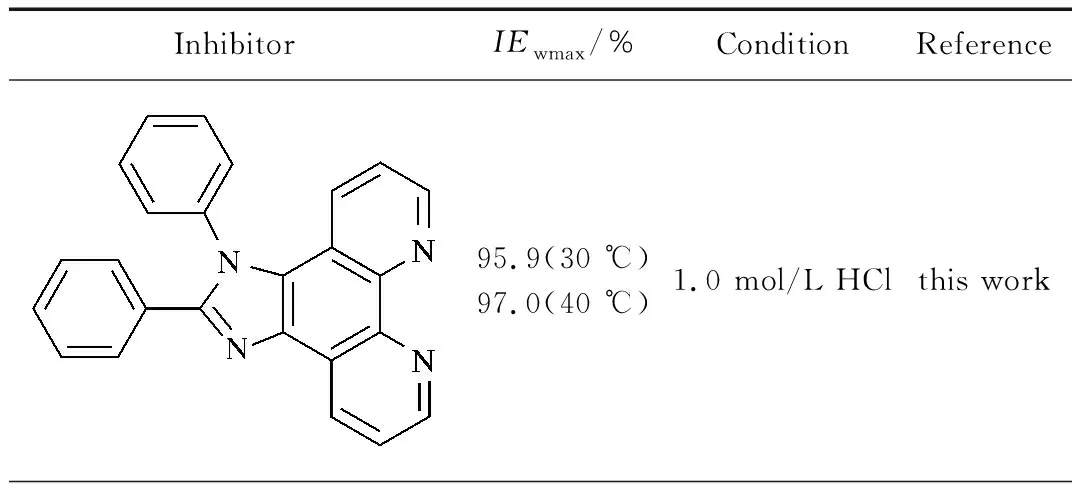
表3 邻菲罗啉衍生物缓蚀剂在不同条件下对低碳钢的最大缓蚀效率(IEwmax)
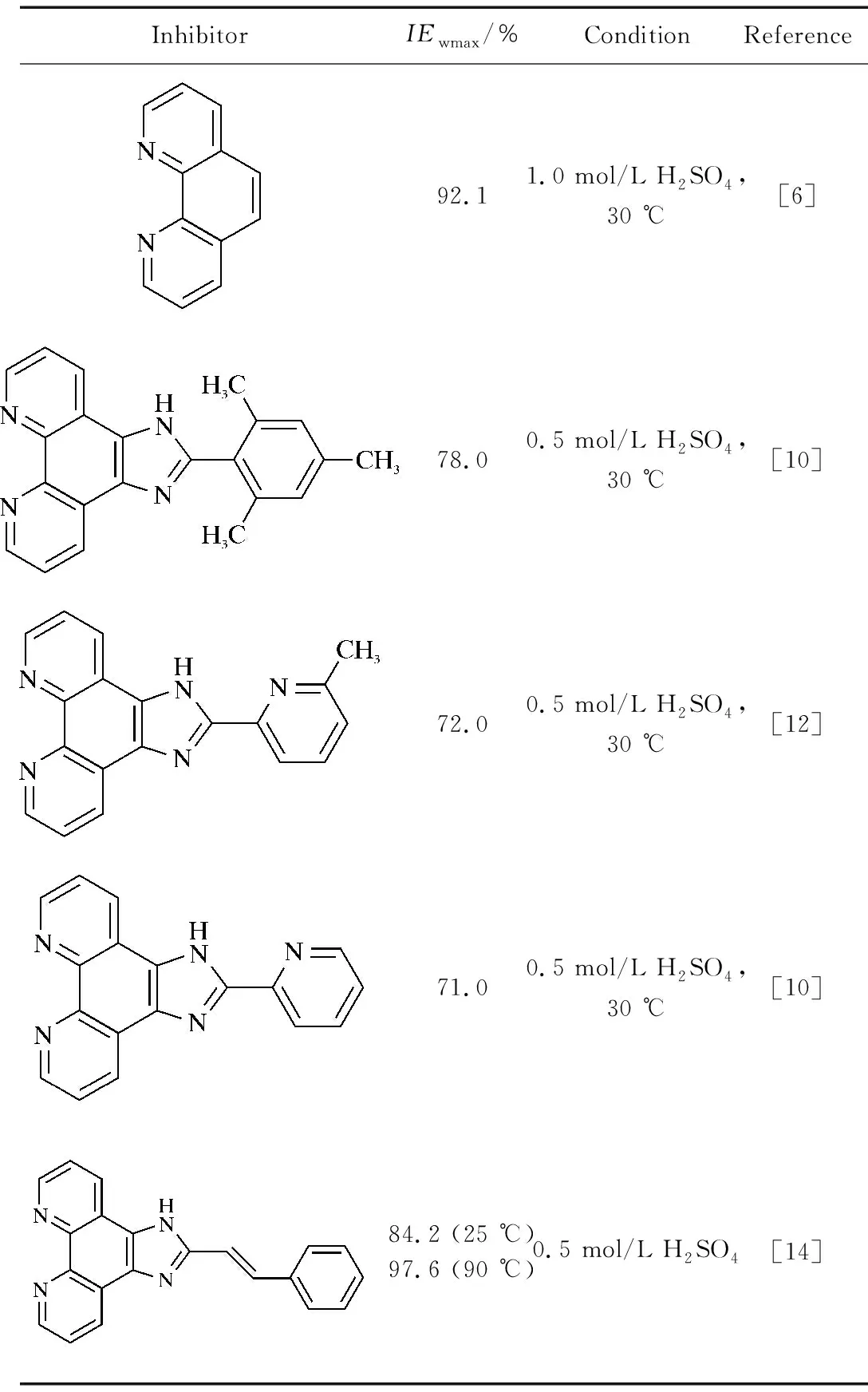
表3(续)
2.2 温度对缓蚀效率的影响
HIP浓度为1.0 mmol/L,20、30、40、50、60 ℃ 5个温度下进行试验。添加和未添加缓蚀剂条件下,不同温度下低碳钢的腐蚀速率见图2。
从图2可以看出,无论是否添加缓蚀剂,盐酸溶液中低碳钢的腐蚀速率都随着温度的升高而增大。但添加缓蚀剂的盐酸介质中,低碳钢的腐蚀速率远远低于未添加缓蚀剂的,说明HIP可以有效减少低碳钢在盐酸溶液中的腐蚀。
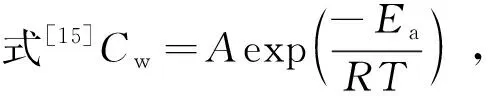

表4 阿伦尼乌斯参数
根据公式Cw=Aexp(-Ea/RT)可知,低碳钢的腐蚀速率降低的条件是腐蚀活化能Ecorr升高,指前因子A减小。由图3求出的腐蚀活化能Ecorr略有降低,仅从这一结果来看腐蚀活化能降低,会导致腐蚀反应速率升高。但将HIP添加到盐酸溶液中,低碳钢腐蚀反应的指前因子呈指数形式地降低,与活化能的较小幅度降低相比,对腐蚀速率的影响更为显著。指前因子A与低碳钢腐蚀反应的活性位点有关[15],A越大,反应的活性位点数目越多。由表4 可知,加入HIP后,指前因子显著降低,意味着由于缓蚀剂吸附在低碳钢表面,其腐蚀反应的活性位点数目大幅度降低,指前因子减小。这一现象说明在盐酸溶液中添加HIP后,低碳钢的腐蚀反应速率降低,表明HIP在盐酸溶液中对低碳钢有一定的缓蚀作用。
不同温度下,1.0 mmol/L HIP在1 mol/L盐酸溶液中对低碳钢的缓蚀效率见表5。
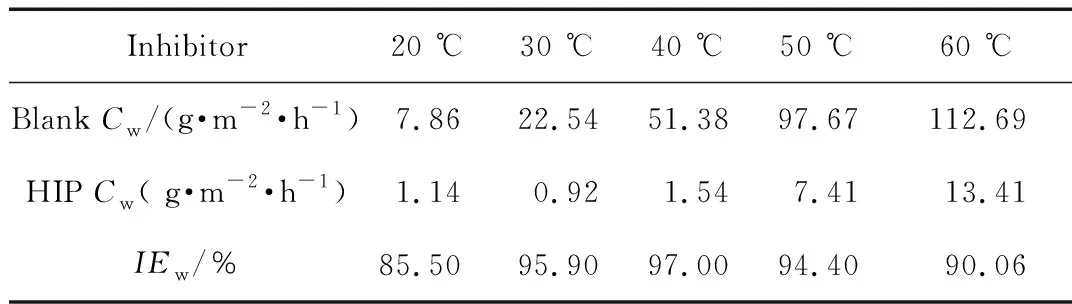
表5 不同温度下HIP对低碳钢的缓蚀效率
随着温度的升高,缓蚀剂分子在低碳钢表面的化学吸附占主导地位,使金属表面的吸附层变得致密坚固。但当温度升高时,低碳钢在盐酸中的溶解速率也加快。因而,温度对缓蚀剂在腐蚀介质中有双重影响。从表5可以看出,在低温(20 ℃)时HIP的缓蚀效率最低;30 ℃和40 ℃时基本稳定,维持在较高的水平;当温度超过50 ℃时,其缓蚀效率略有降低。
2.3 电化学法
2.3.1 动电位极化曲线
室温下,1 mol/L盐酸溶液中,不同浓度HIP的动电位极化曲线如图4所示。由极化曲线得到电化学参数[腐蚀电位(Ecorr),腐蚀电流密度(Jcorr),塔菲尔常数(βa、βc) 和缓蚀效率IEi(%)]列于表6。从图4、表6可以看出,相对于空白样,添加了HIP的腐蚀电流密度Jcorr值降低,即HIP可以降低盐酸介质对低碳钢的腐蚀速率;缓蚀剂浓度越高,腐蚀电流密度Jcorr下降的越明显,用表面覆盖度来解释该现象:高浓度缓蚀剂在金属表面的吸附量和覆盖面积增大,能有效阻隔活性区域的金属溶解。从表6可以看出,随着HIP浓度的增大,缓蚀效率提高,在1.0 mmol/L时达到最大值为95.9%,与失重法试验结果具有一致性。
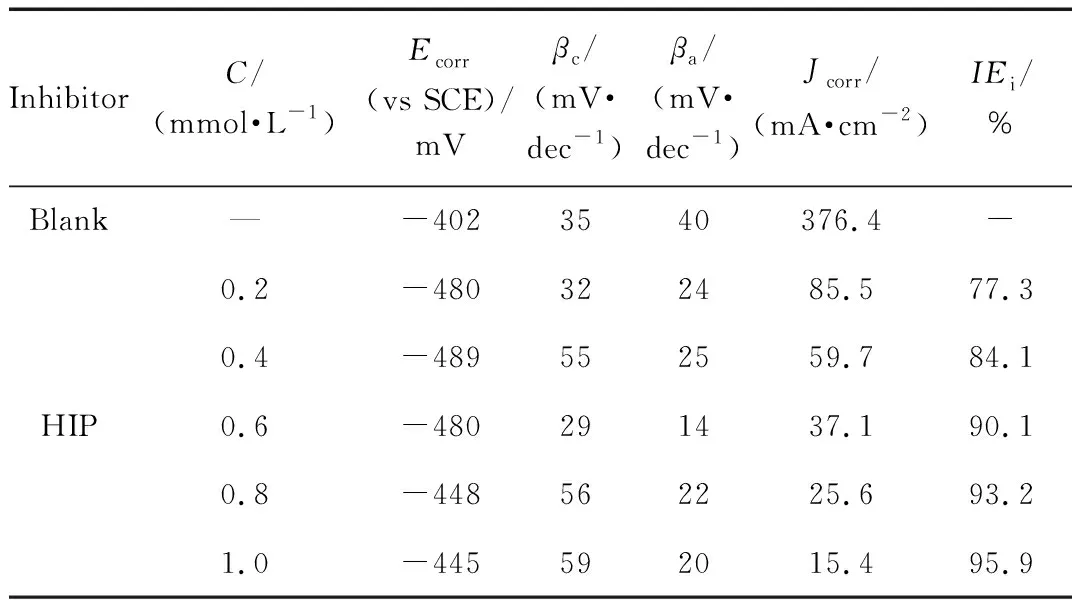
表6 不同浓度HIP的极化曲线电化学参数
2.3.2 交流阻抗
图5为低碳钢在不同浓度HIP的1 mol/L盐酸体系中的电化学阻抗谱和拟合的等效电路。其中,Rs为溶液电阻,Rct为电荷转移电阻,CPE为相原件。
从图5a可知,低碳钢在盐酸体系中的Nyquist谱几乎呈现半圆的形状,且阻抗的复平面为单一容抗弧,只有1个时间常数。随着缓蚀剂浓度的增大,阻抗弧半径逐渐增大。与空白试验相比,添加了缓蚀剂的阻抗谱在形状上并未发生任何改变,HIP未改变金属的腐蚀机理。阻抗弧增大,表明缓蚀剂分子吸附在金属表面,阻止酸/钢界面的电荷转移,阻抗增加[15],进而抑制金属腐蚀。随着HIP在盐酸溶液中浓度的增加,其在低碳钢表面的吸附越来越多,低碳钢表面逐渐被缓蚀剂分子覆盖,且HIP的吸附层厚度比H2O分子的厚,低碳钢表面吸附的H2O分子逐渐被缓蚀剂分子代替,直至吸附平衡[16](见图6)。图5b中电荷转移阻抗的大小以及相位角的大小也都呈现出与电容弧半径相同的趋势,即随着缓蚀剂浓度的增大,电荷转移阻抗逐渐增大,相位角逐渐增大。
盐酸体系中,通过ZSimpwin软件用等效电路图5c对阻抗数据进行拟合得到低碳钢腐蚀电化学阻抗参数,如表7所示。
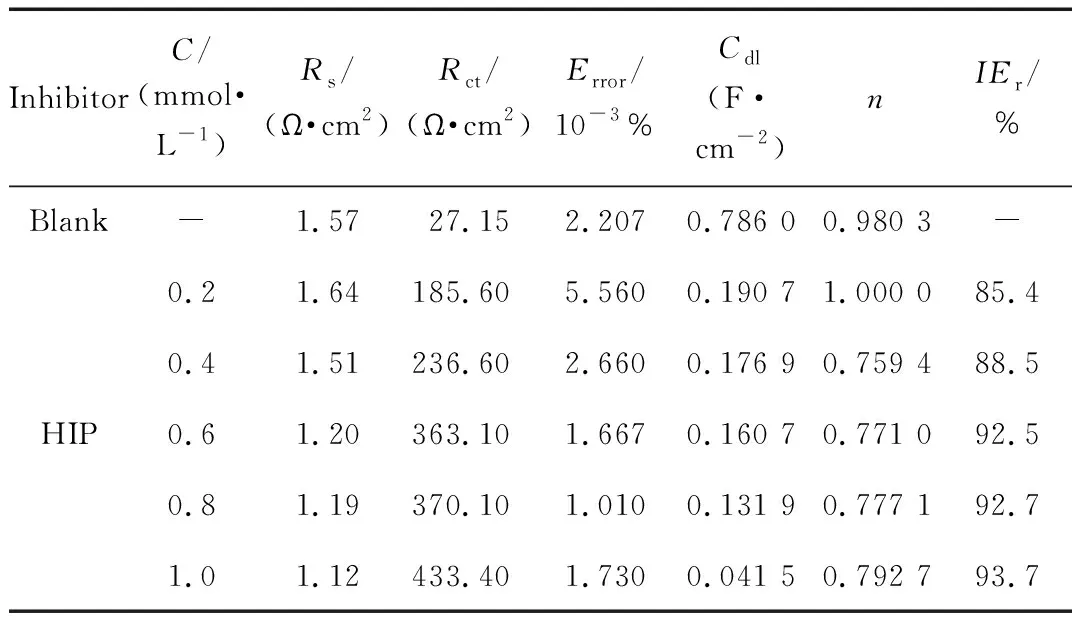
表7 电化学阻抗参数
由表7可知,随着缓蚀剂浓度增加,电荷传递阻抗Rct增大,缓蚀效率与浓度成正相关,在缓蚀剂浓度为 1.0 mmol/L时,电荷转移阻抗Rct达到最大值,缓蚀效率最高为93.7%,HIP吸附在金属表面必须占据金属表面水分子的吸附位点,随着缓蚀剂吸附量的增加,保护层厚度增大导致Cdl(双电层电容)值减小。拟合参数n值介于0.7~1.0之间,表示等效电路能很好地描述金属腐蚀的电荷传递过程;误差值Error很小,说明等效电路拟合结果与电极在酸性溶液中腐蚀的实际过程一致。
2.4 HIP在低碳钢表面吸附等温线
利用失重的试验结果,采用朗格缪尔吸附等温模型[式(1)和式(2)所示[2]]对其吸附行为进行拟合:
(1)
ΔG0=-RTln55.5K
(2)
式中:C为缓蚀剂浓度,mmol/L;θ为覆盖度,%;K为吸附平衡常数,L/mol;ΔG0为标准吉布斯自由能,kJ/mol。
其中C/θ与C的线性拟合呈线性关系,图7为HIP在低碳钢表面的吸附等温线。
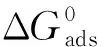
通过公式(3)、(4)[18,19]求出吸附反应焓ΔHads和吸附熵ΔSads。
(3)
(4)
式中,R为气体常数,J/mol·k;T为绝对温度,K。
在常压下,Qads的值等于吸附剂的焓(ΔHads)。绘制ln(θ/1-θ)与1/T关系(图8),ΔHads可从直线的斜率计算出ΔHads为-32.42 kJ/mol, 表明HIP在低碳钢表面的吸附为放热过程;ΔSads为26.67 J/mol·K,说明HIP吸附过程是熵增过程且自发不可逆[20]。
2.5 腐蚀形貌分析
图9为低碳钢试片浸泡在未添加HIP的盐酸溶液中及添加了1.0 mmol/L HIP的盐酸溶液中6 h后的扫描电镜及对应的EDX能谱。从图9可知,低碳钢在未添加缓蚀剂的盐酸溶液中腐蚀严重,试片呈典型的腐蚀形貌,表面粗糙不平,未见原有加工痕迹。在添加了HIP的盐酸溶液中浸泡的试片平整度较好,表面平滑,腐蚀所造成的破坏程度轻,而且可以看出在低碳钢表面有一层规则的新介质膜存在。说明HIP吸附在低碳钢试片表面,发生了化学反应有新物质生成,生成的新物质层能有效抑制低碳钢溶解反应的活性点,进而在低碳钢试片表面形成一层致密的保护膜抑制低碳钢在盐酸介质中的腐蚀。另外,从EDX能谱可以看出,与未添加缓蚀剂空白盐酸浸泡的低碳钢试片相比,加入了HIP的盐酸溶液中浸泡的试片表面出现了N元素,意味着N元素是在盐酸溶液浸泡过程中缓蚀剂分子吸附在试片表面的。
2.6 量子化学计算
通过量子化学计算得出HIP分子的结构参数最高占有分子轨道能量(EHOMO)、最低占有分子轨道能量(ELUMO)、能级差 (ΔE=ELUMO-EHOMO)、电负性 (χ)、硬度 (η)、软度 (σ) 和电荷转移分数(ΔN)、偶极矩(μ)。
χ、η、σ、ΔN值由如下公式获得:
(5)
(6)
σ=1/η
(7)
(8)
式中:χFe、χi、ηFe、ηi分别代表铁和缓蚀剂的电负性和硬度。
HIP最优化分子构型及其前线分子轨道电子云密度分布见图10。从图10可以看出,HIP分子的最高占有轨道能级EHOMO和最低占有轨道能级ELUMO几乎分布在整个分子的平面结构中,而1位取代苯环上未分布HOMO和LUMO。咪唑环和平面结构中的苯环既能够给出电子与金属离子形成配位键,又能够接受金属电子对形成反馈键。量子化学参数见表8。
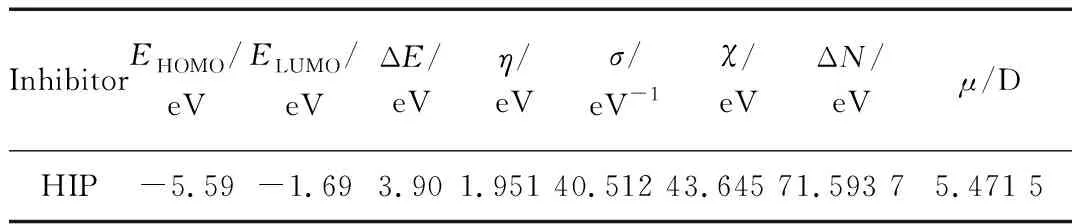
表8 HIP的量子化学参数
EHOMO值与缓蚀剂分子的供电子能力有关,其值越大表示电子越不稳定,越容易给能量低的轨道提供电子;ELUMO值代表有机物接受其他含有孤对电子化合物的电子特性,其值越低代表越容易从金属表面获得电子。此外,ΔE值与有机分子缓蚀特性相关,具有较小ΔE值的化合物易于通过化学作用吸附在金属表面。据表8中理论参数可知,HIP能通过配位键紧密吸附在金属表面,与试验结果一致。偶极矩μ值是另一个判定有机缓蚀剂性能的指标,μ值大的有机分子易于吸附在试片表面。HIP的μ值为5.88 D远大于水分子的μ值(1.85 D),可以代替水分子吸附在金属表面隔绝腐蚀介质的侵蚀。
3 结 论
(1)HIP在盐酸中对低碳钢具有良好的缓蚀性能,缓蚀剂浓度为1.0 mmol/L、温度为40 ℃时其缓蚀效率最高,达到97.0%。
(2)动电位极化曲线可以看出HIP在盐酸溶液中可以同时抑制阴极的析氢反应和阳极的溶解反应;Nyquist几乎呈现半圆的形状,而且阻抗的复平面为单一的容抗弧。
(3)HIP在低碳钢表面的吸附过程遵循朗格缪尔吸附等温模型,是化学吸附,为放热、熵增、不可逆过程。
(4)扫描电镜及EDX能谱表明,HIP可以在金属表面形成致密膜,有效抑制低碳钢在盐酸溶液中的腐蚀。
(5)量子化学计算表面EHOMO和ELUMO分布在分子的平面结构上,且咪唑环和平面结构中的苯环为与金属作用的活性位点,可以与金属进行配位。

