壳聚糖/原花青素微凝胶制备及其评价
◎ 安 妮,何天豪,余 洁,姜皓琤,严禧堃,冉玲玲,葛 建,侯 欢
(1.中国计量大学 生命科学学院,浙江 杭州 310018;2.浙江山屿海康养产业发展有限公司,浙江 杭州 310011)
近年来,肥胖的发病率在全球范围内快速上升,与糖尿病、心脑血管疾病的发生都有密切的联系,而脂肪类膳食摄入过多是引起肥胖、“三高”等慢性病的主要因素[1]。因此,开展天然功能因子的稳定性保护、靶向递送以及复配探索研究,已成为近年来药品食品科学的探索热点与趋势。
原花青素是植物中提取的具有抗氧化、抗肿瘤、预防和治疗心血管疾病等作用的多酚类物质[2-3],其化学结构中存在大量酚羟基,能够提供电子,从而中断自由基反应[4]。天然原花青素广泛存在于葡萄、茶叶、可可、大麦等植物中。杨梅叶中也富含原花青素[5]。壳聚糖含有氨基、羟基等具有生物活性的功能基团,也具有抗氧化和调节脂质代谢等功效[6]。壳聚糖在肠道内能与胆酸盐如甘氨胆酸钠(Sodium Glycyl Acid,GA)或牛磺胆酸钠(Sodium Taurocholate Acid,TA)结合,干扰胆酸盐的肠肝循环,促进胆酸盐排泄,阻止胆汁酸重吸收,促使血浆及肝脏中的胆固醇转化为胆汁酸,从而起到降血脂的效果。壳聚糖还可以通过吸附胆汁酸,抑制脂肪消化,从而减少机体吸收脂类物质,达到降低血脂的作用[7]。
微凝胶是尺寸在0.1~1 000.0 μm,通过聚合物分子(如多糖、蛋白等)间的交联形成三维网络结构的颗粒[8-9]。它表现出无毒、结构稳定、具有生物相容性和可降解性等一系列特殊的性质,具有广阔的应用空间并具有一定的安全性[10]。壳聚糖等聚合物虽有良好的生物相容性,但无法被人体内消化酶所降解,因此适合用于原花青素等功能因子的定向(结肠)释放[11]。将壳聚糖与杨梅叶原花青素制成微凝胶后,其生物活性物质在各种环境中的稳定性能够显著提高[12]。
本研究采用磁力搅拌制备壳聚糖/原花青素微凝胶,并探究其协同抗氧化作用,通过在体外模拟人体消化环境的实验,研究不同因素对微凝胶与胆酸盐结合能力的影响,旨在探讨其与胆酸盐结合的适宜条件,以期为壳聚糖/原花青素微凝胶在药品食品中的实际应用提供理论依据。
1 材料与方法
1.1 材料与试剂
不同聚合度杨梅叶原花青素,实验室自制;壳聚糖、过硫酸钾、硫酸亚铁七水合物,购于上海泰坦科技股份有限公司;2,2-联苯基-1-苦基肼基(DPPH,生物试剂),购于梯希爱(上海)化成工业发展有限公司;2,2-联氮双(3-乙基苯并噻唑啉-6-磺酸);二铵盐(ABTS,生物试剂),购于上海麦克林生化有限公司;甘氨胆酸钠盐和牛磺胆酸钠盐(纯度:95%),购于上海阿拉丁有限公司。
1.2 仪器与设备
UV-5200紫外可见分光光度计(上海元析仪器有限公司);高效液相色谱仪(日本岛津Shimadzu 20AT);85-1磁力搅拌器;SC-30A数控超级恒温槽;XW-80A旋涡混合器;KQ-250B型超声波清洗器;EL204电子天平;高速离心机(MIKRO 22R,德国 Hettich)。
1.3 实验方法
1.3.1 微凝胶的制备
将壳聚糖溶于1%醋酸溶液,磁力搅拌至无沉淀,4 ℃保存备用。将杨梅叶原花青素溶于1%乙醇溶液,磁力搅拌 2 h,5 000 r·min-1离心 15 min,用 0.22 μm过滤器过滤,-20 ℃保存备用。取壳聚糖溶液与杨梅叶原花青素溶液按照3∶1(体积比)比例混合置于圆底烧瓶中封口后磁力搅拌2 h,即得壳聚糖/杨梅叶原花青素微凝胶(以下简称微凝胶)。
1.3.2 抗氧化能力评价
(1)DPPH自由基清除能力测定。参考柳埃塔尔[13]的方法并稍作调整。分别取200 μL杨梅叶原花青素、壳聚糖以及微凝胶与4.5 mL的100 μmol·L-1DPPH乙醇溶液混合,旋涡振荡30 s后置于暗处30 min,在517 nm波长下测定其吸光度A1。用水替代样品溶液作空白组A空白1,乙醇代替DPPH乙醇溶液作对照组A对照1。DPPH清除率计算公式为清除率=[1-(A1-A对照1)/A空白1]×100%。
(2)ABTS自由基清除能力测定。参照凯塔尔[14]的方法并稍作调整,精确称取0.384 1 gABTS,加乙醇溶解并定容至100 mL。加入0.066 2 g过硫酸钾,室温避光条件下静置过夜12~16 h。临用前稀释ABTS储存液至734 nm波长下吸光度为0.8±0.02,分别取80 μL杨梅叶原花青素、壳聚糖以及微凝胶与3 mL的ABTS反应液混合,混匀后室温避光反应6 min。然后在734 nm波长下测定其吸光度A2,用水替代样品溶液作空白组A空白2,乙醇代替ABTS乙醇溶液作对照组A对照2。ABTS清除率计算公式为清除率=[1-(A2-A对照2)/A空白2]×100%。
(3)羟基自由基清除能力测定。参照陈根洪等[15]的方法并稍作调整。称取0.025 0 g的七水硫酸亚铁,加水溶解并定容至10 mL。称取0.012 4 g水杨酸,加乙醇溶解并定容至10 mL。量取0.099 2 mL的30%H2O2,加水定容至100 mL。将0.2 mL的FeSO4溶液、0.2 mL的水杨酸乙醇溶液、0.3 mL的去离子水分别与0.6 mL的杨梅叶原花青素、壳聚糖、微凝胶混合,摇匀后加入0.2 mL的H2O2溶液,于37 ℃水浴加热反应15 min,然后在510 nm波长下测定其吸光度A3。用水替代样品溶液作空白组A空白3,乙醇代替水杨酸乙醇溶液作对照组A对照3。羟基自由基清除率计算公式为清除率=[1-(A3-A对照3)/A空白3]×100%。
1.3.3 胆酸盐检测方法的建立
(1)色谱条件。参照王凤双等[16]的方法并稍作调整。以反相高效液相色谱法测定甘氨胆酸钠和牛磺胆酸钠的含量;色谱柱:Hypersil ODS(150 mm×4.0 mm,5 μm);流动相:甲醇-0.6%磷酸二氢钾(65∶35,V/V);流速:0.5 mL·min-1;检测波长:205 nm;进样量:20 μL。
(2)线性关系考察。分别制备浓度为200 μmol·L-1、150 μmol·L-1、100 μmol·L-1、50 μmol·L-1、25 μmol·L-1的相同浓度GA和TA的混合溶液,离心后取上清液进样测定GA和TA各自的峰面积,绘制标准曲线,建立线性回归方程,考察线性关系。
(3)精密度实验。按上述方法制备含有GA和TA 0.05 mmol·L-1、0.10 mmol·L-1、0.20 mmol·L-1的质控样品,同一日期连续进样3次,记录各峰面积,计算RSD,考察日内精密度;于3个不同日期内各连续进样3次,记录峰面积,根据每日峰面积平均值计算RSD,考察日间精密度。
1.3.4 微凝胶结合胆酸盐功效探究
(1)人体胃肠道环境模拟。胃环境模拟:取一定量样品,加入1 mL 0.01 mol·L-1的盐酸溶液,在37 ℃恒温振荡1 h。肠环境模拟:以0.1 mol·L-1氢氧化钠溶液调节胃环境模拟后样品液pH值为6.3,随后加入4 mL10 mg·mL-1胰酶,(胰酶以pH6.3的0.1 mol·L-1磷酸缓冲液配制),在37 ℃恒温振荡1 h。
(2)微凝胶功能成分结合胆酸盐能力探究。经预实验优化确定胆酸盐浓度为0.3 mmol·L-1,杨梅叶原花青素浓度为1 mg·mL-1,按“1.3.1”项下配比制作凝胶。分别取微凝胶、壳聚糖/原花青素直接混合物1 mL,经胃肠模拟环境处理后加入4 mL胆酸盐溶液(TA、GA 浓度均为 0.3 mmol·L-1,用 pH6.3、0.1 mol·L-1磷酸缓冲液配制),恒温振荡1 h,4 000 r·min-1离心20 min。对上清液中胆酸盐含量进行测定。
1.3.5 影响微凝胶与胆酸盐结合因素研究
(1)离子强度对微凝胶结合胆酸盐的影响。取1 mL微凝胶,经胃肠模拟环境处理后吸取6 mL,每个样品中加入4 mL胆酸盐(GA、TA的浓度设定为0.3 mmol·L-1、0.6 mmol·L-1、1.0 mmol·L-1,分别以pH6.3,浓度为 0.1 mmol·L-1、0.5 mmol·L-1、0.9 mmol·L-1的不同离子强度的磷酸缓冲液配制),振荡,离心。对上清液中胆酸盐含量进行测定。
(2)尿素对微凝胶结合胆酸盐的影响。将经胃肠模拟环境处理的微凝胶平均分成两份,其中一份加入一定量尿素(1.5 mmol·L-1)。取6 mL上述试液,每个样品中加入4 mL胆酸盐溶液(GA、TA浓度设定为0.1 mmol·L-1、0.3 mmol·L-1、0.5 mmol·L-1、0.7 mmol·L-1、0.9 mmol·L-1, 分 别 以 pH6.3 的 0.1 mol·L-1磷 酸 缓 冲液配制),恒温振荡,离心。对照为取6 mL未加入尿素试液,其余操作相同。对上清液中胆酸盐含量进行测定。
2 结果与分析
2.1 抗氧化能力
DPPH清除率检测法广泛应用于天然植物提取物的体外抗氧化能力检测及抗氧化片段筛选[17]。其乙醇溶液呈紫色,当遇到供氢体时,DPPH自由基被还原为DPPH-H,紫色会褪去[18]。由表1可知,微凝胶能有效地清除DPPH自由基,壳聚糖和杨梅叶原花青素的抗氧化能力在DPPH体系中有协同增效作用。

表1 DPPH自由基清除能力表
ABTS清除率检测法在抗氧化能力的测定中应用较为广泛。经氧化后的ABTS能够生成稳定的阳离子自由基ABTS+·,此时溶液呈蓝绿色,反应体系加入抗氧化剂后褪色[19]。由表2可知微凝胶抗氧化活性略大于杨梅叶原花青素,壳聚糖对ABTS自由基清除活性小,而二者所制得微凝胶能在一定程度上提高原花青素抗氧化活性。

表2 ABTS自由基清除能力表
羟基自由基会被原花青素中含有的抗氧化成分消除。·OH的强氧化性能够在水溶液中改变底物的颜色,应用紫外分光光度法测定底物吸光度的改变,间接测定·OH的浓度[20]。据此建立本实验测定原花青素对羟基自由基清除的方法。由表3可知,相较于壳聚糖和原花青素的单独使用,二者在制成微凝胶后具有良好的抗氧化协同作用,能够在一定程度上提高羟基自由基清除能力。

表3 羟基自由基清除能力表
2.2 胆酸盐检测方法学考察结果
根据方法中HPLC检测方法,以GA、TA浓度(μmol·L-1)为横坐标、峰面积为纵坐标绘制标准曲线(图1),得回归方程为GA:y=2 353x-14 053(R2=0.996 9),TA:y=1 277.3x-9 456.7(R2=0.997 6)。TA的日内RSD分别为2.63%、4.61%、2.74%(n=3),日间RSD分别为6.23%、4.38%、5.92%(n=3);GA的日内RSD分别为2.90%、3.36%、3.37%(n=3),日间RSD分别为5.54%、7.05%、2.47%(n=3)。

图1 甘氨胆酸钠和牛磺胆酸钠标准曲线图
2.3 微凝胶与壳聚糖/原花青素直接混合物结合胆酸盐的能力对比
由图2可知,微凝胶的最佳反应时间位于60 min处,而壳聚糖/原花青素直接混合物的最佳反应时间在90 min处。且60 min时微凝胶的胆酸盐结合量(TA 0.375 μmol·mL-1、GA 0.258 μmol·mL-1)明显高于90 min 壳聚糖 /原花青素直接混合物(TA 0.371 μmol·mL-1、GA 0.237 μmol·mL-1)。说明壳聚糖 /杨梅叶原花青素微凝胶体系中存在某种结构,使胆酸盐的结合具有协同增效能力。
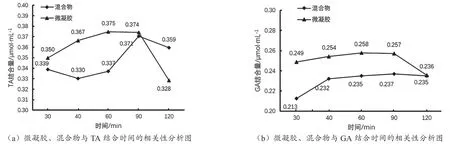
图2 微凝胶、壳聚糖/原花青素直接混合物与胆酸盐结合时间的相关性分析图
2.4 离子强度对微凝胶结合胆酸盐的影响
如图3所示,在不同离子强度的缓冲溶液中微凝胶对2种胆酸盐的结合量不存在显著性差异(P>0.05),表明了离子强度对微凝胶结合胆酸盐有一定影响,但影响不显著。
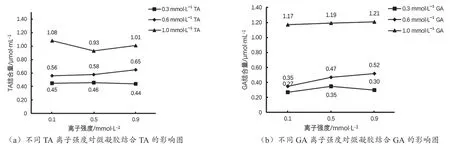
图3 不同胆酸盐离子强度对微凝胶结合胆酸盐的影响图
2.5 尿素对微凝胶结合胆酸盐的影响
在有尿素存在的情况下进行吸附实验,以考察氢键作用和吸附过程的关系。尿素能够优先在自身与水之间形成氢键,暴露胆酸盐的活性基团,进而影响胆酸盐微团的稳定性。在尿素存在的情况下,壳聚糖/原花青素微凝胶对2种胆酸盐的结合作用结果如图4所示,结果表明尿素对微凝胶结合胆酸盐有影响但不显著(P>0.05)。
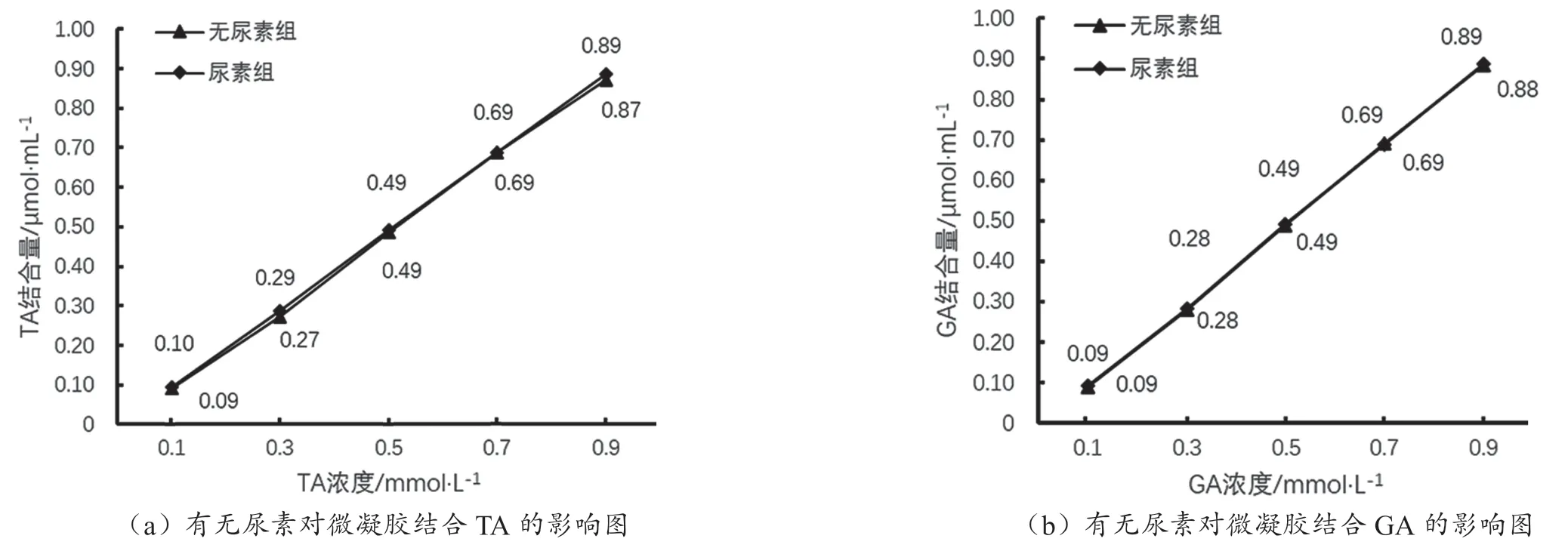
图4 尿素对微凝胶结合胆酸盐的影响图
3 结论
壳聚糖与杨梅叶原花青素都是天然的抗氧化剂,在功能性食品、医药及化工等领域具有广阔的应用前景。经体外抗氧化实验分析可知,壳聚糖/杨梅叶原花青素微凝胶在ABTS与羟基自由基体系中清除自由基的能力大大增强,抗氧化效果明显高于杨梅叶原花青素与壳聚糖单独作用的效果,两者具有协同增效作用。通过微凝胶与直接混合物的胆酸盐吸附对比实验,微凝胶结合胆酸钠的能力高于壳聚糖和杨梅叶原花青素的共同作用,初步证实了微凝胶结构能够提升其功能性成分对人体的降血脂功能。另外,离子强度变化和有无尿素条件对壳聚糖/杨梅叶原花青素微凝胶结合胆酸盐能力均有影响,表明疏水作用力和氢键对微凝胶结合胆酸盐有一定贡献。本研究为天然功能因子的开发利用带来了新视角和新途径,为壳聚糖/杨梅叶原花青素微凝胶在功能性食品、医药和化工等领域的应用创新提供了新的思路。

