生物制剂在风湿免疫病中的治疗药物监测进展Δ
熊晓夫,田雪珂,秦智莹,杨 晶,张晓坚#
(1.郑州大学第一附属医院药学部,郑州450052; 2.河南省精准临床药学重点实验室,郑州 450052; 3.河南省精准临床药学应用与转化工程研究中心,郑州 450052)
生物制剂已成为多种免疫介导的炎症性疾病核心治疗药物,包括类风湿关节炎(rheumatoid arthritis,RA)、银屑病(psoriasis,Pso)、强直性脊柱炎(ankylosing spondylitis,AS)和炎症性肠病(inflammatory bowel disease,IBD)等。生物制剂常表现出非线性药动学特征,且血药浓度在个体内和个体间呈较高的变异,主要由于抗原负荷的变化(与疾病活动有关)和抗药抗体(anti-drug antibodies,ADAs)的存在,也与联合用药、体重和血清白蛋白水平相关[1-2]。药动学参数变异大可能是风湿免疫病患者对生物疗法的反应存在差异的主要原因之一[3]。治疗药物监测(therapeutic drug monitoring,TDM)已成为优化生物治疗的有用工具,特别是国内外均发布了针对生物制剂在IBD中开展TDM的指南和专家共识[4-5]。但TDM和免疫原性检测尚未被广泛应用于风湿免疫病的常规临床实践,且缺少指导性文件。本文对近10年来风湿免疫病治疗领域生物制剂开展TDM的研究进行分析和总结,为该类药物的个体化用药提供理论依据。
1 国内风湿免疫病治疗领域生物制剂的现状
国内外的指南对于一线方案控制不佳、不耐受或者复发的患者,推荐单用生物制剂或联合使用改善病情的抗风湿药(diseases modifying antirheumatic drugs,DMARDs)。生物制剂DMARD近年来发展迅速,截至2022年7月,国内批准用于治疗风湿免疫病的生物制剂包括肿瘤坏死因子α(TNF-α)抑制剂、白细胞介素(IL)拮抗剂、T细胞共刺激信号调节剂和作用于B细胞表面分子抑制剂(数据来源:https://www.nmpa.gov.cn/),见表1。同时,在风湿免疫病[RA、Pso、AS、系统性红斑狼疮(systemic lupus erythematosus,SLE)]中处于临床试验阶段的研究共有181项, 大部分研究处于Ⅰ期临床阶段(83项,占45.86%)和Ⅲ期临床阶段(66项,占36.46%)。RA适应证的临床研究最多,共75个,适应证为Pso、AS和SLE的研究分别有64、35和26项。按照针对的作用靶点分类排序,居前3位的靶点为TNF-α、IL-17A和B淋巴细胞活化因子/B淋巴细胞刺激因子(BlyS),分别有51、31和15项研究,其余居前列的作用靶点还包括IL-6RA、IL-6RB、APRIL、IL-12、CD80、IL-23p19和IL-12B(数据来源:http://www.chinadrugtrials.org.cn/)。

表1 国内上市的风湿免疫病治疗领域生物制剂Tab 1 Domestic listed biologic agents in the field of rheumatic and immunological diseases
2 常用生物制剂的药动学特点
生物制剂作为一类极性较大的大分子蛋白质药物,相对分子质量高达15 kDa,不易透过生物膜[6]。生物制剂的口服生物利用度极低,通常采用静脉注射、肌内注射或皮下给药,其中静脉注射是最常见的给药方式,无吸收过程,可快速发挥作用。肌内注射或皮下给药则吸收过程缓慢,达峰时间为1~8 d,生物利用度一般为50%~100%。生物制剂通常分布容积较小,局限分布于血管和组织间质空间,在肾脏分布较多,其次为肝脏、脾脏,脑中分布最少。该类药物主要通过蛋白水解酶分解代谢为较小的肽和氨基酸,以能源物质或蛋白质合成原料的形式被消除,很少经肾脏排泄,其半衰期较长,达数十日。风湿免疫病中常用生物制剂的药学特点见表2。

表2 风湿免疫病中常用生物制剂的药学特点Tab 2 Pharmaceutical characteristics of biologic agents that commonly applied for rheumatic and immunological diseases
3 生物制剂开展TDM的常用生物分析方法
因生物制剂特殊的药动学特点,其生物分析方法相对复杂[7]。目前,已有多种分析技术被开发用于生物制剂的定量分析,如酶联免疫吸附试验(ELISA)、放射免疫分析、电化学发光免疫测定、均相迁移率变动分析(HMSA)和液相色谱串联质谱方法(LC-MS/MS)等[8]。其中ELISA技术以其高灵敏、高通量的优势,成为目前最常用的方法,也是用于支持药动学数据的治疗性蛋白质定量的“金标准”[6,9]。近年来,生物制剂定性定量分析的LC-MS/MS法被开发出来,因具有高特异性、高准确度及可以实现多种分析物同时定量的优势,其逐渐成为免疫分析方法的补充或某些情况下的替代技术[10]。
大多数测定方法性能的研究结果显示,药物浓度和ADAs滴度之间存在良好的相关性[11]。但因生物制剂的复杂性,以及ADAs的存在等,均使得体内生物制剂的定量检测变得更难[12]。例如,ELISA法可能容易受内源性或外源性物质的干扰,特异性欠佳[7];LC-MS/MS法可能较难同时实现较好的灵敏度和重现性[13]。Iwamoto等[14]比较了LC-MS/MS、ELISA和微流控免疫分析三种方法检测非小细胞肺癌患者254份血浆中的贝伐珠单抗含量的差异,结果表明,三种技术几乎具有相同的相关性,并且LC-MS/MS和微流控免疫分析方法可能比ELISA法更精确。Gibson等[15]提出,ELISA法可能会受ADAs存在的极大影响,而在HMSA法中却未出现;将不同的已上市试剂盒和实验室自建方法进行性能比较,虽然显示药物浓度水平的相关性很好,但已观察到药物浓度的绝对值差异(英夫利昔单抗高达2.09 μg/mL)。如果针对特定阈值或浓度范围时,不同分析方法检测的绝对浓度差异也可能会对生物制剂的临床实践产生影响。生物制剂的主要生物分析方法比较见表3。
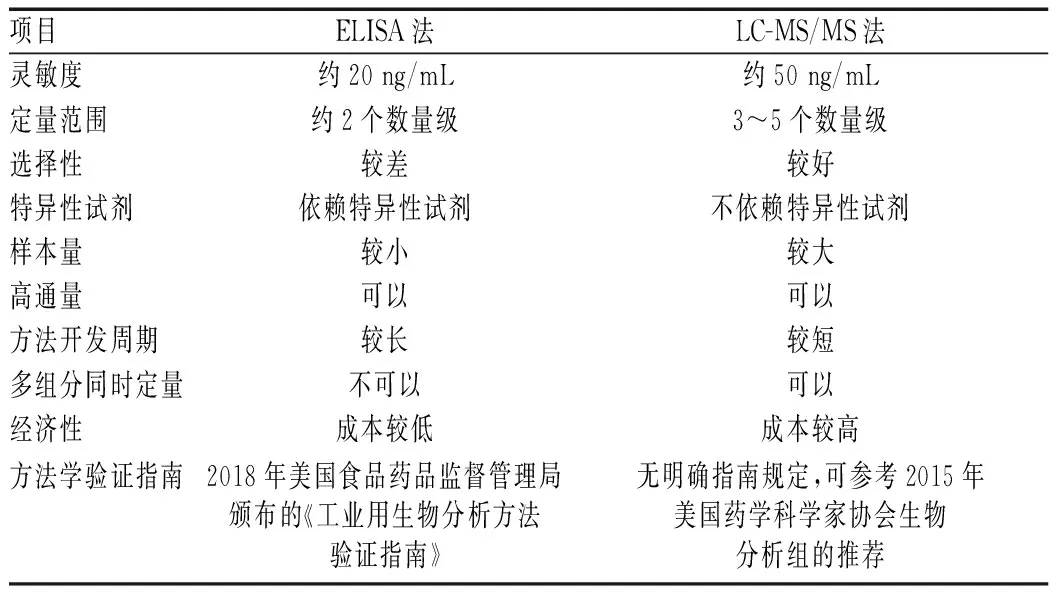
表3 生物制剂的主要生物分析方法比较Tab 3 Comparison of main bioanalytical methods for biologic agents
4 生物制剂开展TDM的临床研究
目前,在风湿免疫病领域对生物制剂DMARDs开展的TDM研究主要分为2种类型:一种为血药浓度与抗体水平之间的相关性研究,另一种为血药浓度或抗体与疗效或预后之间的研究,其中仅2项随机对照试验,见表2。由于TNF-α抑制剂上市较早,所以开展的TDM研究较多。大部分的数据表明,生物制剂浓度与药物的治疗效果呈正相关,而ADAs的出现往往预示着疗效较差或者治疗失败。多项研究结果支持阿达木单抗的谷浓度维持在5~8 μg/mL时,可以达到较好的治疗效果。英夫利昔单抗最佳谷浓度范围波动较大(0.2~7 μg/mL),谷浓度较低时,提示预后不良,ADAs形成或治疗失败。生物制剂临床研究中的量效关系汇总见表4。

表4 生物制剂临床研究中的量效关系汇总Tab 4 Summarize of dose-effective relationship in clinical studies of biologic agents
5 小结与展望
目前,大多数生物制剂浓度与较好的治疗效果之间存在正相关关系,在接受生物制剂治疗的风湿免疫性疾病患者中,与经验性给药或者反应性TDM相比,以达到阈值药物浓度为目的的主动性TDM更能使患者获益[33]。但在实际临床应用中,生物制剂TDM仍存在一些局限和问题:首先,大部分研究采用稳态谷浓度作为监测指标,但是监测时间不一致,甚至前后相隔42周,可能会影响终点事件的判断[23-24];其次,生物制剂TDM的分析技术仍存在诸多挑战,需要建立准确、可重复、适宜常规监测的分析方法,以促进基于TDM的生物制剂的临床实践;最后,因疾病类型不同和疗效判别的差异,造成目标浓度范围不一致[34]。因此,仍需要大样本量的前瞻性研究挖掘有效的生物制剂TDM靶标值并验证。

