新型冠状病毒抗原检测试剂性能评价相关研究进展
方慧玲, 陈子齐, 朱宇清
(上海市临床检验中心,上海 200126)
自2019年世界范围内的新型冠状病毒肺炎(corona virus disease 2019,COVID-19)疫情暴发以来,各国为应对疫情采取了不同的防控策略。我国采取动态清零的防控政策。新型冠状病毒核酸检测阳性是COVID-19确诊的首要标准,新型冠状病毒特异性抗体检测可作为未接种疫苗患者的诊断参考依据[1]。随着疫情防控形势的变化,相关部门规定了3类人群可以应用抗原检测进行自我检测或人员筛查[2],作为核酸检测能力不足时的补充。本文对我国新型冠状病毒抗原检测试剂盒性能和国内外相关研究进行综述。
1 新型冠状病毒病原学特征
新型冠状病毒属于β冠状病毒属,是有包膜的单股正链RNA病毒,病毒的颗粒直径约为100 nm。其基因组从5'端开始到3'端,分别有12个(ORF1a、ORF1b、S、ORF3a、E、M、ORF6、ORF7a、ORF7b、ORF8、N、ORF10)开放阅读框和3'端多聚腺苷酸尾[3]。S、E、M、N分别编码刺突(spike,S)蛋白、包膜(envelope,E)蛋白、膜(membrane,M)蛋白和核衣壳(nucleocapsid,N)蛋白4种结构蛋白。因冠状病毒的ORF1ab、N和E基因序列高度保守,现有的核酸检测方法均选择ORF1ab、N和E基因区域序列设计引物和探针。S基因是新型冠状病毒高度可变的基因,其编码的S蛋白(高度糖基化的Ⅰ型膜蛋白)通过与其受体结合进入宿主细胞[4],与病毒的传染能力密切相关。N蛋白则与病毒基因组宿主RNA相互识别,参与基因组复制和细胞信号通路调节。因此,免疫学检测系统通常选用针对N蛋白或S蛋白抗原表位的抗体进行系统构建。
2 新型冠状病毒抗原检测
从病毒进入人体到在人体样本中检测到新型冠状病毒抗原的这段时间被称为抗原检测的窗口期。人体在感染新型冠状病毒的平均5~6 d后会出现相应症状(部分人群无症状表现但也有传染力),病毒大量繁殖,呼吸道样本中病毒含量最高[5]。有文献报道,冠状病毒N蛋白抗原在临床症状出现前1 d就可被检测到[6]。有研究结果显示,N蛋白抗原在患者出现症状的第2天开始显著上升,并在出现症状的第2~7天达到峰值,随后开始下降[7]。
2.1 新型冠状病毒抗原检测技术
病原微生物抗原检测常用的方法有化学发光法(chemiluminescence immunoassay,CLIA)、电化学发光法(electrochemiluminescence assay,ECLIA)、酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)、侧向流免疫层析法(lateral flow immunochromatography assay,LFIA)。目前的新型冠状病毒抗原快速检测试剂主要是基于LFIA。
LFIA是一种快速免疫层析方法,已被广泛应用于临床多种病原微生物检测,与其他免疫学检测技术相比,其最大的特点就是快速、简便。检测卡主要由样品垫、结合垫、醋酸纤维素膜、吸水垫,以及用于支撑的聚氯乙烯背板卡盒组成。结合垫上包被有不同示踪技术的标记抗体,醋酸纤维素膜上有通过划线静电吸附的方式分别在测试线和对照线上包被单克隆抗体及抗标记抗体的二抗。当样品从进样孔进入样品垫后,样品中的新型冠状病毒抗原通过毛细作用迅速移动,与结合垫上的标记抗体结合,并进一步移动,与测试线上的单克隆抗体结合,而过量的标记抗体则继续移动,与控制线上的二抗结合。最终通过肉眼或特定仪器读取测试线和控制线上标记物的信号强弱来判定结果。近年来,随着量子点、上转发光、碳纳米管、纳米酶等新型技术与材料科学的发展,LFIA与传统的胶体金技术相比,检测性能更加稳定[8]。GRANT等[9]应用half-strip LFIA技术检测新型冠状病毒抗原,灵敏度可达0.65 ng/mL。
通过电化学、光学、微流控等生物传感技术也可实现病毒抗原定量检测。YAKON等[10]发明了一种新型纸基电化学传感器,将其应用于新型冠状病毒S抗原检测,最低检测限可达0.11 ng/mL,该方法为非标记定量技术,因此不需要依赖于任何抗体。材料科技的进步在大大提高生物样本检测灵敏度的同时也缩短了检测时间。仪器尺寸的缩小使设备的应用场景更为灵活,有学者研发出一种基于高密度导电纳米线阵列的柔性免疫传感器的智能口罩,小型化的阻抗电路和无线通信单元嵌入,以及<100 nm的纳米线尺寸和相邻纳米线间距,可成功锁定纳米级别的病毒颗粒,有效识别从口腔呼出气体中的冠状病毒S蛋白;对雾化气溶胶中冠状病毒的检测能力达到7 PFU/mL,耗时仅5 min[11]。
2.2 新型冠状病毒抗原检测试剂性能
尽管新型冠状病毒快速检测试剂具有简单、快速等诸多优点,但其临床检测性能一直存在争议。SCOHY[12]等对106份新型冠状病毒逆转录-聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)检测结果为阳性的鼻咽拭子样本进行了抗原快速检测,结果仅有32份(30.2%)阳性。而PORTE等[13]对82份鼻/口咽拭子样本的比对结果显示,其测试的快速检测试剂的敏感性和特异性分别为93.9%和100.0%。全球创新诊断基金会(the Foundation for Innovative New Diagnostics,FIND)在一项全球范围内的新型冠状病毒快速检测试剂评估计划中,评估了28个品牌的检测试剂[14],其中包括14个中国企业研发的试剂盒,截至2022年3月16日,已经完成评估的9家中国企业研发的10种试剂盒的评估数据显示,抗原检测试剂敏感度多为70.5%~92.1%,特异性多为98.3%~100%,≤7 d敏感度为74.2%~96.2%;检测RT-PCR循环阈值(cycle threshold,Ct)≤25的样品的敏感性为80.3%~100.0%,检测Ct值≤33的样品的敏感性为76.3%~100.0%。德国联邦疫苗及生物医学研究所(Paul-Ehrlich Institute,PEI)的性能评估数据也反映了相似的结果[15],其中部分中国品牌的检测试剂的验证结果显示,在Ct值≤25时,所验证试剂的敏感度均>85%;但在Ct值为25~30时,仅有3个品牌的试剂敏感度>85%;而当Ct值≥30时,所有品牌试剂的验证敏感度均<70%;各品牌试剂最终评估的总体临床灵敏度为34%~92%。RT-PCR检测的Ct值代表检测样本中的病毒载量,Ct值越低,说明检测样本中病毒载量越高,提示抗原检测的窗口时间要长于核酸检测;评估样本中病毒载量越高,受评抗原快速检测试剂的灵敏度也越高。FIND多中心研究数据[14]显示,即使同一个品牌的检测试剂,在不同的检测点呈现的性能参数也不一致,如印度地区的检测灵敏度比其他地区低,具体机制尚不明确,可能与印度地区的温度和湿度有关。有研究发现,当试剂盒于37 ℃温浴10 min后,再于37 ℃下进行检测,45.5%的试剂盒灵敏度下降了90%,随着时间的延长,灵敏度下降的试剂更多,而2~4℃环境则有可能使试剂盒的特异性降低[16]。值得注意的是,目前关于新型冠状病毒抗原检测试剂性能的研究均以核酸检测方法为参比方法,但不同方法学的核酸检测性能不尽相同,同一品牌的抗原检测试剂以不同的核酸检测方法为参比方法时,其性能评价结果也不同[17]。DINNES等[18]对新型冠状病毒抗原快速检测方法的相关研究进行了荟萃分析,发现不同品牌试剂盒的检测灵敏度存在显著差异。

表1 中国品牌新型冠状病毒抗原快速诊断试剂FIND的评估数据
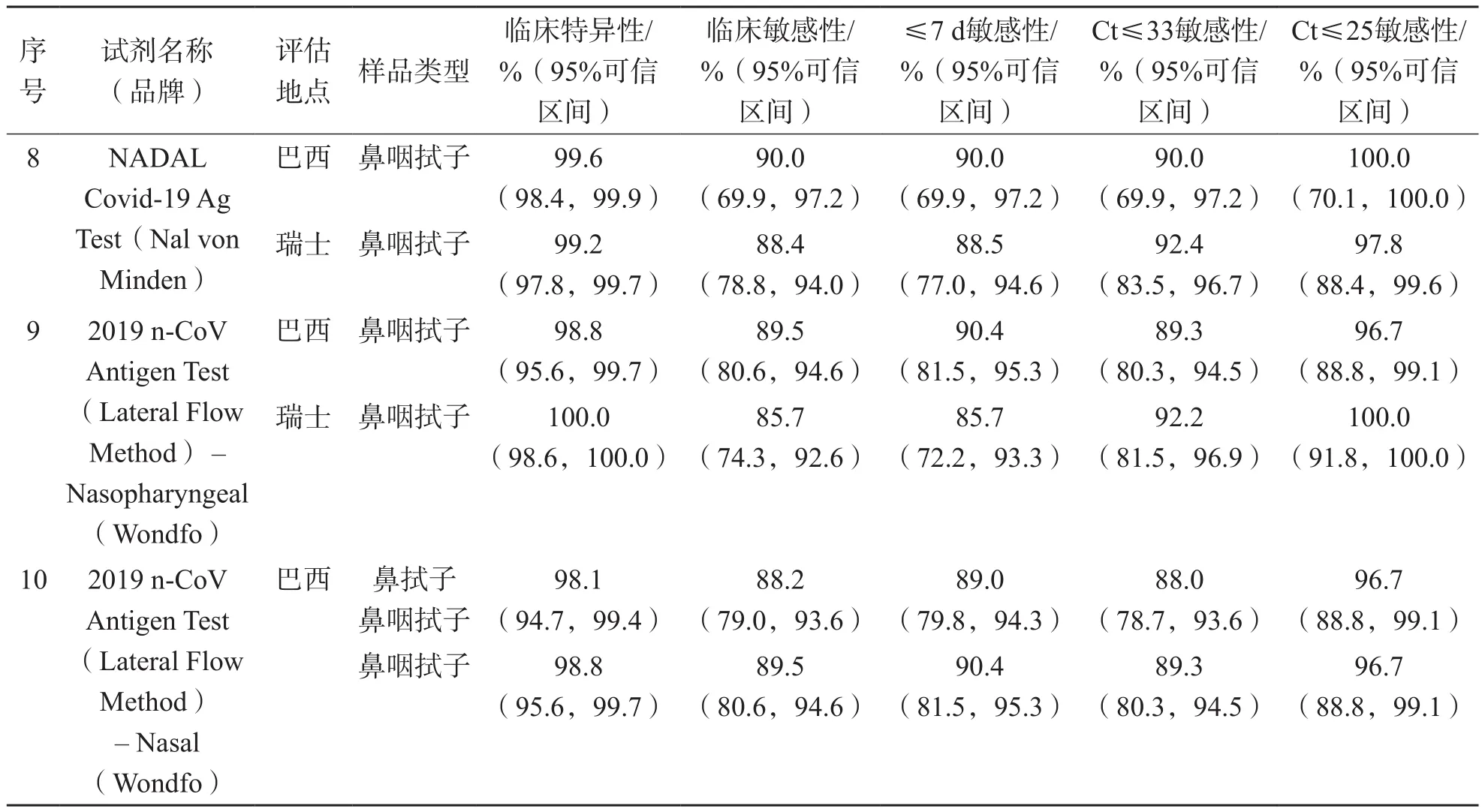
续表1
3 新型冠状病毒抗原检测的应用
截至2022年4月13日,美国食品药品监督管理局紧急授权使用CLIA、ECLIA、LFIA、MIFA和生物传感器等方法进行新型冠状病毒抗原检测的50个试剂,其中19个品牌试剂被授权用于家庭自测。我国国家药品监督管理局共批准了27个品牌新型冠状病毒抗原检测试剂作为国家应急储备。这27个品牌的抗原检测试剂均为基于LFIA的快速检测产品,均可在30 min内给出检测结果,差异在于部分试剂覆盖识别的抗原表位和标记显色技术不同。27种检测试剂中,有15种通过了PEI的性能验证,并被德国联邦药品和医疗器械管理局列入专业使用或家庭自测白名单。
世界卫生组织提出,新型冠状病毒抗原快速检测试剂在满足最低检测性能要求(敏感性80%,特异性97%)的情况下可用于有症状人群的检测[19]。定性检测方法的性能评价指标除灵敏度和特异性外,还包括检出限、重复性、符合率、阳性预测值、阴性预测值[20-21]。在方法开发过程中,增加灵敏度,就一定会损失一部分特异性,反之亦然。当灵敏度的增加幅度超过一定范围时(1-特异性),阳性预测值就会增加,反之将下降。但在有更为“准确”的验证方法的情况下,作为用于普通人群筛查的快速检测试剂,首先应该保证的是对“真阴性”人群的准确识别,提高其筛查的阴性样本为阴性的可能性(阴性预测值)。选择高灵敏度的检测方法,可以最大限度地减少漏诊活跃病例(假阴性)的可能性,快速切断传播链。而这些试剂在真实世界中检测的阳性结果,对于不同的应用场景,会有不同的解读:在发病率(患病率)为1%的地区或人群中,用敏感性为85%、特异性为98.9%的检测试剂对10 000人进行筛查,可检出阳性184例,但其中真实阳性的仅有85例,另外99例均为假阳性,此时阳性预测值仅为46.20%;但当该试剂被应用于发病率(患病率)为10%的地区或人群时,10 000人检测的阳性结果将会有940例,其中真阳性为850例,假阳性为90例,阳性预测值为90.43%;此时的阳性结果对于疾病诊断的指示作用大幅提高[18]。因此,世界卫生组织并不建议在预期患病率低的地区或人群中使用快速检测试剂。
2022年3—5月,新型冠状病毒奥密克戎变异株在上海市流行,当地政府对不同风险区域采取了差异化的筛查方式,抗原快速检测作为核酸检测的补充,有效弥补了大规模核酸检测耗时长的不足。对低风险地区增加抗原筛查,利用抗原检测速度快的特点,快速固定异常人群,以降低人员流动带来的疾病传播风险,提高检测效率。同时,在医院门急诊患者无有效核酸检测报告的情况下,可根据现场抗原筛查的阴性结果先行救治,在提升就医效率的同时,也避免产生医患矛盾。
4 讨论
现有的新型冠状病毒检测方法中,核酸检测只针对特定病毒基因的特定片段进行扩增,从方法学来说,其特异性为100%,因此是新型冠状病毒抗原检测准确与否的“金标准”。现有的核酸检测方法灵敏度多为10~150拷贝/反应,已有研究报道部分检测方法灵敏度可达到1拷贝/反应[17],是抗原检测的灵敏度的100~1 000倍。核酸检测具有严格的环境与仪器设备要求,需要熟练的操作人员,样本周转时间为4~6 h,甚至更长。而抗原检测快速、简便,可大大提升检测效率,推动防控哨点前移,在疾病流行时的人群筛查中有良好的辅助功能。对于抗原检测试剂的应用,有几个方面的问题需要持续关注。
(1)新型冠状病毒的变异性。与更早的毒株相比,奥密克戎株(B.1.1.529型)发生了重大变异,50个变异位点中有超过30个氨基酸位点的变异发生在S蛋白处。有学者[22]评估了商品化新型冠状病毒中和抗体对不同变异株的中和能力,发现44个中和抗体中,仅有6个单抗对奥密克戎毒株仍旧保持较强的中和能力,这6个单抗均识别奥密克戎或其他冠状病毒保守的抗原位点。提示S蛋白作为病毒的丰富的跨膜蛋白具有很强的免疫原性,同时其氨基酸序列的多样性也使其更容易与其他冠状病毒区别开,试剂开发者和专业的检测机构有必要采取一些措施来降低与新型冠状病毒突变相关的敏感性或无反应性导致假阴性结果的潜在风险。
(2)医学检测实验室开展抗原检测的质量保证。专业技术人员在项目开展前应对试剂性能进行充分的评估,必须关注每个批次的试剂质量。尽管快速抗原检测试剂卡上设计了控制线,可对试剂卡的有效性进行判断,但控制线呈反应性仅代表标记抗体完成了从结合垫到吸水垫的层析过程,并不能保证层析过程中标记抗体-抗原-单克隆抗体的结合反应。因此,专业技术人员面对大量检测样品时,应采用第三方质量控制产品确保实验室检测质量。此外,实验室应加强其分析前质量控制,规范技术人员样本采集。采样时,应使用试剂配套的样本保存液,不能使用被筛查人员核酸检测样本保存液内的样本进行抗原检测。
(3)自测人员应仔细阅读试剂说明书,按要求完成样本采集和检测。应规范处理检测产生的废弃物,尤其是检测结果为阳性时,应作为医疗废弃物交由专业人员处理。

