涟源市枣树叶斑病病原菌的鉴定
阳佳媛,林团雪,郝亚伦,廖 凯,金晨钟,2,郭开发,2
(1 湖南人文科技学院农田杂草防控技术与应用协同创新中心/农药无害化应用湖南省高校重点实验室,湖南娄底,417000;2 娄底市农业科学研究所,湖南娄底,417000)
枣树ZiziphusjujubaMill.在南方适应性强,耐贫瘠,抗干旱,产量高,经济效益好,可作为退耕还林、脱贫致富的支柱产业[1]。湖南省枣的种植范围越来越广,其中溆浦、衡阳、祁东等地是该省主要的枣种植区,枣生产在湖南省水果产业中具有重要的地位[2]。
我国枣树叶部病害主要报道有交链格孢菌Alternariaalternata引起的枣果缩果病和黑斑病[3],极细枝孢霉Cladosporiumtenuissimum引起的枣果褐斑病[4],葡萄座腔菌Botryosphaeriadothidea引起的枣果赤腐病[5]和冬枣轮纹病[6]。调查中发现,红枣叶斑病近年来呈加重趋势,发生率达10%~30%,受害叶片上形成红褐色圆形或不规则形、大小不一的斑点,边缘有黄色晕圈,部分斑点中央色浅,发生严重时枣树叶片、幼果早落,影响产量和品质。本研究对湖南省涟源市白马镇枣树叶斑病病原菌进行分离和鉴定,以期明确病原菌种类,为制订病害防治措施提供参考。
1 材料与方法
1.1 试验材料
2021年6月从湖南省涟源市白马镇采集枣树叶斑病病叶10份。病叶典型症状:枣叶形成红褐色圆形或不规则形、大小不一的斑点,边缘有黄色晕圈,部分斑点中央色浅。
1.2 试验方法
1.2.1 病原菌的分离与纯化
采用组织分离法[7]取典型患病枣叶,用75%乙醇擦拭并干燥,于病健交界处切下5 mm×5 mm小块,在超净工作台用1%次氯酸钠消毒1 min,用无菌水冲洗3次,滤纸干燥后接种到PDA平板,在培养箱中培养2 d后,在WA平板上进行单孢纯化,将纯化后获得的菌株保存在PDA斜面上,置4 ℃ 冰箱中贮存备用。
1.2.2 病原物鉴定
形态学鉴定。将病原物在PDA培养基、25 ℃恒温培养10 d后,采用压片法对菌落形态、色泽、分生孢子的特征进行观察,测量分生孢子的大小等。参照文献[8]和文献[9]等资料进行形态学特征鉴定。
分子鉴定。依据形态学鉴定结果,挑选代表菌株在PDA平板上培养5 d后,采用DNA提取试剂盒提取病原物的DNA,采用引物ITS1/ITS4[10]、Beta-2a/Beta-2b[11]和EF1-983F/EF1-728F进行PCR扩增。PCR反应体系:2×Easy Taq PCR SuperMix(+dye)25 μL、ITS1/EF1-983F 2 μL、ITS4 /EF1-728F 2 μL、DNA模板1 μL、ddH2O 20 μL,体积共50 μL。ITS基因序列PCR扩增反应程序为:94 ℃预变性4 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,共30个循环,最后72 ℃延伸10 min。延伸因子PCR反应程序为:94 ℃预变性4 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸40 s,共30个循环,最后72 ℃延伸10 min,反应完成后,1%琼脂糖凝胶电泳检测PCR反应产物。
将不同引物的PCR反应产物送生工生物工程(上海)股份有限公司进行测序。测序后的基因序列经校正后,在核酸序列数据库GenBank中进行同源序列(BLAST)搜索,比较供试菌株与现有数据库中相应序列同源程度。利用MEGA 7.0软件进行比对,构建系统发育树。
致病力测定。采集健康无伤、带有叶片的枣树枝条,用75%酒精进行表面消毒。将试管中的菌种在PDA平板上活化后,用灭菌打孔器(φ=5 mm)在培养菌落上取菌饼,将取好的菌饼接种在PDB液体培养基中,27 ℃、160 r/min振荡培养4 d,获得菌悬浮液,将其放在紫外光下照射2 d,诱导产孢,获得分生孢子悬浮液,加入无菌水调整至1×107个孢子/mL。将获得的分生孢子悬浮液喷洒在刺伤的枣树枝条的叶片上,以喷洒等量无菌水的枣树枝条叶片作为对照,每1个代表菌株接种处理设置3次重复,将接好的枣树枝条放在铺有湿润灭菌滤纸的保鲜盒中,枝干处用无菌湿润的脱脂棉包裹,置于25 ℃人工光照气候箱中培养。每天观察病斑生长情况,7 d后量取病斑直径,进行拍照记录。
2 结果与分析
2.1 病害症状
2021年6月于湖南省涟源市白马镇采集带有典型病斑的枣树病叶,病斑大部分位于叶片中间,叶片边缘偶有病斑,病斑圆形或椭圆形,边缘黑褐色,中央灰白色,外围有黄色褪绿晕圈(见图1)。

图1 叶片自然发病症状
2.2 菌落培养性状与形态特征
从发病叶片上共分离了12个菌株,菌株在PDA培养基上形态较为一致。从中挑选了5株代表菌株(ZjM2-6-2、ZjM2-3-1、ZjM5-2-3、ZjM5-1-1和ZjM4-1-2),占总单孢纯化菌株的41.7%。菌株接种在PDA培养基上,初期为白色;接种5 d后,菌落为灰白色,菌丝白色,具有发达的气生菌丝(图2A);接种菌株10 d后,菌落变为黑褐色,中央气生菌丝丰富(图2B)。经近紫外灯照射诱导产孢后,观察到其分生孢子,分生孢子呈梭形,光滑,无隔膜,平均大小为 (15.0~20.0)μm×(4.5~6.5)μm(图2C)。

A:培养5 d 后的菌落;B:培养10 d 后的菌落;C:分生孢子
2.3 分子生物学鉴定
以5株代表菌株的基因组DNA为模板,对其28SrDNA-ITS、EF-1α基因进行PCR扩增,其ITS和引物因子扩增条带大小分别为 560 bp和1 230 bp。基于ITS测出的序列提交至Genbank,获得的基因登录号分别为MZ558056、MZ558057、MZ558058、MZ558059和MZ558060。将代表菌株ZjM2-6-2序列与相关序列在MEGA7.0中构建系统发育树,结果表明,菌株ZjM2-6-2与葡萄座腔菌B.dothidea的MH393518.1、LC168758.1、KF293945.1和EU520229.1在同一分支,且与葡萄座腔菌B.dothidea序列同源性为100%(见图3)。
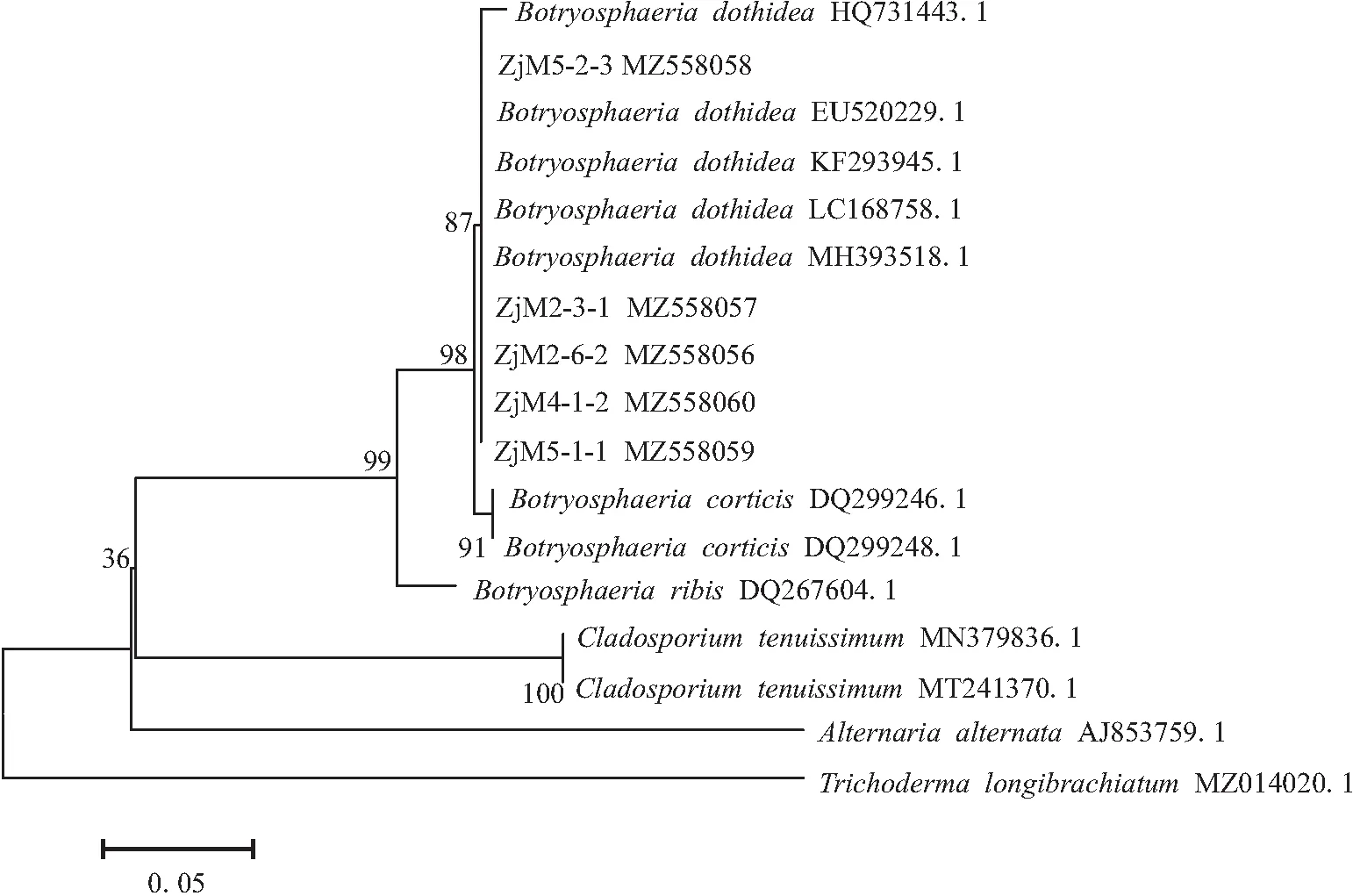
图3 代表菌株基于ITS基因的系统发育树
2.4 病菌致病性测定
在室内条件下,采用离体接种处理,将代表性菌株ZjM2-6-2和其他分离菌株的分生孢子悬浮液分别接种在健康枣树枝条的刺伤叶片上,并设置无菌水接种作为对照,置于保鲜盒中的湿润无菌滤纸上,用无菌湿润脱脂棉包裹枝干。结果显示,接种5 d后,对照的叶片未发病,刺伤接种病原菌的叶片观察到病害症状,病斑直径约6 mm,圆形或椭圆形,边缘红褐色,病斑周围有一圈黄色褪绿晕圈,中央黄白色。这些症状与自然条件下的枣树叶斑病症状基本相似(见图4)。将接种发病的叶片再次采用组织分离法进行菌株分离,采用形态学特征结合rDNA-ITS、EF-1α序列分析,鉴定出该病原菌为葡萄座腔菌。

图4 代表性菌株致病性试验
3 讨论与结论
B.dothidea是葡萄座腔菌属中最常见的种类,寄主范围广,可使20科34属50余种植物致病。B.dothidea属于弱寄生菌,能引起叶斑、枝梢枯萎、枝干溃疡、果实腐烂等多种果树病害症状,造成严重的经济损失[12-14]。已有文献报道,B.dothidea可引起樱桃叶斑病[15]、枣树干腐病[16]、冬枣轮纹病[17]和黄桃烂果病[18]等,而葡萄座腔菌可以引起厚叶南五味子[19]、中华常春藤[20]和桂花[21]等植物的叶斑病。
有关枣树叶斑病的病原物的研究报道较少,不同地区叶斑病的致病病原菌不一致。已有文献报道,新疆地区的红枣叶斑病通过致病性测定、形态学观察和分子生物学鉴定,将其病原菌鉴定为交链格孢菌Alternaria.alternata(Fries) Keissle[22];宁夏地区的枣树叶斑病病原菌有半知菌亚门真菌中的枣叶橄榄色盾壳霉Conithyriumaleuritis和枣叶斑点盾壳霉Coniothyrium.fuckelii[23]。通过此次对枣树叶斑病的病原菌进行鉴定,可以为湖南省涟源市枣树叶斑病的防治提供一定的理论依据,也可为相似气候和地形条件下的枣树叶斑病的防治提供一定的参考价值。
本研究从湖南省涟源市白马镇枣树叶片上分离获得病原菌5株,对其进行培养性状观察、形态学和分子生物学鉴定。结果发现,病原菌与葡萄座腔菌Botryosphaeriadothidea基本一致,rDNA-ITS和EF-1α两个基因序列与葡萄座腔菌的序列的同源性为100%,在构建系统发育树时也与葡萄座腔菌聚在同一分支上。结合致病性试验,可将该病原物鉴定为葡萄座腔菌Botryosphaeriadothidea。

