双色法和三色法检测NK细胞杀伤功能的实用性比较
陈晓燕 阳莉 蔡惠宁 李翠平 卢建溪
自然杀伤细胞(Natural killer cell,NK cell)是具有主要组织相容性复合体(major histocompatibility complex,MHC)非限制性杀伤特点的先天性免疫细胞,是人体抵御肿瘤和病毒感染的第一道防线[1-2]。NK 细胞活化后通过分泌细胞因子、趋化因子,增强细胞毒功能发挥自然杀伤功能[3],NK细胞还有较强的免疫调节功能,在机体免疫监视和早期抗感染和免疫过程都起着重要作用[4]。NK细胞对细胞免疫治疗效果具有重要意义,而评估NK 细胞活性的主要方法是通过检测外周血或体外诱导扩增培养NK 细胞的杀伤功能[5-6]。
本研究采用流式细胞检测方法联合应用CFSE与Annexin-V/7-AAD 三色荧光染色法和CFSE 与PI 双色荧光染色法检测不同效靶比以及不同孵育时间的NK 细胞对K562 细胞的杀伤功能。
1 材料与方法
1.1 样本来源
K562 白血病细胞株为本实验室保存;所有外周血样本取自2019 年至2021 年中山大学附属第三医院健康志愿者,癌症肿瘤患者排除纳入,共计20 名,平均年龄(59±8)岁,本研究获得本院伦理委员会批准,受试者均签署知情同意书。
1.2 主要试剂和仪器
ALYS505NK-AC 培养液和ALYS505NK-EX培养液购自日本CSTI 公司,RPMI1640 培养液和胎牛血清FBS 购自美国Gibco 公司,DMSO 购自德国Sigma 公司,赫赛汀购自美国Roche 公司,rhIL-2 重组人白细胞介素-2 购自山东泉港药业,淋巴细胞检测试剂盒CD45/CD56/CD19/CD3 购自美国Bechman Coulter 公司,CFSE 购自美国Thermo Fisher Scientific 公司,PE-Annexin-V/7-AAD 荧光凋亡检测试剂盒购自孟加拉国BD 公司,PI 溶液购自德国Sigma 公司,PBS 缓冲液购自美国Gibco公司,Centrifuge 5702R 离心机购自德国Eppendorf公司,Sorvall ST16R Centrifuge 离心机购自美国Thermo Scientific 公司,CU600 型电热恒温水箱购自中国Bluepard,二氧化碳培养箱240i 购自美国Thermo Scientific 公司,CytoFLEX 流式细胞分析仪购自美国Bechman Coulter 公司。
1.3 方法
NK 细胞对K562 细胞的杀伤检测分2 组,分别采用2 种不同染色方法,A 组:CFSE/Annexin-V/7-AAD 三色荧光染色;B 组:CFSE/PI 双色荧光染色。
1.3.1 效应细胞(NK 细胞)的准备
肝素钠抗凝管采集的外周血,通过密度梯度离心法分离出单个核细胞(PBMC),用ALYS505NK-AC 培养液重悬细胞,调整细胞密度为(1~3)×106/mL,加入预先用赫赛汀包被好的培养瓶中,于37℃、5% CO2培养箱培养。每隔3 d 用ALYS505NK-EX 培养液进行补液。收集培养14 d的细胞,使用淋巴细胞检测试剂盒CD45/CD56/CD19/CD3 在流式细胞仪上测定NK 细胞(CD3-CD56+)含量,用含10%FBS 的RPMI1640 培养基重悬细胞,调整细胞浓度为1×106/mL、2×106/mL。
1.3.2 靶细胞(K562 细胞)的准备
K562 细胞培养于含10%FBS 的RPMI1640 培养液中,置于37℃,5%CO2培养箱中培养,每隔3 d换液。收集生长状况良好的K562 细胞,用PBS 缓冲液洗涤两次,用含0.1%FBS 的PBS 重悬细胞,并将细胞分为A 组和B 组,每组准备4 管细胞,每管细胞的细胞浓度均为1×106/mL。在A 组和B 组的每管细胞中分别加入荧光染料CFSE 对靶细胞进行标记,37℃避光,水浴20 min;加入5 倍体积预冷的含10%FBS 的RPMI1640 培养基,冰浴5 min,终止反应;PBS 洗涤两次,用含10%FBS 的RPMI1640培养基重悬细胞调整细胞浓度至1×106/mL。
1.3.3 效-靶细胞共培养
效应细胞按照细胞数2×106/mL、1×106/mL,与标记好的靶细胞按照效靶比10∶1、20∶1 分别加入24 孔无菌培养板中,每孔设3 个复孔,并设对照孔只加靶细胞,用于检测靶细胞自发死亡率。将细胞培养板中的效应细胞与靶细胞轻轻混匀,室温,1 600 r/min,离心3 min(离心半径13.9 cm),以使细胞紧密接触。37℃、5%CO2培养箱孵育。
1.3.4 使用荧光凋亡检测试剂盒测定NK 细胞对K562 细胞的杀伤功能
分别取1 h、2 h、3 h、4 h 四个时间点的共培养细胞转入流式管中,用PBS 缓冲液洗涤两次后重悬细胞。A 组细胞加入Annexin-V 和7-AAD 各5 μL 标记细胞,B 组细胞加入PI 5 μL 标记细胞,混匀,室温避光孵育15 min。加入500 μL 缓冲液,室温,2 200 r/min,离心3 min(离心半径13.9 cm),洗涤1 次后,加入200 μL 缓冲液重悬。用CytoFLEX 流式细胞仪进行检测,CytExpert 获取和分析数据。
计算公式:靶细胞杀伤率(%)=(靶细胞死亡率-靶细胞自发死亡率)/(100-靶细胞自发死亡率)×100%
1.3.5 统计学处理
采用Excel、Prism 6 和IBM SPSS Statistics 25.0统计软件进行数据处理;计量资料采用(±s)表示,使用Shapiro-Wilk 方法检验数据是否服从正态,用Levene's 方法检验数据的方差是否有差异,对总体实验结果进行三因素方差分析,使用配对样本t检验进行进一步的两两比较;以P<0.05 为差异有统计学意义。
2 结果
2.1 NK 细胞培养结果
初始培养时NK 细胞占PBMC 的比例仅为(6.15±7.29)%,培养到第14 天,NK 细胞比例增至(48.83±27.28)%。
2.2 CFSE 标记靶细胞结果
CFSE 均能对密度为1×107/mL 的靶细胞进行有效标记,对靶细胞的标记率均可达99%以上。见图1。
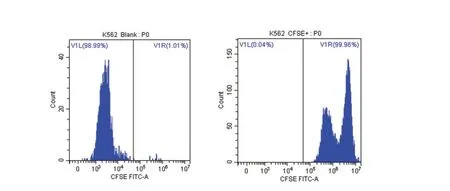
图1 靶细胞经CFSE 标记前后荧光强度变化Figure 1 Changes of fluorescence intensity of target cells labeled with CFSE
2.3 NK 细胞(CD3-CD56+)对靶细胞(K562)的杀伤功能
CFSE/PI 双色法圈定目的细胞,分出CFSE阳性的细胞(图2 中直方图P2),在门P2 中分析凋亡细胞(图2 中直方图Q2)。在CFSE+细胞群中,CFSE+PI-为正常靶细胞,CFSE+PI+为发生凋亡的靶细胞。NK 细胞对靶细胞杀伤功能越强,靶细胞凋亡值越大,从图2 可知,随着效靶比由10∶1 增加为20∶1,NK 细胞杀伤靶细胞功能越强;随着共培养时间越长,NK 细胞杀伤靶细胞功能越强。
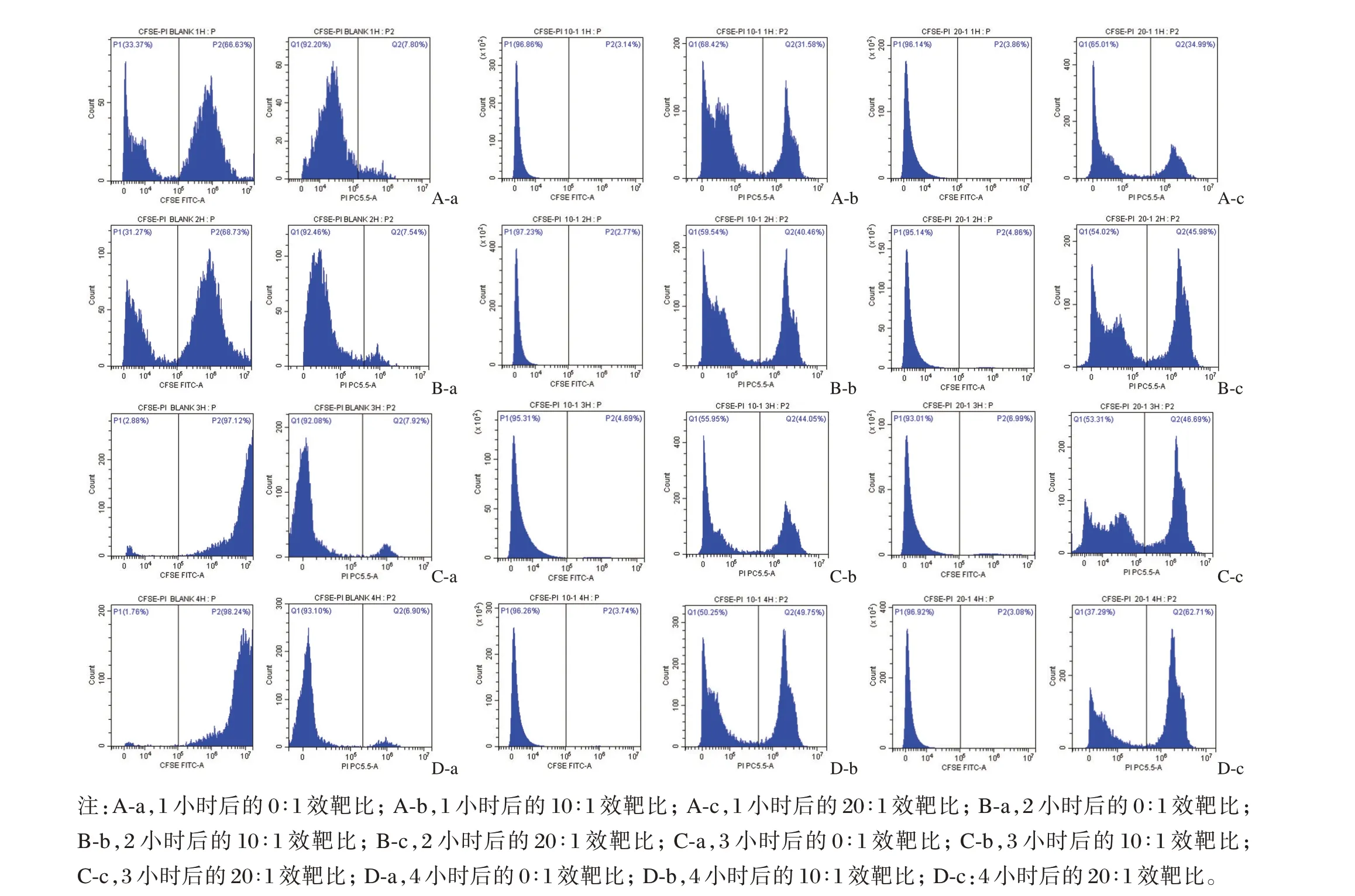
图2 CFSE/PI 双色法检测NK 细胞对K562 细胞的杀伤功能Figure 2 CFSE/PI to detect the killing function of NK cells on K562 cells
CFSE/Annexin-V/7-AAD 三色法圈定目的细胞,分出CFSE 阳性的细胞(图3 中直方图P2),在P2 中分析早期凋亡和中晚期凋亡细胞(图3 中十字门散点图)。CFSE 可有效地将效应细胞和靶细胞区分开,CFSE+为靶细胞,在CFSE+细胞群中,Annexin-V 和7-AAD 双标记将靶细胞分为Annexin-V-7-AAD-、Annexin-V-7-AAD+、Annexin-V+7-AAD+、Annexin-V+7-AAD-4 个组群,其中CFSE+Annexin-V-7-AAD-为正常靶细胞、CFSE+Annexin-V+7-AAD-为早期凋亡的靶细胞,CFSE+Annexin-V+7-AAD+为中晚期凋亡的靶细胞。NK 细胞对靶细胞杀伤功能越强,靶细胞凋亡值越大,从图3 可知,随着效靶比由10∶1 增加为20∶1,NK 细胞杀伤靶细胞功能越强;随着共培养时间越长,NK 细胞杀伤靶细胞功能越强。
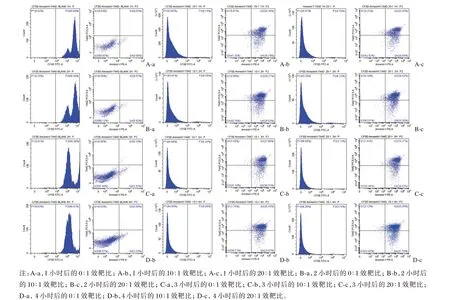
图3 CFSE/Annexin-V/7-AAD 三色法检测NK 细胞对K562 细胞的细胞毒作用Figure 3 CFSE/Annexin-V/7-AAD to detect the killing function of NK cells on K562 cells
NK 细胞对K562 白血病细胞株的杀伤结果显示:检测方法的差异性不受效靶比和共培养时间影响,交互作用不明显(F=0.039,P=0.990),差异无统计学意义(P>0.05)。见表1。在4 个时间点实验组,效靶比为10∶1、20∶1 时,NK 细胞杀伤功能(%)两两比较,三色法NK 细胞杀伤功能显著高于双色法,差异有统计学意义(P<0.05)。见表2。在4 个时间点,效靶细胞共培养4 h 时NK 细胞杀伤功能最强;在不同效靶比实验组,两种染色方法都检测出在效靶比20∶1 时,NK 杀伤功能显著高于效靶比10∶1。见图4。
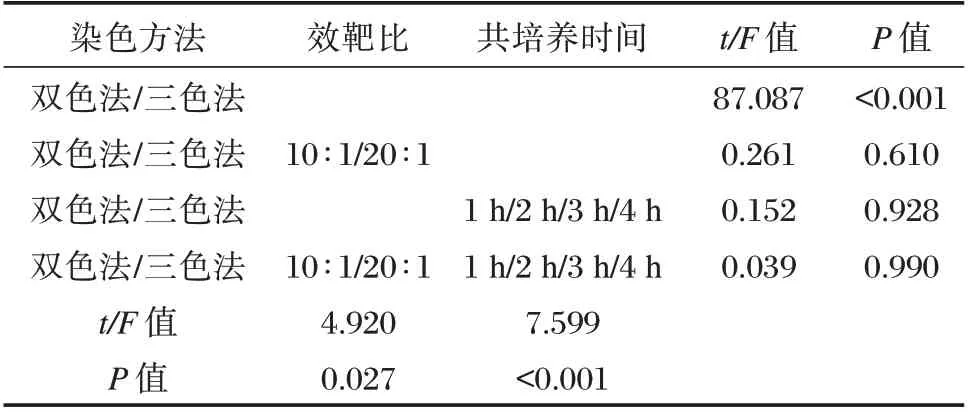
表1 两种染色方法检测NK 细胞对靶细胞在不同效靶比及不同时间组的杀伤效果的三因素方差分析Table 1 Three-way ANOVA of two staining methods were used to detect the killing effect of NK cells on target cells in different effect target ratio and different time groups
表2 两种染色方法检测NK 细胞在20∶1 和10∶1 效靶比下对靶细胞的杀伤功能(n=20,±s)Table 2 The killing function of NK cells to target cells was detected by two staining methods at 20∶1 and 10∶1 target ratios(n=20,±s)
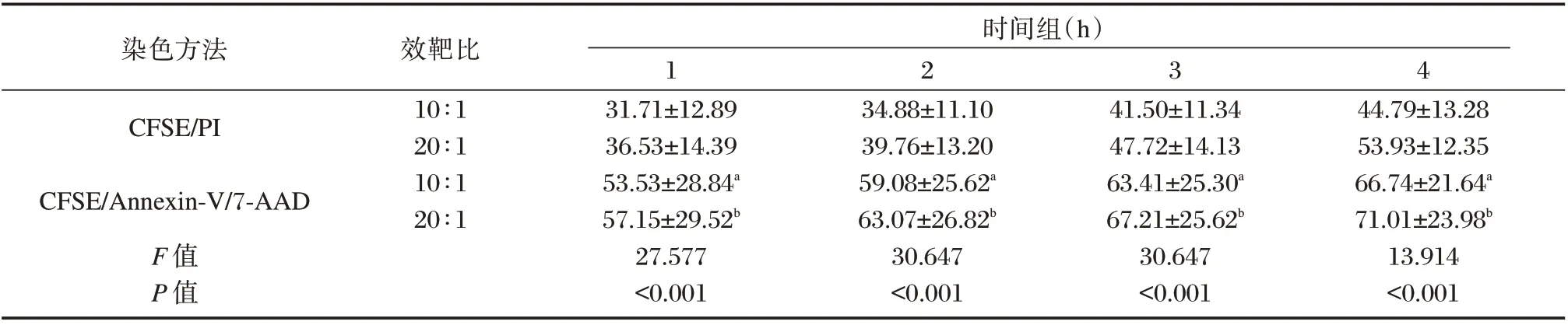
表2 两种染色方法检测NK 细胞在20∶1 和10∶1 效靶比下对靶细胞的杀伤功能(n=20,±s)Table 2 The killing function of NK cells to target cells was detected by two staining methods at 20∶1 and 10∶1 target ratios(n=20,±s)
注:与CFSE/PI 染色方法效靶比为10∶1 组比较,aP<0.05;与CFSE/PI 染色方法效靶比为20∶1 组比较,bP<0.05。
染色方法时间组(h)效靶比10∶1 20∶1 10∶1 20∶1 3 2 4 CFSE/PI CFSE/Annexin-V/7-AAD F 值P 值1 31.71±12.89 36.53±14.39 53.53±28.84a 57.15±29.52b 27.577<0.001 34.88±11.10 39.76±13.20 59.08±25.62a 63.07±26.82b 30.647<0.001 41.50±11.34 47.72±14.13 63.41±25.30a 67.21±25.62b 30.647<0.001 44.79±13.28 53.93±12.35 66.74±21.64a 71.01±23.98b 13.914<0.001
3 讨论
近年来,活化的NK 细胞的调节免疫功能和细胞杀伤作用已成为免疫治疗研究的热点[7-8]。有研究表明,肿瘤患者外周血中NK 细胞活性随着临床分期升高呈负相关,因此,NK 细胞活性的检测对评估肿瘤患者病程和预后都具有重要的指导意义[9]。
目前检测免疫细胞细胞毒活性常用的方法主要有同位素标记法、酶反应比色法和流式细胞技术三大类,而流式细胞术广泛用于免疫学研究,在单细胞水平上监测细胞信号变化,较其他方法更为准确[10]。研究通过流式细胞术结合示踪荧光染料CFSE 对靶细胞进行荧光标记,在单细胞水平上根据CFSE 具有很高的荧光活性和稳定性,有效地将靶细胞和效应细胞区分开,检测结果不受效应细胞的影响[11-12]。
本研究通过比较CFSE/PI 两色法和CFSE/Annexin-V/7-AAD 三色法两种荧光标记染色方法,检测在不同效靶比、不同共培养时间的NK 细胞杀伤功能,结果显示三色法更为灵敏。此外,CFSE/PI 两色法的优点是单染色法,上流式调节补偿更为简便。缺点是虽然能特异性地检测靶细胞的凋亡,但检测不到早期凋亡的靶细胞。CFSE/Annexin-V/7-AAD 三色方法不但能检测出中晚期凋亡细胞,还能检测早期凋亡细胞。其原理是Annexin-V 是检测细胞早期凋亡的灵敏指标,Annexin-V/7-AAD 能与细胞凋亡过程中翻转到膜外的膜磷脂酰丝氨酸(PS)高亲和力特异性结合,可以检测出靶细胞中早期和中晚期凋亡的情况,从而计算出效应细胞的杀伤功能[13-15]。若对靶细胞凋亡需要进一步分析,三色法较两色法更优。
综上所述,两种染色方法均能对不同的靶细胞进行有效标记,均能检测NK 细胞杀伤功能。但由于CFSE/Annexin-V/7-AAD 三色方法早、中晚期凋亡细胞都能区分开来,有利于后续的实验研究。CFSE/Annexin-V/7-AAD 三色方法较CFSE/PI两色法能更直观呈现靶细胞凋亡状态,且重复性好、灵敏度高。