不同分布区胀果甘草原生境土壤微生物群落结构特征及其影响因素
王倩倩,陆嘉惠,4,*,张 洁,徐 影,徐 可,张迦得,刘登奎
1 石河子大学生命科学学院, 石河子 832003 2 绿洲城镇与山盆系统生态兵团重点实验室, 石河子 832003 3 新疆植物药资源利用教育部重点实验室, 石河子 832003 4 石河子大学甘草研究所, 石河子 832003
土壤微生物主要由土壤细菌、古生菌和真菌组成,广泛分布在根际和非根际土壤中,与植物体互惠共生,其多样性和丰富度对植物的多样性,调节土壤微环境和养分循环等生态系统功能起着关键作用[1—6]。研究表明,植被可能会影响土壤的物理和化学性质,进而影响土壤的细菌群落和组成[7],同时微生物的种群结构和代谢产物也可以调控药用植物的生长,提高植物的抗性,影响植物的分布[8—9]。
胀果甘草(Glycyrrhizainflata)是《中国药典》中记载的三种药用甘草基原植物之一,野生胀果甘草主要分布于新疆塔里木盆地和东疆吐哈盆地,在甘肃也有少量分布[10—12],其原生境土壤盐渍化程度较重,表层土壤总体含盐量较高,在三种药用甘草中,胀果甘草耐盐能力最强,具有抗寒、抗旱、抗盐碱等优良特性,能有效改良盐碱地土壤[13],从中提取出的多种化学成分在制药和加工材料等方面也有着很高的利用潜力,兼具重要生态价值和经济价值[14—16]。
药用植物原生境土壤微生物群落结构和多样性特征,是揭示药用植物、土壤、微生物相互关系,挖掘土壤中优势菌群,探寻药用植物种群分布及道地性形成影响因素的重要依据。有研究表明,不同生境的黑果枸杞根际与非根际土壤的细菌、真菌优势类群(门、属)的组成以及丰富度存在地区间差异[17]。孙晓等对干旱区沙生药用植物锁阳的土壤微生物群落研究发现了不同产区土壤微生物群落多样性的差异,并发掘了5个共有核心微生物组[18]。目前,已有五味子、细辛、百合等20种药用植物研究明确了影响土壤微生物多样性的因素和土壤微生物与药用植物的关系,并筛选了生防菌株[19]。重楼根际土壤研究发现了重楼根际土壤真菌、根内生菌、根茎内生菌中的优势菌群[20]。目前对药用甘草土壤微生物的研究主要在乌拉尔甘草内生菌的分离和应用、根际微生物、丛枝菌根的研究等方面[21—24],缺乏野生胀果甘草原生境土壤微生物群落结构及多样性的研究,因此在揭示胀果甘草种群分布与土壤微生物关系、优势土壤菌群和盐碱弃耕地修复机制、药材道地性的影响因素方面缺少依据。
本研究系统、全面地进行了野生胀果甘草分布区的原生境土壤调查,从胀果甘草5个主产区采集原生境土壤,测定土壤理化指标,并采用高通量测序技术,结合Spearman、dbRDA方法开展以下研究:揭示不同分布区的微生物群落结构和多样性特征;发掘胀果甘草原生境土壤的优势或特殊真菌、细菌群落;微生物群落、土壤理化性质、物种地理分布相关性分析。为弃耕盐碱地的修复机制、野生胀果甘草种群恢复和药材道地性研究提供理论依据。
1 材料和方法
1.1 研究区概况
按照新疆植物志[25]记载的胀果甘草分布区,在新疆阿拉尔、库尔勒、哈密、鄯善,甘肃瓜州5个主产区(标记为Z1—Z5)采集土壤样本。5个分布区均为干旱半干旱荒漠地区,温带大陆性气候,夏季炎热,冬季寒冷,昼夜温差大;全年晴天多,光照充足,降水稀少;年降水量仅为35—60 mm,年平均气温为8.98—11.67℃。野生胀果甘草伴生植物主要有芦苇(Phragmitesaustralis)、拂子茅(Calamagrostisepigeios)、骆驼刺(Alhagisparsifolia)、苦豆子(Sophoraalopecuroides)、白刺(Nitrariatangutorum)、柽柳(Tamarixchinensis)、猪毛菜(Salsolacollina)等。
1.2 样地设置和样品采集
土壤采样点信息见表1,5个分布区,每个分布区设3个样地,共15个采样地。每个采样地根据研究区域胀果甘草生长状况、分布特点等差异,按W型每隔50 m选取1个有胀果甘草均匀分布的样点,共5个样点(面积为2 m×2 m),在每样点按V型选取3个重复土样[26],采集0—30 cm的土壤,将取到的土样混合置于平铺的牛皮纸上捏碎混合均匀,按四分法(取对角线)制成混合土样后,分装3份。一份置于铝盒中用于测定土壤含水量(Soil Water Content, SWC)和pH值;一份置于密封袋中带回实验室自然风干后剔出植物根系及石砾等杂物,磨碎,过100目筛,用于测定土壤有机碳(Total Organic Carbon, TOC)、总氮(Total Nitrogen, TN)和总含盐量(Total Dissolved Salts, TDS)。最后一份置于PV离心管中迅速液氮冷冻后保存于-80℃冰箱,用于土壤微生物测序。
1.3 研究方法
1.3.1 土壤理化性质
土壤理化指标的测定采用常规分析法[27]。土壤含水量(SWC)测定采用干燥法。土壤pH值用pH计测定。土壤有机碳(TOC)测定采用重铬酸钾容量法。土壤总氮(TN)测定采用半微量开氏法。土壤总含盐量(TDS)测定采用残渣烘干法。
1.3.2 测序方法
土壤DNA提取、PCR扩增和单端测序均由北京康普森生物技术有限公司完成。采用 SDS-CTAB 方法对来自5个地区共计15个土壤样本的基因组 DNA 进行提取。利用16S rRNA的保守区设计通用引物扩增16S/18S/ITS的区域。以稀释后的基因组 DNA 为模板,根据测序区域的选择,使用带 Barcode 的特异引物(表2)进行扩增,得到相应的产物。
PCR反应体系为Phusion Master Mix (2×)15 μL,Primer (2 μM) 3 μL,gDNA (1 ng/μL) 10 μL, H2O 2 μL。反应程序为98℃预变性1 min;30个循环(98℃,10 s;50℃,30 s;72℃,30 s) ;72℃,5 min。PCR产物使用2%浓度的琼脂糖凝胶进行电泳检测,剪切回收目标条带。

表1 野生胀果甘草原生境土壤样品采集点

表2 野生胀果甘草原生境土壤样品PCR扩增引物
新古菌16S: 古菌1106F:真核生物18S: 真菌ITS:文库构建和上机测序:根据所扩增区域的特点,基于IonS5TMXL测序平台,利用单端测序(Single-End)的方法,构建小片段文库进行单端测序。使用Thermofisher 公司的Ion Plus Fragment Library Kit 48 rxns 建库试剂盒进行文库的构建,构建好的文库经过Qubit 定量和文库检测合格后,使用Thermofisher的Ion S5TMXL上机测序。
1.4 数据处理
1.4.1 测序数据处理
使用Cutadapt[28](V1.9.1, http://cutadapt.readthedocs.io/en/stable/)先对reads进行低质量部分剪切,再根据Barcode从得到的reads中拆分出各样品数据,截去Barcode和引物序列初步质控得到原始数据(Raw reads)。经过以上处理后得到的Reads需要进行去除嵌合体序列的处理,Reads序列通过[29](https://github.com/torognes/vsearch/)与物种注释数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列[30],得到最终的有效数据(Clean Reads)。
1.4.2 OTU聚类和物种注释
利用Uparse软件[31](Uparse v7.0.1001,http://www.drive5.com/uparse/)对所有样品的全部 Clean Reads 进行聚类,默认以97%的一致性(Identity)将序列聚类成为OTUs(Operational Taxonomic Units),选取OTUs的代表性序列。对OTUs序列进行物种注释,用Qiime软件(Version 1.9.1)中的blast方法(http://qiime.org/scripts/assign_taxonomy.html)[32]与Unit(v7.2)数据库[33](https://unite.ut.ee/)进行物种注释分析。使用MUSCLE[34](Version 3.8.31,http://www.drive5.com/muscle/)软件进行快速多序列比对,得到所有OTUs序列的系统发生关系。最后对各样品的数据进行均一化处理,以样品中数据量最少的为标准进行均一化处理,后续的Alpha多样性分析和Beta多样性分析都是基于均一化处理后的数据。使用R软件绘制venn图,Origin、Visio软件绘制物种相对丰度柱形图,并用vcd包 ternaryplot命令进行Ternaryplot三元相图分析。使用ArcMap软件导入采样点,Visio软件绘制丰度前三的优势真菌和细菌种类图。
1.4.3 多样性指数分析
多样性指数显著差异柱形图使用Origin、Visio软件绘制。β多样性:用Qiime软件(Version 1.9.1)计算Unifrac距离,使用R软件(Version 2.15.3)绘制PCoA图,PCoA可以通过样品之间的聚集和分开情况来判断群落结构差异度。使用R软件进行Beta多样性指数组间差异分析。LEfSe分析使用LEfSe软件,默认设置LDA Score的筛选值为4。组间差异显著的物种分析利用R软件做组间T_test检验并作图。
1.4.4 理化性质特征和环境因子关联分析
SPSS软件对数据进行单因素方差分析,Origin软件、Visio软件绘制理化性质的方差分析柱形图。在进行Spearman相关性分析时,首先用R中psych包的corr.test函数计算物种和环境因子的Spearman相关系数值并检验其显著性,然后用Origin软件绘制热图。使用vegan包中的rda函数进行的排序分析,然后使用非冗余的环境因子进行dbRDA分析。
2 结果
2.1 土壤真菌和细菌OTU水平分析
过滤出低质量和短序列reads后,ITS测序共得到1129760条cleanreads,有效序列的平均长度为244bp。16S测序共得到1201313条reads,有效序列的平均长度为253bp。得到有效数据后进行OTUs聚类。图1中显示,Z1—Z5通用的真菌OTUs为524个,特有的真菌OTUs数分别为248、199、154、177和201个。Z1—Z5共有的细菌OTUs为1813个,特有的细菌OTUs数分别为1295、1058、567、785和802个。

图1 胀果甘草土壤真菌和细菌基于OTUs的维恩图Fig.1 Soil fungi and bacteria of Glycyrrhiza inflata are based on the Venn diagram of OTUsOTUs:Operational taxonomic units可操作分类单元;Z1:采集地新疆阿拉尔;Z2:采集地新疆库尔勒;Z3:采集地新疆哈密;Z4:采集地新疆鄯善;Z5:采集地甘肃瓜州
2.2 微生物群落组成
根据物种注释结果,胀果甘草分布区土壤样品中真菌和细菌群落属水平上的组成结构和相对丰度排名前十的物种如图2所示。真菌中,优势物种为曲霉菌属(Aspergillus)、地丝霉属(Geomyces)、镰刀菌属(Fusarium)。其中,相对丰度值最高的为曲霉菌属(Aspergillus),在各分布区均有分布,但丰度不同,在Z3.2、Z3.3、Z4.1地区的相对丰度明显高于其他地区。细菌中,优势物种为寡氧单胞菌属(Stenotrophomonas)、Marinimicrobium、Idiomarina。其中,Marinimicrobium在Z1.1地区的相对丰度明显高于其他地区。Idiomarina在Z1.3地区的相对丰度明显高于其他地区。

图2 胀果甘草土壤中属水平的真菌和细菌的相对丰度Fig.2 Relative abundance of fungi and bacteria at the genus level in the soil of Glycyrrhiza inflataOthers:所有其他属的相对丰度之和;Aporospora:Aporospora属;Gymnoascus:裸子囊菌属;Scleroderma:硬皮马勃属;Inocybe:丝盖伞属;Penicillium:青霉属;Geopora:地孔菌属;Alternaria:链格孢属;Fusarium:镰刀菌属;Geomyces:地丝霉属;Aspergillus:曲霉菌属;Sphingomonas:鞘氨醇单胞菌属;Salegentibacter:需盐杆菌属;Proteus:变形杆菌属;Streptomyces:链霉菌属;Salinimicrobium:Salinimicrobium属;Aliifodinibius:Aliifodinibius属;Halomonas:嗜盐单胞菌属;Idiomarina:Idiomarina属;Marinimicrobium:Marinimicrobium属;Stenotrophomonas:寡养单胞菌属
通过对调查数据汇总及分析,将5个地区采样地微生物丰度为前三的优势属的类群进行了统计,如图3所示。5个地区采样地丰度前三的真菌属均有镰刀菌属(Fusarium)。库尔勒地区、哈密地区和鄯善地区的丰度前三的真菌属种类相同,为曲霉菌属(Aspergillus)、镰刀菌属(Fusarium)、链格孢属(Alternaria),哈密地区、鄯善地区和瓜州地区的丰度前三的细菌属种类相同,为嗜盐单胞菌属(Halomonas)、Salinimicrobium、链霉菌属(Streptomyces)。

图3 胀果甘草采样点及丰度前三大属的优势真菌和细菌种类Fig.3 Dominant fungi and bacteria species of Glycyrrhiza inflata sampling sites and the first three genera in abundance
LEfSe统计结果分析显示,大部分真菌种类相似,个别菌种有差异,Z1、Z3组中真菌物种无差异显著,故此组缺失。Z2地区的小子囊菌科支顶孢属的烟曲霉菌(Aspergillusfumigatus),Z4地区的链格孢属(Alternariaatra),Z5地区的帚霉属布朗氏帚霉(Scopulariopsisbrumptii)是具有显著差异的真菌。部分细菌种类有差异,其中,Z2、Z4组中细菌物种无差异显著,故此组缺失。Z1地区的Idiomarins,Z3地区的链霉菌属(Streptomyces)、考克氏菌属(Kocuria),Z5地区的芽孢杆菌科(Bacillaceae)是具有显著差异的物种。

图4 胀果甘草土壤真菌和细菌的LDA值进化分支图和分布柱状图Fig.4 Evolutionary clade and distribution histogram of LDA values of soil fungi and bacteria of Glycyrrhiza inflataLDA:线性判别分析 Linear discriminant analysis;p:门;c:纲;o:目;f:科;g:属;s:种;Scopulariopsis:帚霉属;brumptii:布朗氏;atra:atra种;Microascales:小囊菌目;Microascaceae:小囊菌科;fumigatus:烟曲霉;Acremonium:枝顶孢属;Bacillales:芽孢杆菌目;Bacillaceae:芽孢杆菌科;Actinobacteria:放线菌门;unidentified:未确定的;Micrococcales:微球菌目;Streptomycetaceae:链霉菌科;Streptomycetales:链霉菌目;Micrococcaceae:微球菌科;Cytophagales:噬纤维菌目;Kocuria:考克氏菌属;Poteobacteria:变形菌门;Gammaproteobacteria:伽马变形菌纲;在进化分支图中,由内向外辐射的圆圈代表了从门到属(或种)的分类等级,小圆圈的直径与相对丰度大小成正比;LDA值分布柱状图显示LDA得分大于设定值(默认设置为4)的物种,即组间具有统计差异的生物标记物;无显著差异的物种统一着色为黄色,差异物种Biomarker跟随组进行着色,若图中某一组缺失,则表明此组中并无差异显著的物种,故此组缺失
2.3 生物多样性分析
2.3.1 α多样性
胀果甘草原生境真菌和细菌的丰富度和多样性指数的显著性检验(图5)显示,细菌的香农、Chao1、ACE指数均无显著差异。细菌Chao1指数平均值均大于真菌,表明细菌的OTU数均多于真菌。在真菌中,Z2库尔勒地区的香农指数平均值最高,Z1阿拉尔地区最低,表明库尔勒地区真菌群落的多样性最高,阿拉尔地区最低。Z5瓜州地区ACE指数平均值最高,Z1阿拉尔地区最低,表明瓜州地区真菌群落的丰富度最高,阿拉尔地区最低。阿拉尔地区的真菌、细菌香农指数均低,表明本地区微生物多样性最低。

图5 野生胀果甘草原生境土壤样品微生物丰富度和多样性指数的显著性检验(P<0.05)Fig.5 Microbial richness and diversity index of soil samples inwild Glycyrrhiza inflata habitat(P<0.05)
2.3.2 β多样性
基于Unweighted unifrac距离的主坐标分析(图6)和Adonis分析(表3)显示,真菌的组成结构在Z1与Z4;Z1与Z5;Z2与Z4;Z4与Z5组间差异显著,在Z1与Z2;Z1与Z3;Z2与Z3;Z2与Z5;Z3与Z4组间差异不显著。细菌的组成结构在Z1与Z2;Z1与Z3;Z1与Z4;Z1与Z5;Z2与Z3;Z2与Z5组间差异显著,在Z2与Z4;Z3与Z4;Z3与Z5;Z4与Z5组间差异不显著。

图6 基于Unweighted unifrac距离的胀果甘草土壤真菌和细菌群落的主坐标分析Fig.6 PCoA of soil fungus and bacteria communities in Glycyrrhiza inflata based on Unweighted unifrac distancePCoA:主坐标分析 Principal co-ordinates analysis;PC:主成分 Principal component
2.4 土壤理化性质特征
土壤理化性质方差分析如图7所示。不同分布区除土壤pH无显著差异外,土壤含水量SWC、总盐量TDS、有机碳TOC、总氮TN均有显著差异。Z1地区含水量最高,Z2地区含水量次之,Z3、Z4、Z5最低,说明由新疆阿拉尔地区至甘肃瓜州地区,随着经度升高,土壤含水量呈现下降趋势。土壤总含盐量随着经度的升高呈现出先升高再降低的趋势,其中Z2库尔勒地区土壤总含盐量最高,与Z1、Z4、Z5地区差异显著。Z2、Z4地区的土壤有机碳含量最高,Z1地区最低,地区差异显著。全氮的含量与土壤有机碳趋势相同。Z1地区的土壤有机碳和土壤全氮量均为最低,说明Z1地区的土壤肥力最低。

图7 胀果甘草分布区土壤理化性质方差分析Fig.7 Analysis of variance histogram of soil physical and chemical properties in distribution area of Glycyrrhiza inflata不同小写字母表示不同处理之间差异显著(P< 0.05)
2.5 微生物组成与环境因子关联分析
属水平的Spearman相关分析(图8)结果表明,不同种类的微生物与环境因子之间存在正相关或负相关关系。在真菌中,含盐量与裸子囊菌属(Gymnoascus)、Aporospora呈极显著正相关。含水量与镰刀菌属(Fusarium)、青霉属(Penicillium)呈极显著负相关。有机碳与丝盖伞属(Inocybe)、硬皮马勃属(Scleroderma)呈极显著负相关。全氮与硬皮马勃属(Scleroderma)呈极显著负相关。在细菌前10属中,pH与Marinnimicrobium呈极显著正相关,与链霉菌属(Streptomyces)显著负相关。含盐量与6个属的细菌呈极显著正相关,分别为Marinimicrobium、Idiomarina、嗜盐单胞菌属(Halomonas)、Aliifodinibius、Salinimicrobium、需盐杆菌属(Salegentibacter);与2个属的细菌呈极显著负相关,分别为链霉菌属(Streptomyces)和鞘氨醇单胞菌属(Sphingomonas)。含水量与Marinnimicrobium,Idiomarina和需盐杆菌属(Salegentibacter)呈极显著正相关,与链霉菌属(Streptomyces)呈极显著负相关。

图8 胀果甘草土壤中丰度前十的属真菌、细菌的Spearman相关性分析热图Fig.8 Spearman correlation analysis heat map of the top ten abundance soil fungi and bacteria in the soil of Glycyrrhiza inflata垂直方向是环境因子信息,水平方向是物种信息,热图对应的是斯皮尔曼相关系数r的值,介于-1,1之间;r<0为负相关,r>0为正相关
冗余分析(图9)表明,在真菌中,含水量是与群落分布相关程度最大的因子,含盐量是第二重要的环境因子;在细菌中,含水量是与群落分布相关程度最大的因子,而有机碳是第二重要的环境因子。土壤含水量均对真菌和细菌群落分布影响大,而总含盐量只对土壤中真菌群落分布影响大,对细菌群落分布影响小。

图9 环境因子与土壤真菌、 细菌在属水平的冗余分析Fig.9 Redundant analysis of environmental factors and soil fungi and bacteria at the genus leveldbRDA:基于距离的冗余分析 Distance-based redundancy analysis;土壤理化性质用箭头表示,连接箭头的长度表示一个理化因子与微生物群落分布的相关程度
2.6 分布区内生物群落结构和多样性的差异
本研究中,阿拉尔、哈密地区的采样点包括盐碱荒漠、盐碱弃耕地和林下不同生境,通过三元相图可直观查看采样点内三组样本在属水平上优势物种的差异,揭示盐碱地土壤微生物结构多样性特征,挖掘盐碱地特殊菌群。如图10所示,阿拉尔地区和哈密地区的土壤真菌在盐碱荒漠生境(Z1.3、Z3.1)丰度最低,而在林下农田边(Z1.1和Z1.2;Z3.2,Z3.3)丰度高;哈密地区的真菌仅有曲霉属(Aspergillus)丰度较高。Z1.2、Z3.1的土壤细菌丰度低,但Idiomarina在Z1.3丰度较高;Marinimicrobium在Z1.1丰度较高,呈现出盐碱地和非盐碱地土壤优势细菌种类不同。

图10 真菌、细菌属水平上丰度排名前10的三元相图Fig.10 Ternaryplot of fungi and bacteria at genus level图中3个顶点代表3个样本分组,圆圈代表物种,圆圈大小和相对丰度成正比,圆圈离哪一顶点越接近,表示此物种在这个分组中含量越高
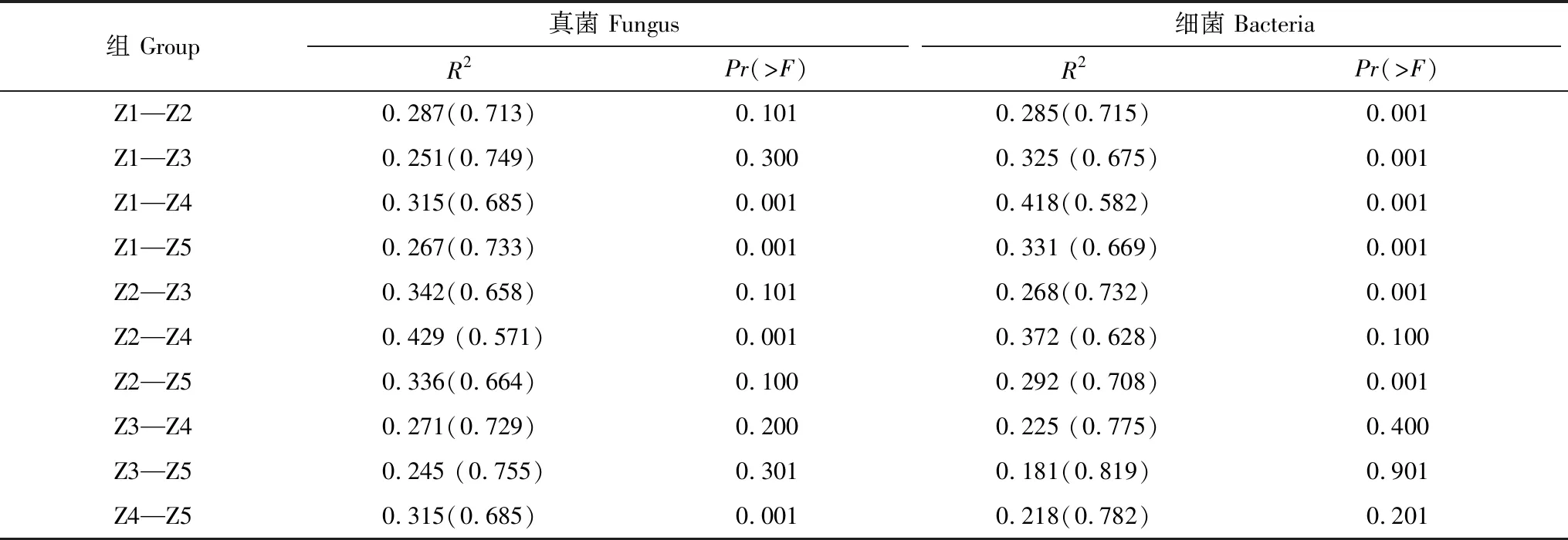
表3 组间Adonis分析
3 讨论
3.1 土壤优势微生物
本研究中,物种注释结果表明,曲霉属 (Aspergillus)、地丝霉属(Geomyces)、镰刀菌属(Fusarium)为属水平上胀果甘草原生境土壤的优势真菌。乌拉尔甘草的内生真菌研究中发现,曲霉属(Aspergillus)和镰刀菌属(Fusarium)为优势真菌[35—36],本研究胀果甘草原生境中也存在这两个优势菌群,说明同属药用甘草原生境土壤中优势菌群和内生菌有相似性。辽宁药用植物研究[19]从14种药用植物土壤中分离真菌,发现镰刀菌属(Fusarium)在14种药用植物土壤中均可分离得到,说明Fusarium属真菌在一些药用植物的土壤中具有普遍性。本研究在野生胀果甘草原生境土壤中分离出曲霉属,潘争艳等在五味子土壤中也分离出曲霉属,说明曲霉属真菌的来源广泛。不止如此,曲霉属真菌次生代谢产物多样,近年来也有新类型的发现,具有进一步研究的价值[37—38]。
寡养单胞菌属(Stenotrophomonas)、Marinimicrobium、Idiomarina为胀果甘草原生境土壤的属水平上的优势细菌。黄芪、人参等药用植物的土壤中优势细菌为土壤杆菌(Agrobacterium)、芽孢杆菌(Bacillus)、假单胞菌(Pseudomonas),本研究结果与之不同[19]。其中,寡养单胞菌属(Stenotrophomonas)细菌中能够提取出paritriside A等多种次生代谢产物,此属资源丰富,其次生代谢产物的利用具有重要的价值[39]。
通过比较土壤中优势真菌群落,我们发现,真菌和细菌丰度低的地区生境为盐碱荒漠或弃耕盐碱地;真菌和细菌丰度均较高的地区,生境类型为林下和农田边。结合土壤理化性质及dbRDA分析,认为这可能与盐碱弃耕地的低含水量有关。另外,含有链格孢属(Alternaria)真菌和链霉菌属(Streptomyces)细菌的地区,生境均为林下。其中,链霉菌属(Streptomyces)是具有应用前景的生防菌株。在优势细菌中,Idiomarina属在盐碱生境中含量丰富,有研究表明,所有的Idiomarina属物种都是从盐碱地环境中分离出来的,本属细菌的部分种可能具有在生物技术和工业应用中生产蛋白酶的潜力[40]。
众多研究表明,微生物肥料的利用,对土壤荒漠化、盐渍化的治理有重要的价值。因此,对原生境特殊和优势土壤微生物的利用有望对野生甘草种群恢复提供帮助,同时,也有助于胀果甘草野生驯化和栽培种植。
3.2 影响微生物群落结构和多样性的土壤理化因子
本研究调查涉及的样点,由新疆天山南麓阿拉尔地区至甘肃省河西走廊西部的瓜州县,纬度跨越不大,但经度相差15度,海拔梯度较大,落差接近800m。因此,经度和纬度梯度上,土壤微生物结构多样性特征具有较大的空间分布异质性。相关研究均表明,土壤微生物的丰度、菌群组成与土壤的pH值、含水量、有机质含量等物理化学性质密切相关,其中,土壤含水量和盐度是关键因素[41—46]。本研究结果也表明野生胀果甘草分布区土壤微生物结构多样性特征的空间分布异质性,主要与分布区土壤的理化性质有关,尤其是水、盐因子。
有研究表明,土壤含水量在0—15%范围内时,干旱半干旱区土壤细菌、真菌群落的多样性与土壤含水量呈显著正相关关系[47]。本研究结果显示胀果甘草原生境含水量与曲霉属(Aspergillus)、镰刀菌属(Fusarium)、链格孢属(Alternaria)、青霉属(Penicillium)真菌呈显著负相关;与Marinnimicrobium,Idiomarina、Aliifodinibius和需盐杆菌属(Salegentibacter)细菌呈显著正相关,与链霉菌属(Streptomyces)细菌呈显著负相关。其中,青霉属和曲霉属真菌,能够产生多种次生代谢产物,具有抗菌、抗肿瘤、抗氧化等作用[48—49]。
胀果甘草原生境土壤总含盐量,与曲霉属(Aspergillus)、裸子囊菌属(Gymnoascus)、Aporospora真菌呈显著正相关,与镰刀菌属(Fusarium)、丝盖伞属(Inocybe)、硬皮马勃属(Scleroderma)真菌呈显著负相关;总盐含量与Marinimicrobium、Idiomarina、嗜盐单胞菌属(Halomonas)、Aliifodinibius、Salinimicrobium、需盐杆菌属(Salegentibacter)这6种细菌的丰富度存在显著正相关关系,与链霉菌属(Streptomyces)和鞘氨醇单胞菌属(Sphingomonas)细菌呈显著负相关。细菌Marinimicrobium、Idiomarina、Salinimicrobium为20年内发现的新属,现有研究较少;而嗜盐单胞菌属(Halomonas)、Aliifodinibius、需盐杆菌属(Salegentibacter)均为嗜盐细菌,原生境中丰富度高的嗜盐细菌可能与胀果甘草的盐适应和耐盐机制有密切关系。嗜盐细菌能够产生活性物质、胞外多糖和各种酶可以在高盐、高pH值情况下发挥作用[50],对盐碱地的治理有重要的作用。因此,以上高丰度的嗜盐单胞菌属(Halomonas)、Aliifodinibius、需盐杆菌属(Salegentibacter)嗜盐细菌的发现,有助于利用耐盐碱微生物改良土壤盐碱环境,修复土壤功能,对野生胀果甘草种群恢复和盐碱弃耕地修复具有重要价值,值得后续研究。
另外,野生胀果甘草土壤真菌和细菌空间分布的异质性也与生境类型有关。本研究中Z1.3地区真菌丰度低,Z3.1地区真菌和细菌丰度均低,可能与其盐碱生境有关。通常认为,碳源充足的地区中,土壤微生物的种类较丰富[51]。本研究中,林下、农田边生境中的植物根系及凋落物较盐碱地、弃耕地多,土壤中碳源更加丰富,因此土壤微生物种类丰富;但有机碳对胀果甘草原生境土壤的真菌群落和细菌群落的影响并不相同,对真菌影响小,对细菌影响大,其影响机制值得进一步研究。
3.3 地理环境影响微生物分布
图4显示,哈密地区和鄯善地区的丰度前三属真菌种类相同,哈密、鄯善、瓜州地区丰度前3属的细菌种类相同,3个地区均为温带大陆性干旱气候,光照丰富,日照充沛,昼夜温差大,适宜胀果甘草生长,且都是胀果甘草单独分布区,说明优势微生物的种类与地理环境密切相关。
野生胀果甘草主要分布于新疆,另有少量分布于甘肃。在新疆分布在塔里木盆地和东疆吐哈盆地的盐碱荒漠草甸,在甘肃分布在河西走廊的干旱半干旱地带[14,52]。本研究样点由新疆天山南麓塔克拉玛干沙漠北沿至甘肃河西走廊西端,覆盖了野生胀果甘草的分布区域,新疆阿拉尔、库尔勒位于南疆,哈密、鄯善位于东疆,瓜州地区位于甘肃西北部,沿甘肃向东南,根据我们野外调查和采集,发现原植物志记载的胀果甘草分布区,已采集不到野生胀果甘草。这可能与近几十年来新疆和甘肃河西地区气温升高,降水量增加的变化[53—54]有关。土壤盐分的动态变化受气温和降水的变化的影响,而盐分是对细菌群落结构影响很大的因素,能够通过改变土壤肥力影响微生物群落的生长环境[55],因此,地理环境也是影响土壤微生物结构和多样性的重要因素。
4 结论
本研究挖掘出野生胀果甘草原生境土壤中优势真菌和细菌,并发现不同分布区真菌和细菌的多样性和丰富度的差异。野生胀果甘草原生境土壤真菌和细菌的空间分布异质性与土壤的含水量、总含盐量密切相关,也与野生胀果甘草的生境类型、地理环境相关。
另外,本研究中发现嗜盐细菌嗜盐单胞菌属(Halomonas)、Aliifodinibius、需盐杆菌属(Salegentibacter),有研究表明这些细菌能够产生活性物质、胞外多糖和各种酶,因此我们推测其在改良土壤盐碱环境,修复土壤功能的方面可能具有作用,该发现对野生胀果甘草种群恢复和盐碱弃耕地修复具有重要价值,为土壤微生物的利用方面提供了新的视角。

