雌激素及其抑制剂氟维司群对子宫内膜异位症间质细胞中NGF、MAPK及CREB表达的影响
王 芳,韩彩玲,任丽芸,陈 华
(1.宁夏回族自治区人民医院妇产科,银川 750004;2.宁夏医科大学总医院妇科,银川 750004;3.宁夏银川市第二人民医院妇产科,银川 750021)
子宫内膜异位症(endometriosis,EMs)是一种严重影响女性身心健康的慢性激素依赖性疾病,并可发生周期性盆腔疼痛、性交疼痛及不孕等[1]。50%~90%的EMs 青春期女性有痛经或慢性盆腔疼痛,但目前控制EMs 妇女盆腔疼痛仍是一项挑战[2]。目前,关于EMs 的疼痛发病机制仍有争议,药物治疗主要包括雌孕激素相关药物。EMs患者神经纤维的异常分布、神经生长因子(nerve growth factor,NGF)的异常表达与其疼痛密切相关[3]。有研究[4-6]显示,NGF 除了作为重要的神经营养因子外,还可以诱导丝裂原活化蛋白激酶(MAPK)/环腺苷酸应答元件结合蛋白(CREB)表达增加,增加机体对膝骨关节炎伤害性刺激的敏感性,参与疼痛的发生,但其在EMs 中的具体作用机制尚不清楚。因此,本研究借助雌激素及其抑制剂氟维司群药物干预EMs 在位内膜间质细胞,检测上述因子表达变化,探讨其在EMs 疼痛发病机制中的作用。
1 材料与方法
1.1 材料
选取2019年3月至2020年10月就诊于宁夏医科大学总医院因卵巢子宫内膜异位囊肿行手术治疗的患者9 例,分离培养子宫内膜间质细胞作为EMs 组;收集同期因其他卵巢良性肿瘤行手术治疗的患者9 例,分离培养子宫内膜间质细胞作为对照组。该研究已获得宁夏医科大学总医院伦理委员会批准(KYLL-2021-736)。
1.2 主要试剂
兔抗NGF 多克隆抗体(ab62557)、兔抗CREB多克隆抗体(ab52628)、β-actin 抗体(ab8227)、山羊抗兔HRP 二抗(ab6721)均购自英国Abcam 公司;兔抗MAPK 多克隆抗体(sc-377400)购自美国Santa Cruz Biotechnology 公司;17-β 雌二醇及氟维司群购自美国MCE 公司;SYBRRPremix Ex Taq(RR820A)、PrimeScriptTMRT reagent Kit with gDNA Eraser(RR047A)均购自日本Takara 公司;BCA蛋白提取检测试剂盒购自凯基公司;波形蛋白、角形蛋白均购自英国Abcam 公司。
1.3 方法
1.3.1 原代细胞培养 获取新鲜的EMs 患者及对照组患者在位子宫内膜组织,分别置于PBS 溶液反复冲洗去除血污,将内膜组织剪成1 mm×1 mm×1 mm 大小,移至离心管中,加入胶原酶IV,消化10 min 左右,静置离心管,将上层细胞液移至新离心管,加入培养基终止消化,1 000 r·min-1离心,取上清液1 mL 加入60 mm 培养皿中,加入2 mL 配制好的培养基,摇匀后显微镜下观察细胞均匀分布于培养皿中,放置在37 ℃、5%CO2培养箱中培养24 h 后换液观察。
1.3.2 药物配制 将细胞培养板中的培养基去掉,对照组加入新鲜培养基,雌激素组加入含有100 nmol·L-1雌激素的培养基,氟维司群组加入含有100 nmol·L-1氟维司群的培养基。细胞放置在37 ℃、5% CO2培养箱中培养24 h 后,对细胞进行处理。
1.3.3 细胞免疫荧光化学染色检测EMs 在位内膜间质细胞NGF、CREB 及MAPK 定位表达 待细胞汇合度为70%~90%时,弃掉培养基,加入1 mL 0.25%的胰酶,37 ℃孵育1~2 min。将培养瓶中液体移至新离心管中,1 000 r·min-1速度离心5 min。去掉上清液,加入新鲜培养基吹打均匀,将细胞悬液滴入细胞计数板,使细胞悬液充满盖玻片与计数板间,静置2~3 min,通过显微镜计算细胞总量。将细胞以5×104个/孔的量接种于24孔板,每孔加入500 μL 培养基培养12 h。4%多聚甲醛室温固定。加入含0.1% Triton X-100 的PBS,室温透化10 min。5% BSA 封闭液室温封闭30 min。吸去液体,分别加入1% BSA 稀释的兔CREB 抗体(稀释比1∶200)、兔MAPK 抗体(稀释比1∶200)、兔NGF抗体(稀释比1∶200),4 ℃孵育过夜,PBS 洗涤。山羊抗兔二抗(稀释比1∶1 000)避光室温孵育1 h,PBS 洗涤。DAPI 染液室温染色5 min,PBS 洗涤。荧光显微镜观察拍照,显微镜下细胞核为蓝色,使用488 标记的蛋白为绿色。
1.3.4 Western blot 蛋白检测各组细胞中NGF、CREB 及MAPK 蛋白表达 收集细胞,弃掉培养液,并用1 mL 的PBS 缓冲液清洗1 次。按照0.2 mL/孔加入细胞裂解液,置于-80 ℃超低温冰箱中,使细胞完全裂解。收集充分裂解后的细胞,置于EP 管中离心(4 ℃,1 000 r·min-1),留取细胞上清液,-20 ℃下保存备用。按照BCA 蛋白提取试剂盒和检测试剂盒说明提取总蛋白并测定蛋白浓度。每个加样孔上样30 μg 蛋白,电泳、PVDF膜转膜2 h,再经5%脱脂牛奶室温封闭3~4 h,一抗用TBST 溶液按照说明书操作稀释(NGF 1 ∶1 000,MAPK 1∶1 000,CREB 1∶1 000,β-actin 1∶10 000),4 ℃孵育过夜。经过室温复温,二抗孵育用TBST 按照1∶5 000 稀释,TBST 洗涤,进行化学发光反应。运用Image J 软件分析蛋白相对表达量。
1.3.5 实时荧光定量PCR 检测各组细胞中NGF、CREB 及MAPK mRNA 表达 实时荧光定量PCR 检测NGF、MAPK 及CREB 的mRNA 表达:提取细胞中的总RNA,使用微量分光光度计检测RNA 浓度和纯度,按照逆转录试剂盒说明书进行逆转录PCR 反应,以融解曲线判断PCR 反应的特异性,以β-actin 为内参,所得各样品Ct 值利用公式计算各样品mRNA 的相对表达量。
计算公式:

1.4 统计学方法
所有实验数据均使用GraphPad Prism 6 统计学软件进行分析,计量资料采用均数±标准差(±s)表示,两样本均数比较采用t 检验,多组间比较采用ANOVA 分析。P≤0.05 为差异有统计学意义。
2 结果
2.1 子宫内膜间质细胞分离鉴定
利用差速离心法分离培养原代子宫内膜间质细胞,用细胞免疫化学法进行细胞鉴定,显微镜下观察到波形蛋白组细胞呈长梭形,细胞核和细胞质染成棕黄色,角蛋白组与PBS 组细胞核和细胞质未见染色,即鉴定细胞为子宫内膜间质细胞,见图1。

图1 子宫内膜间质细胞的鉴定(细胞免疫化学法×50)
2.2 子宫内膜间质细胞中NGF、MAPK 及CREB蛋白荧光染色
细胞免疫荧光染色结果显示,荧光显微镜下观察到细胞核为蓝色,目的蛋白为绿色。子宫内膜间质细胞中NGF、MAPK 及CREB 蛋白荧光染色均能看到绿色荧光产生,且NGF、MAPK 及CREB蛋白主要定位于胞浆中,见图2。
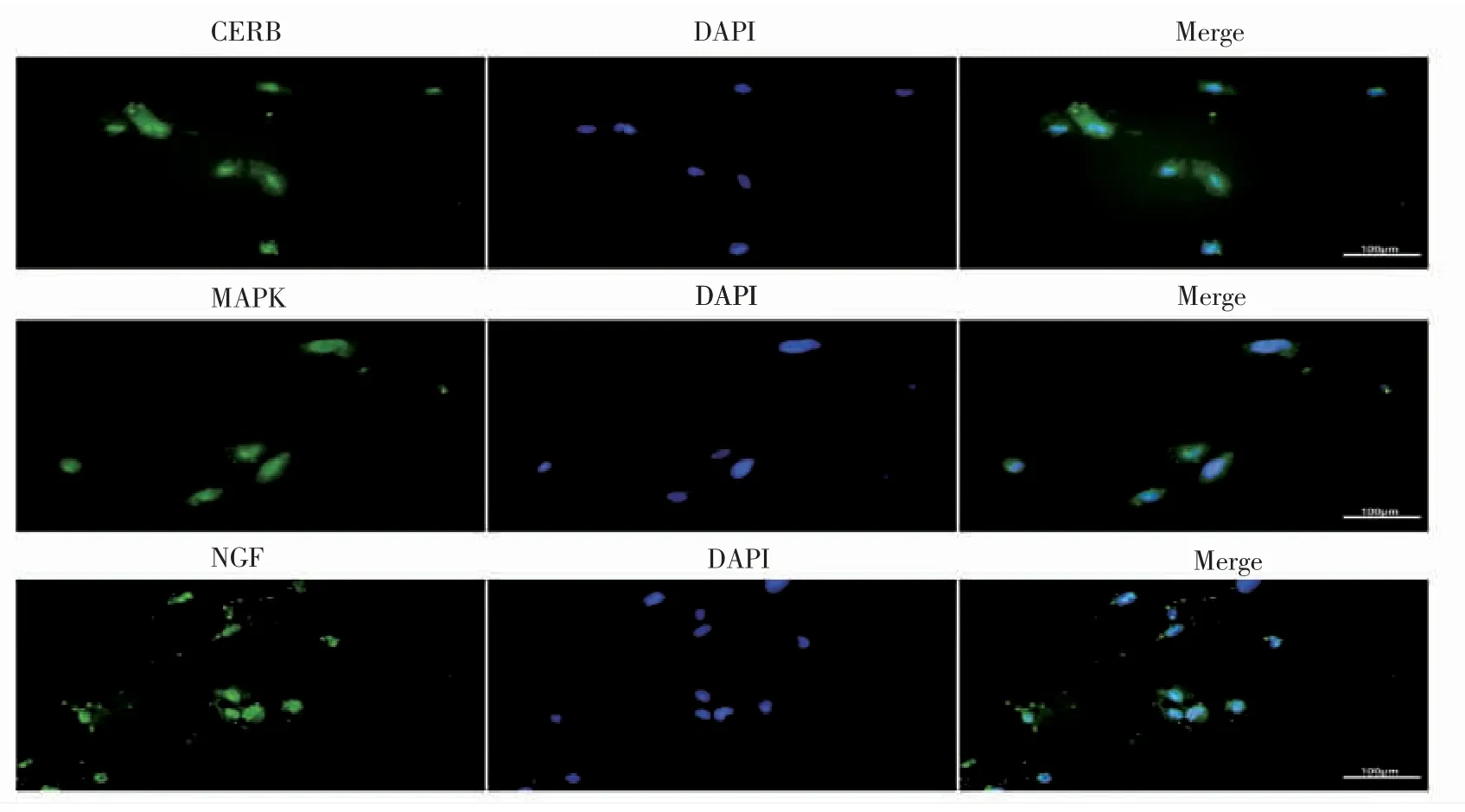
图2 子宫内膜间质细胞荧光染色观察结果(细胞免疫荧光×200)
2.3 NGF、MAPK 及CREB 蛋白在EMs 组和对照组子宫内膜间质细胞中的表达情况
Western blot 结果显示,与对照组相比,NGF、MAPK 及CREB 蛋白在EMs 组子宫内膜间质细胞中的表达均升高(P 均<0.05),见图3。

图3 各组细胞中NGF、MAPK、CREB 蛋白表达水平
2.4 雌激素与氟维司群作用后对子宫内膜间质细胞中NGF、MAPK 及CREB 蛋白表达的影响
Western blot 结果显示,与对照组相比,加入雌激素后,子宫内膜间质细胞中NGF、MAPK 及CREB 的蛋白表达水平均升高(P 均<0.01);给予氟维司群后,子宫内膜间质细胞中NGF、MAPK 及CREB 的蛋白表达水平均降低(P 均<0.05),见图4。

图4 雌激素与氟维司群作用后各组细胞中NGF、MAPK、CREB 蛋白表达水平
2.5 雌激素与氟维司群作用后对子宫内膜间质细胞中NGF、MAPK 及CREB mRNA 表达的影响
实时荧光定量PCR 结果显示,与对照组相比,加入雌激素后,子宫内膜间质细胞中NGF、MAPK、CREB 的mRNA 表达水平均升高(P 均<0.01);加入氟维司群后,子宫内膜间质细胞中NGF、MAPK、CREB 的mRNA 表达水平均降低(P 均<0.01),见图5。

图5 各组细胞中NGF、MAPK、CREB 的mRNA 表达水平
3 讨论
EMs 作为以不同程度疼痛综合征为主要症状的雌激素依赖性全身性疾病,疼痛已成为威胁患者生活质量的主要因素。目前其疼痛发病机制仍不明确。治疗方式的核心是非甾体激素类药物的应用,许多激素和激素联合用药诱导了子宫内膜和子宫内膜异位病灶蜕膜化的假孕状态,这些药物在一定程度上可缓解EMs 疼痛[7]。已有研究[8-9]报道,作为一种疼痛介质,神经生长因子NGF 的异常表达与EMs 疼痛发生存在明显的相关性,其可能直接参与了EMs 疼痛过敏和炎症性疼痛反应。本课题组前期已经证实神经生长因子NGF、MAPK 及CREB 在EMs 患者组织中高表达,揭示其与EMs 疼痛发生密切相关[6]。本研究通过原代分离培养子宫内膜在位间质细胞,细胞模型鉴定成功后给予雌激素及其抑制剂药物氟维司群,观察NGF、MAPK 及CREB 蛋白及mRNA表达水平变化,探讨雌激素相关药物在内异症疼痛治疗中的可能作用。
疼痛病理生理学是一个被广泛研究的巨大课题。深部浸润的异位细胞的存在可能与局部腹膜炎症有关,从而导致组织损伤释放与疼痛相关联的化学介质,这是EMs 可能涉及的疼痛机制[10-12]。NGF 是最早从神经组织中分离出来的神经营养因子家族成员,是调节神经生长、增殖、分化和存活的主要介质[13]。NGF 已经被证实在各种急慢性病理性疼痛的产生中发挥着重要的调控作用。正常人体注射NGF 后可在局部产生痛觉过敏反应,其可能机制是[14-15]:1)NGF 作为一种疼痛介质,参与了外周痛觉致敏反应和持续性疼痛发生;2)NGF 可使相关神经生长因子激活并触发丝裂原蛋白激酶/细胞外信号调节激酶(MAPK/ERK)信号转导级联反应,诱导CREB 相关基因表达增多,调控疼痛反应。EMs 相关研究[9]表明,神经因子NGF 的异常表达可能通过降低患者的疼痛阈值,增加疼痛敏感性,从而参与EMs疼痛的发生。课题组也从蛋白及基因水平证实NGF、MAPK 等因子在EMs 患者组织中高表达,但目前有关NGF 在EMs 中的研究仍主要停留在临床组织相关性验证层面,其在病理性疼痛情况下具体通过何种调控机制发挥作用仍不明确。有研究[16]报道,MAPK 信号转导通路被发现参与了NGF 的胞内信号转导,共同介导了病理性疼痛的发生。因此,为了进一步明确NGF 参与EMs 疼痛发生的具体机制,本研究建立EMs 原代间质细胞模型,采用免疫荧光证实了NGF、MAPK 及CREB蛋白主要在子宫内膜间质细胞胞浆中表达,结合Western blot 及qRT-PCR 证实EMs 患者间质细胞中NGF、MAPK 及CREB 蛋白表达水平升高,借助临床常见的雌激素及其抑制剂药物氟维司群干预,检测了干预后子宫内膜间质细胞中NGF、MAPK 及CREB 蛋白及mRNA 表达变化。结果发现,与对照组相比,雌激素组NGF、MAPK 及CREB蛋白及mRNA 表达均升高,而雌激素抑制剂组(氟维司群组)NGF、MAPK 及CREB 蛋白及mRNA 表达均下降。因此,雌激素抑制剂很有可能通过抑制NGF/MAPK 途径发挥治疗EMs 疼痛的作用。
综上所述,EMs 患者间质细胞中存在参与病理性疼痛的化学介质NGF 的高表达,雌激素抑制剂氟维司群可以拮抗子宫内膜间质细胞中NGF、MAPK 及CREB 蛋白及mRNA 的表达,揭示雌激素抑制剂很有可能通过抑制NGF/MAPK 途径减轻EMs 相关疼痛。

