基于网络药理学分析土茯苓治疗乳腺癌的作用机制
马意轩,杜 娟,陈美霓,徐向荣,赵菊梅
(延安大学医学院,延安市肿瘤防治重点实验室,陕西 延安 716000)
乳腺癌是威胁女性生命安全和健康的常见癌症。2020年全球癌症统计数据[1]显示,女性乳腺癌已超过肺癌,成为最常见的癌症。在2020年大约有230万新发乳腺癌病例,占所有癌症病例的11.7%。目前,治疗乳腺癌的主要手段仍为手术、放疗、化疗、内分泌治疗等[2]。但是由于较高的复发率和放、化疗的一些不良反应,患者的生存质量仍然得不到有效的保障。相比于传统治疗,中药治疗乳腺癌具有多靶点、毒性及不良反应小、效果好等特点[3]。研究[4]表明土茯苓有治疗乳腺癌的作用,但目前对于土茯苓抗乳腺癌作用机制的研究报道较少,缺乏系统的分子水平的作用机制探索以及多细胞层面的抗癌作用研究。网络药理学是基于系统生物学的理论,融合高通量组学技术、生物信息学技术,通过构建多成分-多靶点的调控模型,并通过多节点的分析找出关键节点,系统性地阐释中药作用于疾病过程中在分子水平的作用机制,这与中医的整体性、系统性诊治观点相吻合[5-6]。因此,本研究拟采用网络药理学方法,构建整体性、系统性的调控网络,多角度分析土茯苓治疗乳腺癌的潜在靶点,为其作用机制的实验探索提供理论参考。
1 方法
1.1 土茯苓活性成分筛选以及靶点预测
1.1.1 成分筛选以口服利用度(oral bioavailability,OB)≥30%,类药性(drug-likeness,DL)≥0.18为标准,通过中药系统药理学数据库分析平台(Traditional Chinese Medicine Database and Analysis Platform,TCMSP,https://tcmsp-e.com/)筛选土茯苓的活性成分。
1.1.2 靶点预测用TCMSP预测活性成分的潜在靶点。同时获取活性成分的化学结构,通过瑞士生物信息学研究所(Swiss Institute of Bioinformatics,Swiss,http://swisstargetprediction.ch/)、美国加利福尼亚大学药物化学系Shoichet实验室提供的相似性集合方法数据库(Similarity ensemble approach,SEA,https://sea.bkslab.org/)、PharmMapper数据库(http://www.lilab-ecust.cn/pharmmapper/)预测活性成分的潜在靶点,所取得结果经合并后去重。蛋白靶点经UniProt数 据 库(https://www.uniprot.org/uniprot/)比对矫正,同时转为基因靶点。
1.2 乳腺癌相关靶基因的获取
以“Breast Cancer”为关键词,通过毒性与基因比较数据库(comparative toxicogenomics database,CTD,https://ctdbase.org/)、人类基因数据库(The Human Gene Database,GeneCards,https://www.genecards.org/)、人类孟德尔遗传综合数据库(online mendelian inheritance in man,OMIM,https://www.omim.org/)、PharmGKB数 据 库(https://www.pharmgkb.org/)、Dis-GeNET数据库(https://www.disgenet.org/),检索并筛选乳腺癌的相关靶基因,其中CTD数据库根据经验设置推理分数大于100为筛选条件,DisGeNET数据库以“Advanced breast cancer”“Breast Cancer,Familial”“estrogen receptor-negative breast cancer”“Oestrogen receptor positive breast cancer”“HER-2 positive breast cancer”“HER2-negative breast cancer”为关键词检索。GeneCards以相关分数大于20为筛选条件。将以上数据库检索到的疾病相关基因合并后进行去重。
1.3 土茯苓活性成分与作用靶点的网络构建
利用Venny 2.1在线工具分析土茯苓与乳腺癌的交集靶点作为土茯苓治疗乳腺癌的潜在靶点。将土茯苓的活性成分和潜在作用靶点导入Cytoscape 3.8.2软件,构建“药物-活性成分-作用靶点-疾病”网络。其网络节点代表药物、活性成分、交集靶点和疾病,边表示两者具有相互作用。
1.4 蛋白互作网络构建
利用STRING数据库(https://cn.string-db.org/)分析调控网络中的蛋白质-蛋白质相互作用(protein-protein interaction,PPI),将获得数据导入Cytoscape 3.8.2软件进行蛋白互作网络构建,并通过Cytohubba插件筛选其核心靶点进行可视化处理。
1.5 GO富集分析和KEGG通路富集分析
利用Metascape在线分析平台(https://metascape.org/)进行基因本体(GeneOntology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,并通过微生信(www.bioinformatics.com.cn)在线工具进行可视化处理。
2 结果
2.1 土茯苓活性成分的收集与筛选
以OB≥30%、DL≥0.18为筛选 条件,研究 由TCMSP数据库筛选获得15个(表1)土茯苓有效活性成分。其中包括槲皮素(quercetin)、β-谷甾醇(β-sitosterol)、花旗松素(taxifolin)、谷甾醇(sitosterol)、柚皮素(naringenin)、异黄杞苷(isoengelitin)、落新妇苷(astilbin)、豆甾醇(Stigmasterol)、薯蓣皂苷元(diosgenin)等活性成分。

表1 土茯苓有效活性成分
2.2 靶点信息的收集和筛选
通过TCMSP、Swiss、SEA、PharmMapper数据库共预测到土茯苓治疗乳腺癌的潜在靶点有614个。通过DisGeNET、PharmGKB、GeneCards、CTD、OMIM数据库检索乳腺癌靶点,最终得到2 195个乳腺癌疾病靶点。通过韦恩在线平台取药物-疾病靶点基因的交集,得到273个交集靶点,即土茯苓治疗乳腺癌的潜在作用靶点,将共有靶点所对应的中药、有效成分、对应的疾病信息导入Cytoscape 3.8.2,构建“药物-成分-靶点-疾病”网络图(图1)。网络由290个节点和1 039条边组成。

图1 土茯苓治疗乳腺癌的“药物-成分-靶点-疾病”网络图
红色节点对应疾病,绿色节点对应药物,橙色节点对应活性成分,蓝色节点对应药物-疾病的交集靶点,边表示节点之间的相互作用关系。
2.3 土茯苓治疗乳腺癌的PPI网络
将273个药物-疾病共同靶点导入STRING在线数据库,设置使用默认参数,剔除1个游离的靶点,得到靶点蛋白272个。将获得结果导入Cytoscape 3.8.2软件,利用cytuHubba插件根据度值筛选出土茯苓治疗乳腺癌排名前30的关键靶点蛋白,430条相互作用关系,并进行可视化处理(图2)。在PPI网络中,排名靠前的核心靶点包括AKT1、TP53、ALB、TNF、EGFR、VEGFA、IL6、MYC、JUN等,提示这些靶点在治疗过程中发挥着关键作用,是调控网络中连接其他节点的枢纽。

图2 土茯苓治疗乳腺癌的蛋白相互作用网络
2.4 GO富集分析与KEGG通路富集分析
根据PPI核心靶点的分析结果,将30个核心靶点蛋白导入Metascape在线分析平台,结果显示土茯苓治疗乳腺癌共涉及900个生物学过程(biological processes,BP),35种细胞组分(cellular components,CC)以及47种分子功能(molecular functions,MF)。
BP中,主要涉及到蛋白质磷酸化的正向调控、细胞迁移的正向调节、细胞运动的正向调节、细胞组分运动的正向调节、转移酶活性的正向调节、MAPK级联调控、对细胞因子的反应、调节细胞的应激反应、调节蛋白激酶活性以及调节上皮细胞增殖等生物过程进行调节。
CC中,主要涉及到转录调节复合物、膜筏、膜微域、囊泡腔、核膜、RNA聚合酶Ⅱ转录调节复合物、内质网腔、溶酶体、转录抑制复合物以及分泌颗粒管腔等细胞组分进行调节。
MF中,主要涉及蛋白激酶活性、转录因子结合、RNA聚合酶Ⅱ特异性DNA结合转录因子结合、受体配体活性、细胞因子受体结合、信号受体激活剂活性、蛋白C端结合、丝氨酸/苏氨酸蛋白激酶活性、细胞因子活性以及DNA结合转录激活剂活性等分子功能进行调节。
将上述30个核心靶点蛋白导入Metascape在线分析平台进行KEGG通路富集分析,得到的结果显示土茯苓治疗乳腺癌共涉及157条通路。富集潜在靶基因最多的10条通路依次为癌症、癌症中的蛋白聚糖、脂质和动脉粥样硬化、人巨细胞病毒感染、卡波西肉瘤相关性疱疹病毒感染、PI3K-Akt信号通路、MAPK信号通路、内分泌抵抗、乳腺癌、癌症中的微小RNA,提示土茯苓可能通过以上通路发挥治疗乳腺癌的作用。
使用微生信在线作图网站将GO分析与KEGG分析结果,分别按富集基因数和P值排序,选前15个绘制成柱状图和气泡图(图3)。气泡图中气泡大小代表富集基因数的多少,气泡颜色差异依P值变化。
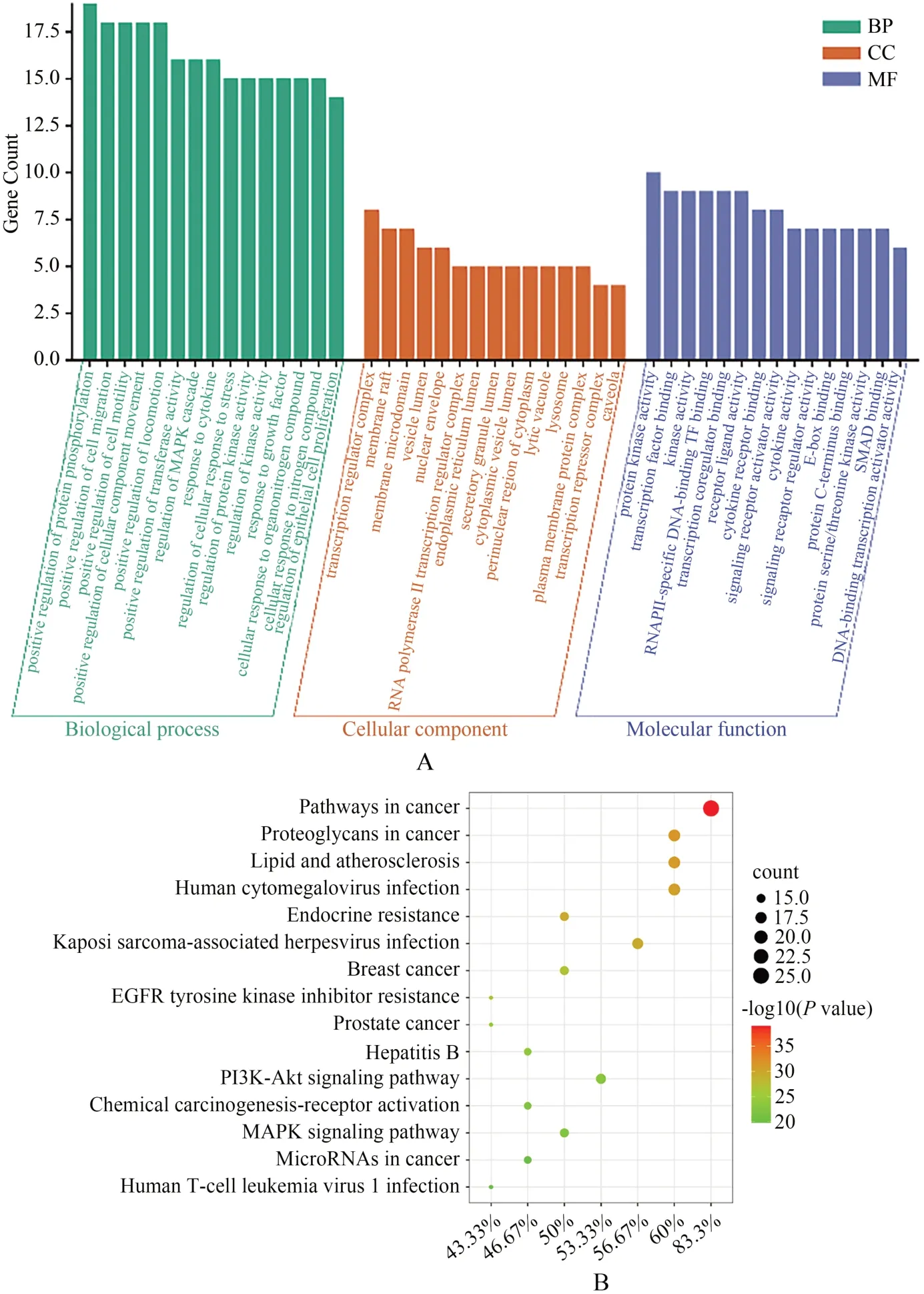
图3 土茯苓治疗乳腺癌的GO富集分析和KEGG通路富集分析
3 讨论
本研究最终预测得到土茯苓治疗乳腺癌涉及到15种有效活性成分,273个潜在作用靶点和157条信号通路,其活性成分、作用靶点、信号通路的多样性以及网络分析的整体性,与中医药强调的“同病异治和异病同治”观点不谋而合[7]。
现代药理学研究证实,土茯苓的化学成分主要包括黄酮类、苯丙素类、甾体类、有机酸、挥发油[8]。本次研究的土茯苓有效化学成分为黄酮类和甾体类,其中黄酮类包括异黄杞苷、花旗松素、槲皮素、柚皮素和落新妇苷等,甾体类包括谷甾醇、β-谷甾醇、豆甾醇和薯蓣皂苷元等。有研究表明,黄酮类化合物有抗病毒[9]、抗菌[10]、抗肿瘤[11]、抗氧化[12]等生物活性。Li等[13]发现花旗松素通过下调β-连环蛋白的转录及翻译促进间充质细胞到上皮细胞的转变,进而抑制乳腺癌细胞的增殖、迁移和侵袭;Lee等[14]发现槲皮素可以调节表皮生长因子/热激蛋白27通路从而调节乳腺癌干细胞和祖细胞的血管生成拟态,进而减少乳腺癌干细胞的数量;Zhao等[15]发现柚皮素能以时间和浓度依赖性的方式抑制乳腺癌细胞增殖,并使其停留在G0/G1期阻止细胞发育。Sun等[16]发现落新妇苷通过调节天冬氨酸特异性半胱氨酸蛋白酶依赖性途径促进乳腺癌细胞的凋亡。甾体类化合物经常被用于炎症、癌症和内分泌治疗中[17],其中Vundru等[18]发现β-谷甾醇诱导细胞周期停滞在G0/G1期并伴随着CDK4和cyclin D1的降低,以及p21/Cip1和p27/Kip1蛋白水平的增加,同时β-谷甾醇还可诱导乳腺癌细胞的凋亡。Liu等[19]发现薯蓣皂苷元通过抑制乳腺癌细胞中的S期激酶相关蛋白2(Skp2)从而降低细胞活力和运动性并诱导细胞凋亡。在本次研究中主要涉及到的活性成分同样包括上述黄酮类和甾体类化合物,由此说明,本次研究较全面地收集到土茯苓治疗乳腺癌的有效活性成分。
靶点AKT1、TP53、ALB、TNF、EGFR、VEGFA、IL6、MYC、JUN、PTEN、ERBB2、IGF-1、CASP3等在网络中处于核心位置,是土茯苓治疗乳腺癌的核心靶点。其中,AKT信号在细胞中具有许多功能,如细胞生存、细胞生长、细胞周期调节和代谢。Deng等[20]发现,在中国乳腺癌患者中检测PIK3CA和AKT1基因的突变并且可能与预后不良有关。TP53在许多肿瘤类型中充当肿瘤抑制因子,诱导生长停滞或凋亡。易宗毕等[21]研究发现,TP53体细胞突变在中国乳腺癌患者中很常见。EGFR是一种细胞表面蛋白,与表皮生长因子结合,从而诱导受体二聚化和酪氨酸自身磷酸化,导致细胞增殖,而且普遍在乳腺癌中高表达,尤其是三阴性乳腺癌和炎性乳腺癌[22-23]。PTEN是一种PIP3特异性磷酸酶,可使PIP3去磷酸化变为PIP2分子,进而阻止AKT的激活而起到抑制肿瘤细胞增殖的作用[24],同时PTEN在乳腺癌中经常发生突变,导致其功能缺失[25]。ERBB2(又称HER2)包含一个胞外配体结合结构域、一个跨膜结构域和一个胞内酪氨酸激酶结构域,在大约15%~20%的乳腺癌病例中观察到ERBB2高表达[26],这可能导致PI3K/AKT/mTOR通路激活[27]。IGF-1是IGF1R的配体,与IGF1R的α亚基结合,导致内在酪氨酸激酶的激活,其自磷酸化β亚基中的酪氨酸残基,从而引发一连串的下游信号事件,导致PI3K-AKT/PKB和Ras-MAPK途径的激活,免疫组织化学染色显示,IGF-1受体在近一半的乳腺癌中高表达[28]。而CASP3所编码的蛋白质是天冬氨酸特异性半胱氨酸蛋白酶,在细胞凋亡的执行阶段起核心作用,同时还参与坏死和炎症的信号通路,可见这些靶点涉及肿瘤细胞的细胞周期、凋亡、细胞生长等方面,与乳腺癌的发生发展密切相关,由此证实了土茯苓治疗乳腺癌的作用。
通过将30个核心靶点进行KEGG信号通路的富集分析发现土茯苓治疗乳腺癌相关的信号通路有157条,主要涉及到的通路都与PI3K-AKT相关,包括EGFR酪氨酸激酶抑制剂耐药性(EGFR tyrosine kinase inhibitor resistance)、MAPK、内分泌抵抗等。PI3K/AKT信号通路在细胞代谢、细胞生长、细胞增殖、凋亡和血管生成等基本细胞活动中发挥重要作用,大约30%~40%的乳腺癌患者存在PIK3CA突变,PIK3CA是编码PI3K蛋白p110α催化亚基的基因[29],与此同时PTEN的失活进一步加剧了该通路的激活,这可能与内分泌治疗的耐药有关[30]。也有研究[31]证实,黄酮类化合物通过PI3K-AKT信号通路诱导乳腺癌细胞的凋亡。MAPK信号通路在肿瘤细胞的增殖、生长、分化方面起到关键的作用。有研究[32]证实,MAPK信号通路和PI3K-AKT信号通路共同参与IGF-1诱导的VEGF-C(血管内皮生长因子-C)上调,从而诱导乳腺癌细胞淋巴结转移。对于EGFR酪氨酸激酶抑制剂耐药性与PI3K/AKT信号通路的关系早在多年以前就有研究[33]报道,EGFR酪氨酸激酶抑制剂耐药性产生的原因之一可能与PTEN的缺失有关,从而解除其对PI3K/AKT信号通路的抑制引发耐药,故推测PI3K/AKT信号通路是土茯苓治疗乳腺癌过程中的关键枢纽。
综上所述,本次研究运用网络药理学方法探索土茯苓治疗乳腺癌的分子机制,系统阐述了多靶点、多成分、多通路的相互作用关系,预测到PI3K/AKT通路在分子网络中的核心作用,为更进一步开展土茯苓治疗乳腺癌的实验研究及临床应用提供了理论依据。

