月见草中一个新的莽草酸衍生物
刘娟娟,张靖柯,曾梦楠,李 孟,朱登辉,魏俊俊,郑晓珂,冯卫生*
1河南中医药大学药学院;2河南省中药开发工程技术研究中心,郑州 450046
肺纤维化(pulmonary fibrosis,PF)是一类破坏性、不可逆损伤的弥漫性肺间质疾病[1]。其中严重呼吸综合征冠状病毒和新型冠状病毒(COVID-19)感染以及多种炎症性肺部疾病,均可引起肺纤维化[2]。治疗上西医多采用糖皮质激素、免疫抑制剂、细胞因子抑制剂等进行治疗,但不良反应比较多[3]。随着中医药事业的不断发展,以及中医药在抗击新冠疫情方面发挥的核心作用[4]。越来越多的实验研究表明中药及其提取物对肺纤维化有良好的治疗作用[5]。查阅地方书籍发现月见草能够治疗肺部相关的疾病。比如《泉州本草》记载用月见草可以治疗肺病、瘰疬等。
月见草OenotherabiennisL.为柳叶菜科(Onagraceae)月见草属(OenotheraL.)多年生草本植物[6],因在傍晚7~9时开花,故称为月见草。它是一种集油用、观赏、药用于一身的多功能植物[7],为民间常用的中草药,全株皆可入药,该植物主要分布在我国的东北南部及东部山区等地[8]。月见草种子油中富含γ-亚麻油酸等多种不饱和脂肪酸是人体不可缺少的必需脂肪酸,有很强的生物活性[9-12]。查阅文献发现,目前有关月见草化学成分研究的报道比较少,且缺乏对月见草化学成分的系统研究。为了明确月见草的化学成分,为月见草的后续开发利用奠定基础,本文对月见草全草化学成分进行分离鉴定研究。
1 材料与方法
1.1 仪器与材料
赛谱锐思LC-52型高压制备液相色谱仪(赛谱锐思北京科技有限公司,SP-5030型半制备型高压输液泵,UV200型紫外检测器,Easychrom型色谱工作站);OSB-21000型旋转蒸发仪(上海爱朗仪器有限公司);Bruker AVANCE III 500型核磁共振仪(德国Bruker公司);Bruker maxis HD型飞行时间质谱(德国Bruker公司);Thermo Nicolet IS10 红外光谱仪(Thermo Scientific,USA);Thermo EVO300紫外分光光度计(Thermo Scientific,USA);Rudolph AP-IV 型旋光仪(Rudolph,USA);Multiskan MK3酶标仪(Thermo Fisher,USA)。
硅胶H(200~300目)(青岛海洋化工厂);Sephadex LH-20(Pharmacia Biotech);MCI GEL CHP-20(Mitusishi Chemical Corporation);色谱柱COSMOSIL C18-MS-II,250 mm × 20 mm,5 μm);薄层色谱硅胶G和GF254(烟台江友硅胶开发有限公司);色谱甲醇、分析甲醇、分析二氯甲醇、分析乙酸乙酯、分析石油醚、分析正丁醇(天津市富宇精细化工有限公司),色谱乙腈(美国天地有限公司)。
月见草样品于2019年8月采自于河南省伏牛山区,经河南中医药大学董诚明教授鉴定为柳叶菜科月见草属植物月见草(OenotherabiennisL.)的干燥全草;留样标本(YJC-201908)存放于河南中医药大学药学院河南省中药开发工程技术研究中心。
1.2 实验方法
1.2.1 提取与分离
取干燥月见草全草(40 kg),用50%含水丙酮组织破碎提取2次,过滤,合并滤液,减压浓缩,得到总浸膏(3.3 kg)。总浸膏加等量水分散,依次用石油醚、二氯甲烷、乙酸乙酯以及水饱和正丁醇进行萃取,各部位经减压浓缩,回收溶剂,得到石油醚部位(5.0 g)、二氯甲烷部位(49.6 g)、乙酸乙酯部位(161.0 g)及正丁醇部位(457.0 g)。二氯甲烷部位进行硅胶柱色谱分离,以石油醚-乙酸乙酯(10∶0 → 0∶1)以及乙酸乙酯-甲醇(5∶1 → 0∶1)洗脱,洗脱组分经TLC检测,合并相同部分,得到10个组分,即Fr.1~Fr.10。其中Fr.8(2.47 g)洗脱组分进行硅胶柱色谱分离以石油醚-丙酮(20∶1 → 0∶1)梯度洗脱,经TLC检识,合并相同组分,得到9个组分,即Fr.8-1~Fr.8-9。其中Fr.8-8(0.95 g)进行硅胶柱色谱分离以石油醚-丙酮(15∶1 → 0∶1)梯度洗脱,经TLC检识,合并相同组分,得到7个组分,即Fr.8-8-1~Fr.8-8-7。其中Fr.8-8-6(0.53 g)加甲醇溶解,进行硅胶柱色谱分离,以二氯甲烷:甲醇(50∶1 → 10∶1)梯度洗脱,得到7个洗脱组分Fr.8-8-6-1~Fr.8-8-6-7。其中Fr.8-8-6-3(0.14 g)进行制备薄层分离纯化并结合使用半制备高效液相(乙腈-水洗脱体系),最终得到化合物9(22.96 mg)。Fr.8-8-6-4(0.27 g)加甲醇溶解,进行硅胶柱色谱分离,以二氯甲烷∶甲醇(50∶1→10∶1)梯度洗脱,得到4个洗脱组分Fr.8-8-6-4-1~Fr.8-8-6-4-4。其中Fr.8-8-6-4-2经Sephadex LH-20凝胶柱色谱(70%甲醇)分离并结合半制备高效液相(甲醇-水洗脱体系),最终得到化合物3(3.68 mg)、4(1.98 mg)、5(2.55 mg)。Fr.8-8-6-6(0.09 g)经Sephadex LH-20凝胶柱色谱(70%甲醇)分离并结合半制备高效液相(甲醇-水洗脱体系),最终得到化合物6(1.32 mg)。
乙酸乙酯部位进行硅胶柱色谱分离,以二氯甲烷-甲醇(100∶1 → 0∶1)梯度洗脱,洗脱组分经TLC检测,合并相同部分,得到5个组分,即Fr.11~Fr.15。其中Fr.13(10.3 g)进行MCI gel CHP-20柱色谱分离,以甲醇-水(0∶100 → 100∶0)梯度洗脱,洗脱组分经TLC检测,合并相同部分,得到7个组分,即Fr.13-1~Fr.13-7。其中Fr.13-5(1.49 g)加甲醇溶解,进行硅胶柱色谱分离,以二氯甲烷∶甲醇(50∶1 → 10∶1)梯度洗脱,得到4个洗脱组分,即Fr.13-5-1~Fr.13-5-4。Fr.13-5-2(0.21 g)经Sephadex LH-20凝胶柱色谱(70%甲醇)分离并结合半制备高效液相(乙腈-水洗脱体系),最终得到化合物8(2.70 mg)、10(4.33 mg)。Fr.13-5-3(0.12 g)经Sephadex LH-20凝胶柱色谱(70%甲醇)分离并结合半制备高效液相(乙腈-水洗脱体系),最终得到化合物7(1.62 mg)。其中Fr.14(28.9 g)进行MCI gel CHP-20柱色谱分离,以甲醇∶水(0∶100 → 100∶0)梯度洗脱,洗脱组分经TLC检测,合并相同部分,得到9个组分,即Fr.14-1~Fr.14-9。其中Fr.14-2(3.59 g)加甲醇溶解,进行硅胶柱色谱分离,以二氯甲烷-甲醇(30∶1 → 0∶1)梯度洗脱,得到6个洗脱组分Fr.14-2-1~Fr.14-2-6。其中Fr.14-2-4(1.39 g)反复经过硅胶柱色谱、Sephadex LH-20凝胶柱色谱分离,并结合使用半制备高效液相(乙腈-水洗脱体系),最终得到化合物1(6.28 mg)、2(8.76 mg)。
1.2.2 MTT法测定细胞活力
前期课题组成员对月见草总提物以及各分部位进行抗肺纤维化活性实验研究。为探究其发挥肺纤维化的活性成分,本研究采用MTT法测定化合物1~10对TGF-β1诱导BEAS-2B细胞损伤的影响,以初步探究其抗肺纤维化的活性成分。
将BEAS-2B细胞置于37 °C、5% CO2培养箱中培养至对数生长期,按照细胞密度每毫升2.5×104个细胞,每孔200 μL接种于96孔板中,24 h后分为正常组、模型组(TGF-β1,1 ng/mL)及各给药组(10 μmol/L + TGF-β1,1 ng/mL),继续培养24 h后,每孔加入MTT溶液(5 mg/mL)20 μL,再继续培养4 h,终止培养,小心吸取摒弃孔内培养上清液,每孔加入150 μL的DMSO,在490 nm下测定每个孔吸光度(A),计算细胞活力(细胞活力=实验组的OD值/正常组的OD值)。
2 结果与分析
2.1 结构鉴定
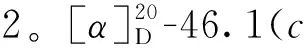
1H-1H COSY谱(见图1)中显示H-3(δH4.11)和H-2(δH6.87)、H-4(δH3.70)与H-5(δH4.00)和H-4(δH3.70)、H-6(δH2.44,2.53)具有相关,推测该结构中有一个-C=CH-CH-CH-CH-CH2-的结构;在HMBC谱(见图1)中H-6(δH2.44,2.53)与C-5(δC69.5)、C-4(δC73.8)、C-1(δC130.2)、C-2(δC137.7)、C-7(δC168.5)具有远程相关,可以确定该结构中有一个莽草酸甲酯结构。1H-1H COSY谱中显示H-8(δH4.46)和H-10(δH1.40)具有相关;在HMBC谱中δH4.46(H-8)与δC175.8(C-9)、δC78.7(C-3)、δC19.2(C-10)具有远程相关,推测该结构中有一个-O-CHCH3COOCH3结构,且连在莽草酸甲酯的3位碳原子上。根据以上数据,结合文献[13],由此可以确定该化合物的平面结构。在NOESY谱中,H-4与H-5具有相关信号,说明其位于同侧,为β-构型;H-3与H-4无相关信号,说明其位于异侧,为α-构型;H-8与H-3具有相关信号,说明其位于同侧,为α-构型。经过ECD计算(见图2),确定该化合物的绝对构型为3R,4R,5R,8S。经文献检索,确定该化合物为新化合物,命名为dimethyl 3-lactyl shikimate(结构见图3)。该化合物的碳氢数据归属见表1。化合物1的详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。
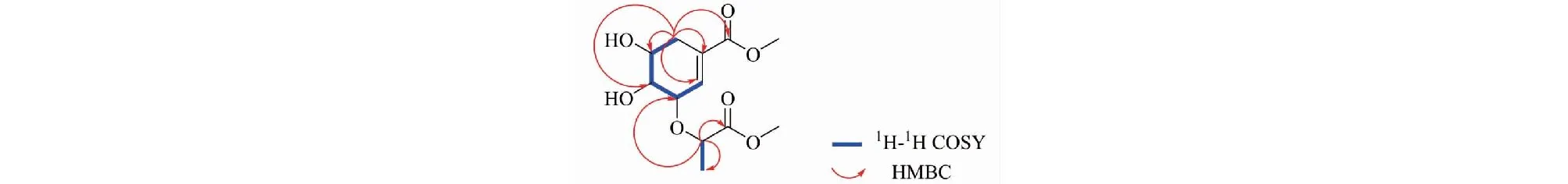
图1 化合物1的1H-1H COSY、HMBC相关Fig.1 Key 1H-1H COSY and HMBC correlations of compound 1
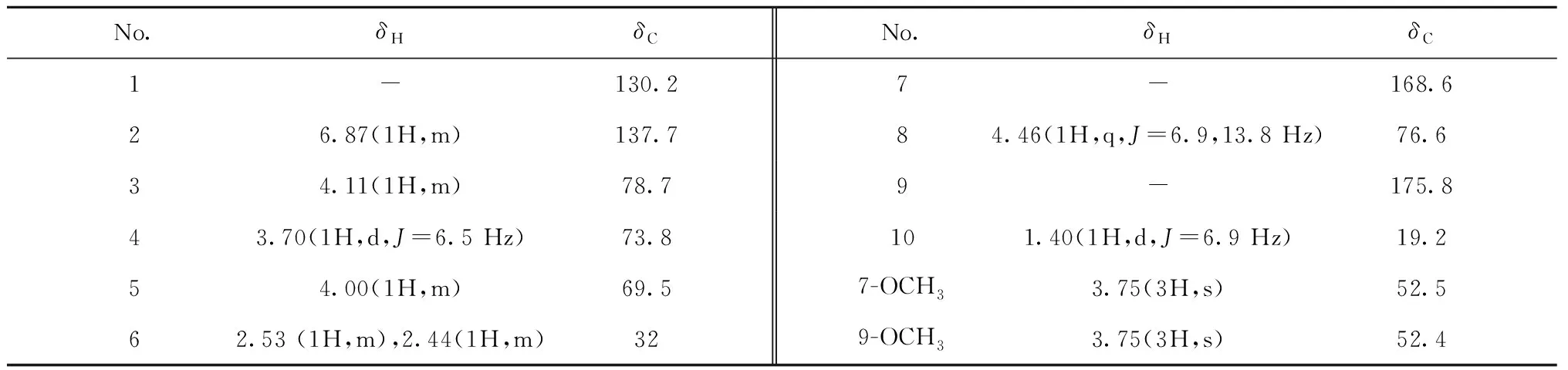
表1 化合物1的1H NMR(500 MHz)和13C NMR(125 MHz)数据(CD3OD)Table 1 1H NMR (500 MHz) and13C NMR (125 MHz) data for compound 1 (in CD3OD)
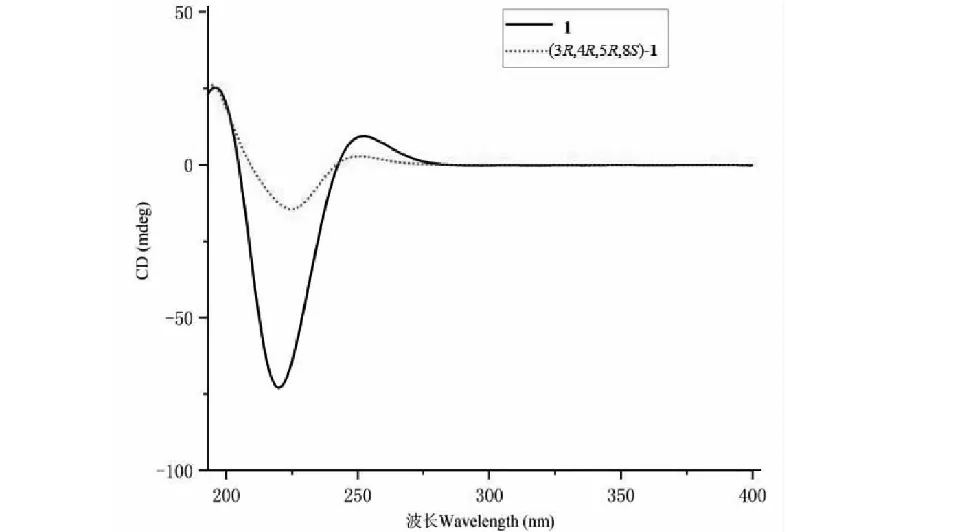
图2 化合物1的实测和计算ECD谱图Fig.2 Experimental and calculated ECD spectra of compound 1
化合物2无色结晶;分子式为C8H12O5,ESI-MS:m/z211 [M+Na]+。1H NMR(500 MHz,CD3OD)δ:6.76(1H,m,H-2),4.29(1H,m,H-3),4.04(1H,dt,J= 4.8,7.2 Hz,H-5),3.74(3H,s,7-OCH3),3.62(1H,d,J= 6.4 Hz,H-4),2.55(1H,m,H-6a),2.46(1H,m,H-6b);13C NMR(125 MHz,CD3OD)δ:129.8(C-1),139.3(C-2),70.3(C-3),75.0(C-4),69.0(C-5),32.0(C-6),168.7(C-7),52.4(7-OCH3)。以上数据与文献[14]报道基本一致,故鉴定化合物2为methyl shikimate。
化合物3黄色固体;分子式为C17H12O8,ESI-MS:m/z367 [M+Na]+。1H NMR(500 MHz,DMSO-d6)δ:7.64(1H,s,H-5),7.54(1H,s,H-5′),4.06(3H,s,3-OCH3),4.04(3H,s,4-OCH3),4.00(3H,s,3′-OCH3);13C NMR(125 MHz,DMSO-d6)δ:111.2(C-1),140.2(C-2),140.9(C-3),152.7(C-4),111.7(C-5),112.0(C-6),158.3(C-7),112.6(C-1′),141.5(C-2′),141.0(C-3′),153.8(C-4′),107.5(C-5′),113.4(C-6′),158.5(C-7′),61.3(3′-OCH3),60.9(3-OCH3),56.7(4-OCH3)。以上数据与文献[15]报道基本一致,故鉴定化合物3为3,3′,4-O-三甲基鞣花酸。
化合物4黄色固体;分子式为C16H10O8,ESI-MS:m/z353 [M+Na]+。1H NMR(500 MHz,DMSO-d6)δ:7.54(2H,s,H-5,5′),4.04(6H,s,3,3′-OCH3);13C NMR(125 MHz,DMSO-d6)δ:111.7(C-1,1′),141.2(C-2 2′),140.2(C-3 3′),152.2(C-4 4′),111.5(C-5 5′),112.2(C-6 6′),158.5(C-7,7′),61.0(3,3′-OCH3)。以上数据与文献[16]报道基本一致,故鉴定化合物4为3,3′-二甲氧基-鞣花酸。
化合物5黄色固体;分子式为C17H12O9,ESI-MS:m/z383 [M+Na]+。1H NMR(500 MHz,DMSO-d6)δH7.54(1H,s,H-5′),4.15(3H,s,3-OCH3),4.04(3H,s,4-OCH3),3.89(3H,s,3′-OCH3);13C NMR(125 MHz,DMSO-d6)δ:111.7(C-1),140.1(C-2),151.7(C-3),133.4(C-4),147.0(C-5),97.5(C-6),160.9(C-7),113.0(C-1′),141.4(C-2′),140.6(C-3′),153.1(C-4′),111.3(C-5′),113.4(C-6′),158.3(C-7′),61.7(4-OCH3),61.2(3-OCH3),61.0(3′-OCH3)。以上数据与文献[17]报道基本一致,故鉴定化合物5为3,4,3′-三甲氧基鞣花酸。
化合物6白色晶体;分子式为C15H12O5,ESI-MS:m/z295 [M+Na]+。1H NMR(500 MHz,DMSO-d6)δ:11.83(1H,s,7-OH),10.38(1H,s,3-OH),7.24(1H,d,J= 2.1 Hz,H-10),6.66(2H,d,J= 2.6 Hz,H-2,4),6.63(1H,d,J= 2.1 Hz,H-8),3.92(3H,s,9-OCH3),2.74(1H,s,H-11);13C NMR(125 MHz,DMSO-d6)δ:138.4(C-1),117.6(C-2),158.6(C-3),101.6(C-4),152.6(C-4a),166.2(C-6),98.5(C-6a),164.1(C-7),99.2(C-8),164.7(C-9),103.4(C-10),137.8(C-10a),108.8(C-10b),25.0(C-11),55.8(9-OCH3)。以上数据与文献[18]报道基本一致,故鉴定化合物6为Alternariol 9-methyl ether。
化合物7淡黄色粉末;分子式为C11H14O6,ESI-MS:m/z242 [M+Na]+。1H NMR(500 MHz,CD3OD)δ:7.35(2H,s,H-2,6),5.13(1H,t,J= 3.8 Hz,H-8),3.80(6H,s,3,5-OCH3),3.68(1H,dd,J= 11.6,5.1 Hz,H-9a),3.58(1H,dd,J= 11.6,5.1 Hz,H-9b);13C NMR(125 MHz,CD3OD)δ:125.3(C-1),106.3(C-2,6),147.7(C-3,5),141.6(C-4),198.3(C-7),74.2(C-8),64.8(C-9),55.5(3,5-OCH3)。以上数据与文献[19]报道基本一致,故鉴定化合物7为2,3-二羟基-1-(4-羟基-3,5-二甲氧基苯基)-1-丙酮。
化合物8白色无定形粉末;分子式为C10H12O5,ESI-MS:m/z235 [M+Na]+,1H NMR(500 MHz,(CD3)2CO)δ:5.95(1H,d,J= 2.2 Hz,H-5),5.42(1H,d,J= 2.3 Hz,H-3),3.85(3H,s,4-OCH3),3.64(3H,s,H-4′),2.77(2H,m,H-1′),2.68(2H,m,H-2′);13C NMR(125 MHz,(CD3)2CO)δ:164.7(C-2),88.1(C-3),171.9(C-4),99.4(C-5),164.0(C-6),29.4(C-1′),31.1(C-2′),172.7(C-3′),51.9(C-4′),55.6(4-OCH3)。以上数据与文献[20]报道基本一致,故鉴定化合物8为scirpyrone H。
化合物9白色无定形粉末;分子式为C12H14O4,ESI-MS:m/z245 [M+Na]+。1H NMR(500 MHz,CD3OD)δ:6.87(1H,s,H-6),5.48(1H,dd,J= 6.7,13.2 Hz,H-8),3.96(3H,s,H-9),3.94(3H,s,H-11),2.11(3H,s,H-10),1.58(3H,d,J= 6.7Hz,H-12);13C NMR(125 MHz,CD3OD)δ:170.6(C-1),110.2(C-2),158.6(C-3),121.3(C-4),166.1(C-5),100.0(C-6),155.1(C-7),78.5(C-8),62.5(C-9),8.7(C-10),56.9(C-11),20.8(C-12)。以上数据与文献[21]报道基本一致,故鉴定化合物9为dimethoxydimethylphthalide。
化合物10无定形固体;分子式为C13H14O4,ESI-MS:m/z257 [M+Na]+。1H NMR(500 MHz,(CD3)2CO)δ:6.47(1H,s,H-4),4.74(1H,s,H-10a),4.72(1H,s,H-10b),4.08(1H,q,J= 7.1 Hz,H-8),3.93(3H,s,H-13),2.10(3H,s,H-12),1.36(3H,d,J= 7.1 Hz,H-11);13C NMR(125 MHz,(CD3)2CO)δ:165.9(C-1),99.2(C-2),164.0(C-3),98.3(C-4),167.6(C-5),114.8(C-6),143.3(C-7),35.3(C-8),158.3(C-9),96.0(C-10),22.5(C-11),10.1(C-12),56.5(C-13)。以上数据与文献[22]报道基本一致,故鉴定化合物10为clearanol C。
化合物1~10的结构见图3。
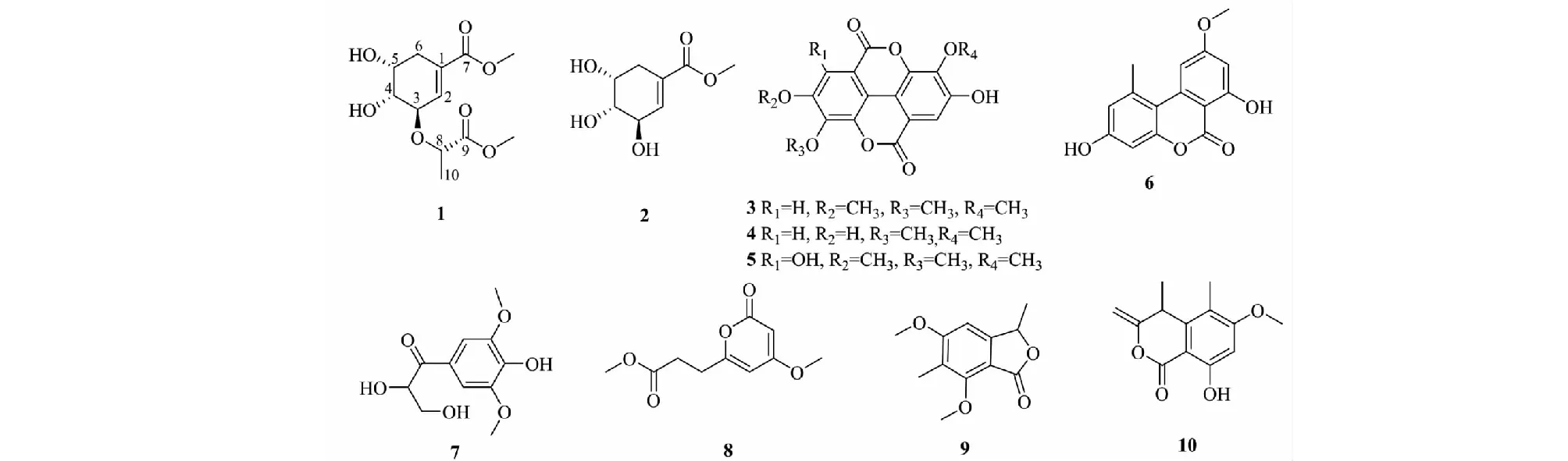
图3 化合物1~10的结构Fig.3 Chemical structures of compounds 1-10
2.2 活性测试结果
采用TGF-β1诱导BEAS-2B细胞建立肺纤维化体外模型,探究从月见草中分离得到的化合物1~10对TGF-β1诱导BEAS-2B细胞损伤的影响,结果表明,化合物2、3可显著提高TGF-β1诱导BEAS-2B细胞的活力,推测其可能具有潜在的肺保护作用。
3 结论
本文通过多种色谱分离技术对月见草的化学成分进行分离纯化,得到10个化合物(1~10),其中化合物1为新化合物;采用MTT法测定了化合物1~10对TGF-β1诱导BEAS-2B细胞损伤的影响,结果显示化合物2、3可显著提高TGF-β1诱导BEAS-2B细胞的活力。本文进一步丰富了月见草化学成分,前期研究多集中在月见草油的相关药理活性[23],本研究的活性测试结果也拓展了月见草的药用价值,为月见草的开发利用积累了基础数据。同时课题组前期对月见草的总提物进行了抗肺纤维化活性筛选研究,为明确其药效物质基础,本研究对其化学成分进行分离纯化,为其进一步的开发利用奠定基础。

