穿心莲内酯衍生物的合成及活性研究进展
刘天福,杜枭年,张义福,张 建,2*
1甘肃中医药大学 药学院;2甘肃省高校中(藏)药化学与质量研究省级重点实验室,兰州 730000
传统中药穿心莲(Andrograppaniculata(Burm.F) Nees)为爵床科植物,归心、肺、大肠、膀胱经,味苦且性寒。具有清热解毒、凉血消痈等功效[1]。穿心莲内酯(andrographolide,分子式C20H30O5,结构见图1),为白色方棱形结晶,是药用植物穿心莲的主要提取物。研究表明,穿心莲内酯具有广泛的生物活性,如抗感染[2]、保肝利胆[3]、抗癌[4]、抗炎[5]、抗菌[6]、抗疟[7]、免疫调节[8]、抗心脑血管疾病[9]、抗病毒[10]等,临床应用广泛且效果显著。据文献报道,Boorsma小组首次从穿心莲中分离出一种无色晶体,后经Gorter小组结构鉴定为内酯类化合物,于是被命名为andrographolide[11]。现代穿心莲内酯提取工艺多采用超声提取法[12]。Gao[13]于2011年通过仿生多烯环化,首次完成了穿心莲内酯的不对称全合成。穿心莲内酯是双环二萜内酯类化合物,为反式稠环半日花烷骨架,由两个椅式构象的稠合六元环与五元内酯环构成,并有C-3位仲羟基、C-19位伯羟基和C-14位烯丙位仲羟基,两个环外双键,这些基团为穿心莲内酯结构的修饰带来了很多的活性位点。由于穿心莲内酯存在水溶性差,体内稳定性差等缺点,致使其体内生物利用率低,临床使用受到一定的限制,且目前在临床上主要用于抗炎。基于穿心莲内酯本身的性质缺陷和其相对活泼的结构特性,近年来研究者做了大量的结构修饰和活性筛选工作,以期发现更有效的候选药物。本文主要从抗肿瘤、抗炎、抗菌和抗病毒四个方面来介绍穿心莲内酯衍生物的合成以及其活性研究进展。

图1 穿心莲内酯化学结构Fig.1 The chemical structure of andrographolide
1 穿心莲内酯衍生物的合成及活性研究
1.1 抗肿瘤活性
2005年,Xu等[14]以穿心莲内酯(1)为原料,和硝基甲烷首先发生Michael加成反应,然后铁粉/醋酸还原硝基成氨基,再乙酰化,最后对羟基进行酯化合成得到10个N-乙酰基-12-氨基亚甲基-14-脱氧穿心莲内酯衍生物(2a~2j),合成路线见图2。通过筛选发现化合物2c对SMMC-7721(人肝癌细胞)具有较强的抑制活性。同年,Xu等[15]再次利用Michael加成反应、酯化反应,合成了16个新的穿心莲内酯硝甲基衍生物(3a~3p),合成路线见图3。通过建立体外细胞模型,筛选后发现化合物3a~3c、3f~3i、3k~3n、3p对BGC-823(人胃癌细胞)的抗肿瘤活性优于穿心莲内酯,其中化合物3n活性最强。3e、3f、3p对SMMC-7721(人肝癌细胞)的抗肿瘤活性优于穿心莲内酯,其中化合物3e活性最强。化合物3a~3p对SGC-7901(人胃腺癌细胞)的抗肿瘤活性均优于穿心莲内酯,其中化合物3a的活性最强。

图2 穿心莲内酯的结构修饰策略1Fig.2 Structural modification strategy 1 of andrographolide

图3 穿心莲内酯的结构修饰策略2Fig.3 Structural modification strategy 2 of andrographolide
2008年,Han等[16]以穿心莲内酯为底物,合成了脱水穿心莲内酯(4)、14-去氧穿心莲内酯(5)、异穿心莲内酯(6)、穿心莲酸(7),合成路线见图4。通过建立HL-60细胞(人白血病)体外模型和小鼠H22肝癌皮下移植肿瘤体内模型,发现异穿心莲内酯(6)的抗肿瘤活性最强,构效关系表明五元内酯环是抗肿瘤活性的必需基团,形成四氢呋喃环可以增强抗肿瘤活性(见图4)。
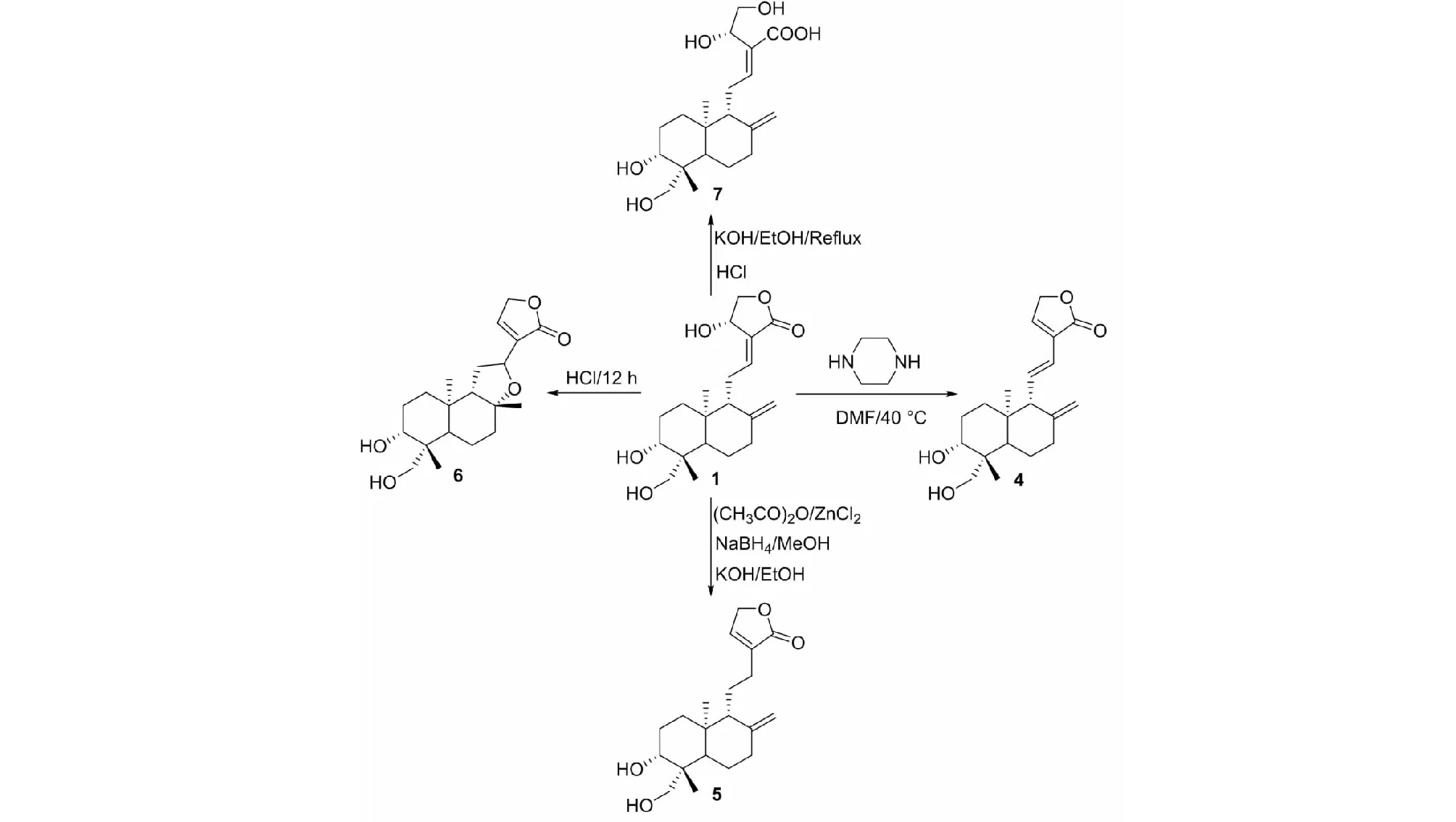
图4 穿心莲内酯的结构修饰策略3Fig.4 Structural modification strategy 3 of andrographolide
2010年,Fan等[17]以穿心莲内酯为先导物,先将C-3、C-19位羟基保护起来,再与甲磺酰氯反应,再与胺类化合物发生迈克尔加成反应,最后脱去保护基团生成了8个结构为12-N-取代-14-脱氧穿心莲内酯衍生物(8a~8h),合成路线见图5。其中化合物12-(4-溴苯胺基)-14-脱氧穿心莲内酯(8d)具有显著的体内外抗肿瘤作用,其机制可能与激活 p53 依赖性凋亡诱导途径有关。

图5 穿心莲内酯的结构修饰策略4Fig.5 Structural modification strategy 4 of andrographolide
2011年,Xu等[18]以穿心莲内酯为原料,利用Michael加成和还原反应得到胺类衍生物,再与异氰酸酯反应,合成了14个12-亚甲基脲-14-脱氧穿心莲内酯衍生物(9a~9n),合成路线见图6,在经过筛选后,发现化合物9f和9m显示出中等的细胞毒活性,构效关系表明在C-12位引入较长的亲水基团会显著增强细胞毒性活性;同年,Xu等[19]又以穿心莲内酯为原料,与硝基甲烷发生Michael加成反应,再用锌粉盐酸还原硝基得到胺衍生物,最后与羧酸或者磺酰氯进行酰化,合成得到17个12-[N-酰基氨甲基]14-脱氧穿心莲内酯衍生物(10a~10n、11a~11c),合成路线见图7,他们运用MTT法筛选后,发现合成的化合物抗肿瘤活性均弱于穿心莲内酯,因此表明在C-12位引入(磺)酰胺并不能提高抗肿瘤活性。

图6 穿心莲内酯的结构修饰策略5Fig.6 Structural modification strategy 5 of andrographolide

图7 穿心莲内酯的结构修饰策略6Fig.7 Structural modification strategy 6 of andrographolide
2011年,Dong等[20]采用荷S180肉瘤小鼠模型、荷H22肝癌小鼠模型,对C-15位取代脱水穿心莲内酯衍生物12和13做了抗肿瘤活性分析,二者活性均强于穿心莲内酯。构效关系表明,穿心莲内酯脱水后,进一步对C-15位的修饰会增强抗肿瘤活性(见图8)。

图8 穿心莲内酯的结构修饰策略7Fig.8 Structural modification strategy 7 of andrographolide
2015年,Guo等[21]以穿心莲内酯为原料,在3位和19位进行结构修饰,合成了8个新的脱水穿心莲内酯环磷酸酯类衍生物(14a~14h),合成路线见图9。筛选发现化合物(14g)对Tca-8113(舌癌细胞)具有较好的体外抑制活性。

图9 穿心莲内酯的结构修饰策略8Fig.9 Structural modification strategy 8 of andrographolide
2015年,Song等[22]以穿心莲内酯为先导物,通过甲硅烷基化、Fisher吲哚合成、羟基酰化等关键反应,最终合成了19个新的吲哚[3,2-b]穿心莲内酯衍生物,合成路线见图10,后通过筛选发现化合物15b~15e、15i、15j、15l~15n、17a、17b、18a、18b、20a、21a、21b对人体癌细胞株MCF-7(人乳腺癌)、HCT-116(人结肠癌)和DU-145(人前列腺癌)的抑制活性均优于穿心莲内酯。
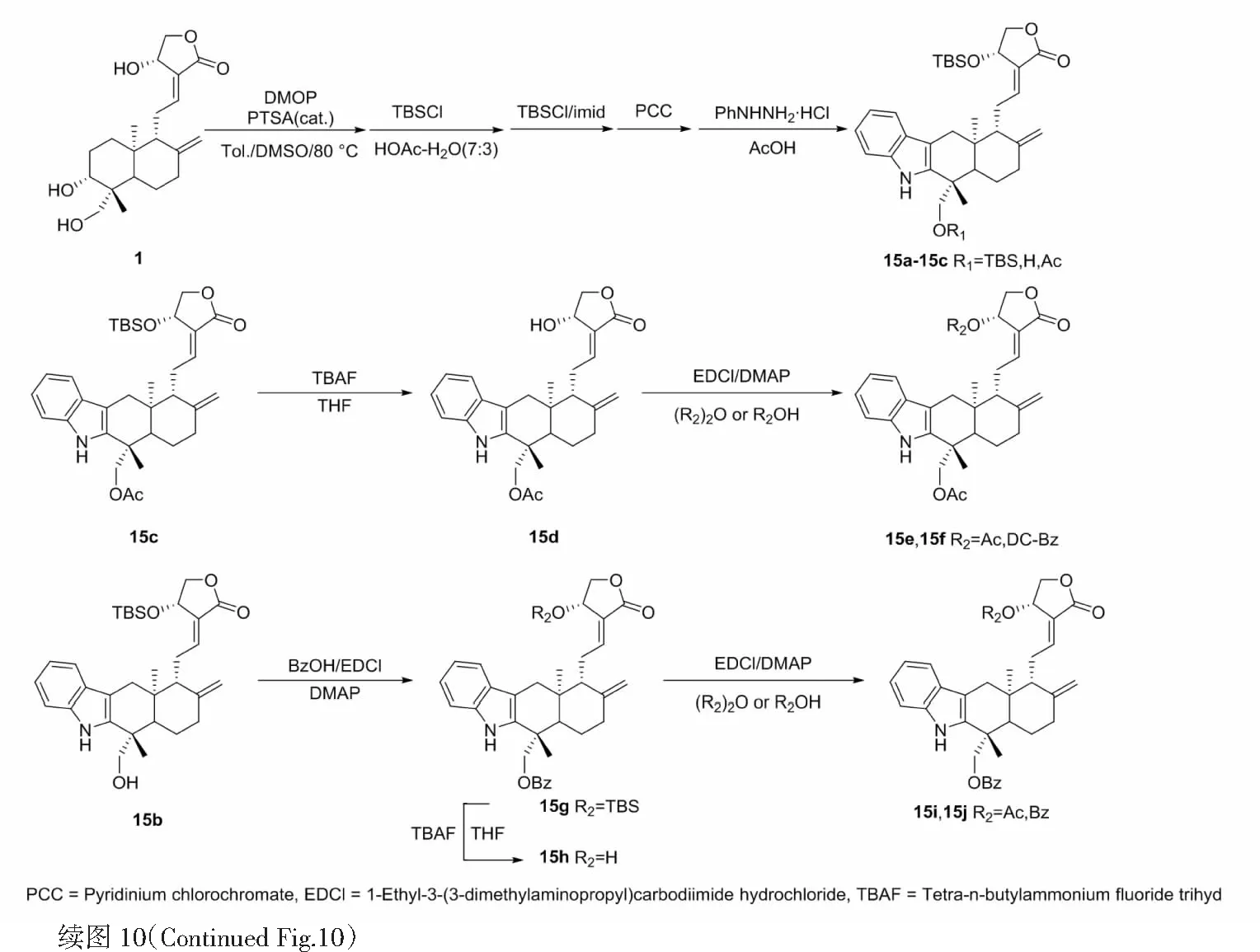

图10 穿心莲内酯的结构修饰策略9Fig.10 Structural modification strategy 9 of andrographolide
2015年,Devendar等[23]通过利用硝酸铈铵(CAN)诱导生成环缩醛,再经过酰化、氧化等合成了6个新的3,19-O-缩醛穿心莲内酯衍生物(22a~22f),合成路线见图11。筛选发现新化合物都具有较高抗癌活性,构效关系表明通过诱导C-3、C-19位羟基进行环缩醛保护或C-14位酯化,可以提高抗肿瘤活性。

图11 穿心莲内酯的结构修饰策略10Fig.11 Structural modification strategy 10 of andrographolide
2017年,Liu等[24]通过在C-12和C-14位羟基引入不同的芳香族和杂芳族取代基,合成了38个新的硫醚穿心莲内酯衍生物(23~60),合成路线见图12。通过筛选发现化合物28a、30、31、39、41、53、54,对前列腺癌细胞PC-3和人乳腺癌细胞MDA-MB-231表现出较好的抑制率。构效关系表明3、19-异亚丙基穿心莲内酯类似物比C-3、C-19位羟基无保护的穿心莲内酯类似物具有更好的抗肿瘤活性;与芳香族硫醚相比,杂芳硫醚具有更好的活性(见图12)。

图12 穿心莲内酯的结构修饰策略11Fig.12 Structural modification strategy 11 of andrographolide
2017年,Kandanur等[25]通过迈克尔加成反应,将各种磺酰胺药效团引入,合成了6个新的C-12取代芳基氨基14-脱氧穿心莲内酯衍生物(61a~61f),合成路线见图13。发现化合物(61a~61e)

图13 穿心莲内酯的结构修饰策略12Fig.13 Structural modification strategy 12 of andrographolide
与穿心莲内酯、三乙酰穿心莲内酯相比,抗肿瘤活性更强,构效关系表明在C-12芳基穿心莲内酯类似物中引入磺酰胺部分,会增强抗肿瘤活性。
2017年,Guo等[26]建立乳腺癌细胞和肺癌细胞模型,采用MTT法检测,发现三乙酰穿心莲内酯(62)的抗肿瘤活性优于穿心莲内酯,其作用机制是通过对线粒体依赖途径的相关蛋白进行干预,导致肿瘤细胞凋亡,增强抗肿瘤活性(见图14)。

图14 穿心莲内酯的结构修饰策略13Fig.14 Structural modification strategy 13 of andrographolide
2019年,Mokenapelli等[27]以穿心莲内酯为原料,先进行羟基保护,再与丙炔酸在Cu催化作用下完成C-14羟基的选择性酯化,再在酸性条件下脱保护。然后三键与叠氮进行偶极加成,最终合成了14个新的14α-O-(1,4-二取代-1,2,3-三唑基)穿心莲内酯衍生物(63a~63n),合成路线见图15。筛选发现化合物63c的抗HCT-15(人结直肠腺癌细胞)活性最高,化合物63j的抗K562(人慢性髓系白血病细胞)活性最强,构效关系表明C-14α上的1,4-二取代-1,2,3-三唑酯起到主要活性作用,并且电负性基团的存在可能会增强抗肿瘤活性。
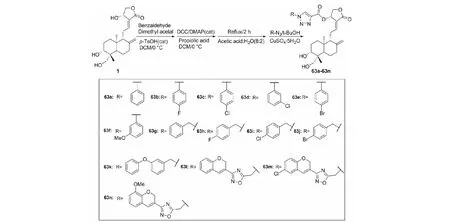
图15 穿心莲内酯的结构修饰策略14Fig.15 Structural modification strategy 14 of andrographolide
1.2 抗炎活性
2006年,Han等[28]建立蛋清致大鼠足肿胀模型,筛选发现异穿心莲内酯(6)的抗炎活性最强,其次为14-去氧穿心莲内酯(5)和脱水穿心莲内酯(4),构效关系表明形成四氢呋喃环,可以增强抗炎活性,五元内酯环存在与否并不会影响抗炎活性,当衍生物具有环外双键时,抗炎活性增强(见图16)。

图16 穿心莲内酯的结构修饰策略15Fig.16 Structural modification strategy 15 of andrographolide
2011年,Dai等[29]建立二甲苯所致小鼠耳肿胀和大鼠足趾水肿模型,筛选发现化合物64和65可以显著抑制小鼠耳水肿,化合物65对小鼠耳水肿和大鼠足跖水肿显示出最强的抗炎活性,此外,还可以显著抑制由0.6%醋酸溶液腹腔注射引起的小鼠肉芽肿形成和血管通透性增加。构效关系表明,在C-15位中引入对氯亚苄基可以增强抗炎活性(见图17)。

图17 穿心莲内酯的结构修饰策略16Fig.17 Structural modification strategy 16 of andrographolide
2013年,Guan等[30]建立了EV71(肠道病毒71型)感染Vero(非洲绿猴肾)细胞模型和7日龄ICR乳鼠重症HFMD(手足口病)模型,研究表明穿心莲内酯磺化物(喜炎平注射液)会抑制炎症因子分泌从而减轻组织炎症损伤、提高抗炎活性。
2015年,Chen等[31]研究穿心莲内酯对花生四烯酸(AA)致炎抑制作用,发现穿心莲内酯衍生物66可以减少小鼠耳肿胀组织中前列腺素E2(PGE2)和白三烯B4(LTB4)的产生,从而发挥抗炎作用(见图18)。
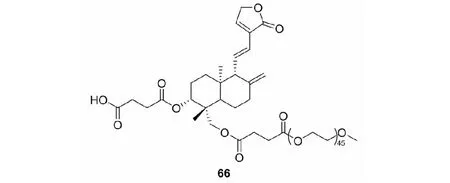
图18 穿心莲内酯的结构修饰策略17Fig.18 Structural modification strategy 17 of andrographolide
2015年,Guo等[32]以穿心莲内酯为原料,在C-3、C-19羟基引入环磷酸酯类结构,合成了化合物67a,以及亚硫酸钠的加成产物67b,合成路线见图19。后通过建立小鼠二甲苯耳肿胀模型,筛选发现化合物67a、67b具有强较好的抗炎活性。

图19 穿心莲内酯的结构修饰策略18Fig.19 Structural modification strategy 18 of andrographolide
2018年,Duan等[33]以14-α-硫辛酰基穿心莲内酯(68)为底物,与甘氨酸基团发生偶联反应,后脱除氨基的保护基合成了14-α-硫辛酰基穿心莲内酯-13,19-二甘氨酸盐酸盐(69),合成路线见图20。通过建立小鼠RAW 264.7细胞模型,发现化合物68和69均能抑制炎症细胞NO的释放,都具有良好的抗炎活性,并且化合物69具有良好的水溶性和低细胞毒性,有望成为治疗炎症的候选药物。

图20 穿心莲内酯的结构修饰策略19Fig.20 Structural modification strategy 19 of andrographolide
2019年,Wang等[34]合成了两个系列的穿心莲内酯衍生物。在系列1中,通过贝克曼重排改造A环结构,合成得到一系列己内酰胺衍生物(70a~70h),合成路线见图21。

图21 穿心莲内酯的结构修饰策略20Fig.21 Structural modification strategy 20 of andrographolide
在系列2中,将C-19位羟基转化为甲酰氨基,同时将C-3位羟基进行一系列酯化,引入不同的药效团,得到衍生物(71a~71j),合成路线见图22。构效关系表明,穿心莲内酯衍生物A环己内酰胺的形成和C-19羟基的酯化反应可以提高对HK2酶的抑制作用,从而增强其抗炎活性。

图22 穿心莲内酯的结构修饰策略21Fig.22 Structural modification strategy 21 of andrographolide
同年,Wang等[35]又利用生物电子等排体替代的方法,用小分子酚类化合物作为内酯环的生物等价键,合成了15个以含氮杂环、酚类和芳香酸作为内酯环生物等离基团的穿心莲内酯衍生物(72a~72i、73a~73i、74j、74k),合成路线见图23。筛选发现其中化合物74j的抗炎活性最强,构效关系表明小分子酚类化合物可以作为内酯环的生物等价体,用于提高穿心莲内酯衍生物的抗炎作用。
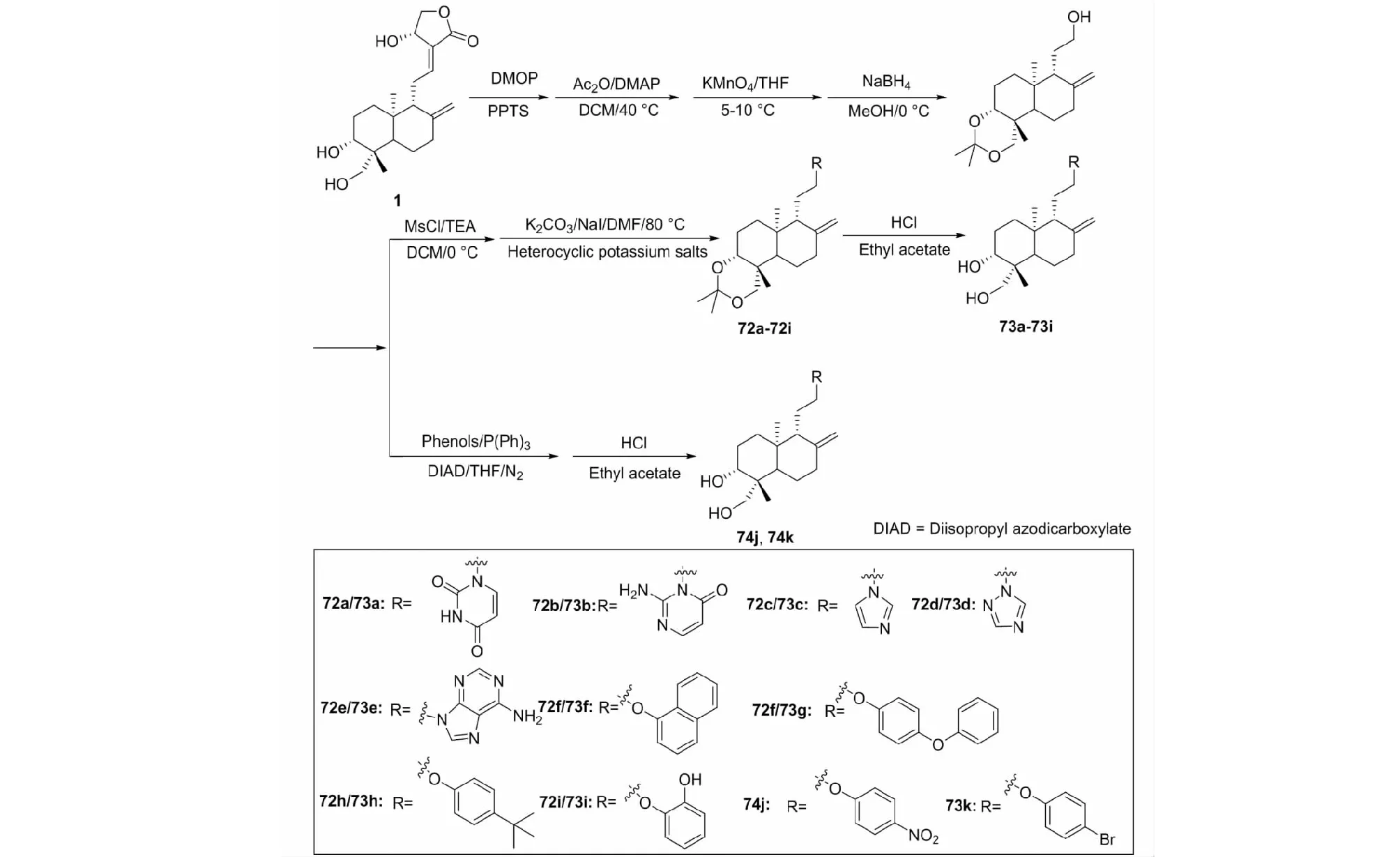
图23 穿心莲内酯的结构修饰策略22Fig.23 Structural modification strategy 22 of andrographolide
2020年,Liu等[36]以穿心莲内酯为原料,通过脱水、酰化等反应合成了14个新衍生物(75a~75c、76、76a~76c、77、77a~77d、78、78a),合成路线见图24。建立蛋清致大鼠足跖肿胀模型,筛选发现化合物76和77抗炎活性最强,构效关系表明穿心莲内酯衍生物的抗炎活性不能通过C-3、C-14、C-19羟基引入环外双键和酯基来改善,而新形成的四氢呋喃环和环内双键可以增强化合物的抗炎活性。


图24 穿心莲内酯的结构修饰策略23Fig.24 Structural modification strategy 23 of andrographolide
1.3 抗菌活性
2006年,Fan等[37]以穿心莲内酯为底物,与吡啶、乙酸酐反应生成三乙酰穿心莲内酯(62),合成路线见图25,该方法反应温和、产率高达81%。通过抑菌活性实验,发现化合物62在较高浓度下对枯草芽孢杆菌、黑根霉菌、苹果酵母B13和辣椒晚疫病菌的抑制效果均强于穿心莲内酯。

图25 穿心莲内酯的结构修饰策略24Fig.25 Structural modification strategy 24 of andrographolide
2010年,Wang等[38]以穿心莲内酯为原料,首先将C3、C19-羟基保护起来,再对C-14羟基进行酯化,引入不同的药效团,最后脱保护得到18个新的穿心莲内酯衍生物(79a~83a、79b~83b、84a~84d、84a~84d),合成路线见图26。筛选发现化合物79b、80b、81b、84b、85b抑菌活性较穿心莲内酯更强,构效关系表明C-14羟基部位是抗菌活性的必需基团,在C-14羟基引入不同长度碳链的酰基,其抑菌活性也不同,C-14羟基引入含有环烷基取代的直链酰基时,其对绿脓杆菌抑制活性更强。

图26 穿心莲内酯的结构修饰策略25Fig.26 Structural modification strategy 25 of andrographolide
2011年,Tang等[39]以穿心莲内酯为原料,通过硼氢化钠还原,Jones氧化反应、溴代,消除反应得到中间体86,86再经几种转化得到化合物87~91。同时,以穿心莲内酯为原料在碱性条件下开环得到羧酸类化合物,再转化成酯,合成了14个新的穿心莲内酯衍生物(88~94),合成路线见图27。用琼脂稀释法测定了这些化合物对大肠杆菌(Escherichiacoli)、铜绿假单胞菌(Pseudomonasaeruginosa)、表皮葡萄球菌(Staphylococcusepidermidis)、金黄色葡萄球菌(Staphylococcusaureus)、阴沟肠杆菌(Enterobactercloacae)、产气杆菌(Aerogenicbacilli)、大肠杆菌ATCC 25922和铜绿假单胞菌ATCC 27853的抑菌活性,筛选发现化合物94a~94c的抗菌活性均优于穿心莲内酯,其中化合物94a的抗菌活性是穿心莲内酯的32倍,具有成为新药的潜力。

图27 穿心莲内酯的结构修饰策略26Fig.27 Structural modification strategy 26 of andrographolide
2011年,Chen等[40]以穿心莲内酯为原料,利用Novozym 435(固定化脂肪酶)催化区域选择性酶促酰化合成5个14-酰化穿心莲内酯衍生物(95a~95e),合成路线见图28。通过液体稀释法评价了化合物95a~95e对典型的革兰氏阳性菌和革兰氏阴性菌的抗菌活性。其中14-丁酰穿心莲内酯(95b)的抗菌活性最强,它对蜡样芽孢杆菌(Bacilluscereus)和大肠杆菌(Escherichiacoli)的抑制活性与现有的抗生素庆大霉素和苯丙氨酸的活性相当,而穿心莲内酯则无此活性。构效关系表明C-14位内酯环上酰基部分的链长对抗菌活性起重要作用。
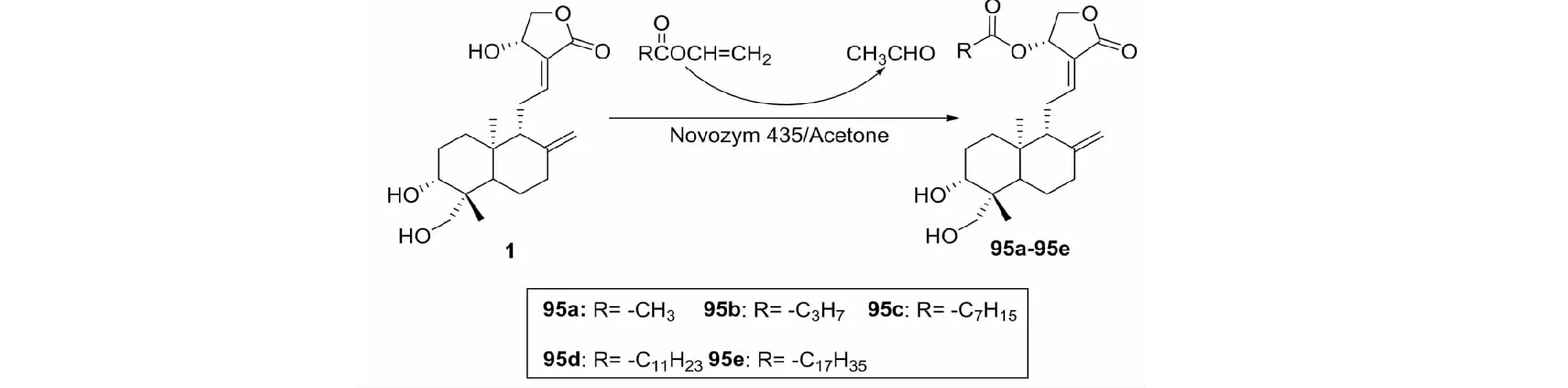
图28 穿心莲内酯的结构修饰策略27Fig.28 Structural modification strategy 27 of andrographolide
2016年,Peng等[41]以穿心莲内酯为原料,通过将端头烯键环氧化和C-19位引入叔丁基二甲硅基(TBS)基团,最终合成了12个新的8,17-环氧穿心莲内酯衍生物(96a~101a、96b~101b),合成路线见图29。抑菌活性实验发现化合物100a和100b对大肠杆菌、金黄色葡萄球菌和粪肠球菌的抑制活性均优于穿心莲内酯。

图29 穿心莲内酯的结构修饰策略28Fig.29 Structural modification strategy 28 of andrographolide
2016年,Sun等[42]以脱水穿心莲内酯为原料,在C-15位引入芳亚甲基,再对其3,19-羟基进一步修饰,最终合成得到14个15-芳亚甲基脱水穿心莲内酯衍生物(102a~108a、102b~108b),合成路线见图30。通过筛选发现,化合物108b对粪肠球菌的抑制活性优于脱水穿心莲内酯。

图30 穿心莲内酯的结构修饰策略29Fig.30 Structural modification strategy 29 of andrographolide
2018年,Li等[43]以穿心莲内酯为原料,首先将C-3、C-19羟基保护起来,后通过醚化、氧化、脱保护和引入芳环等反应合成了一系列14-芳氧基化合物,合成路线见图31。后通过筛选发现化合物109和110具有良好的活性。构效关系表明,C-14-芳氧基可以增强抗菌活性,C-19-羟基乙酰化极大降低了对大肠杆菌和金黄色葡萄球菌的抑制活性,C-3-醇转化为C-3-酮对抗菌活性影响不大,14-(8′-喹啉氧基)是一个很好的抗菌药物活性基团。

图31 穿心莲内酯的结构修饰策略30Fig.31 Structural modification strategy 30 of andrographolide
2018年, Patil Harshal S等[44]通过酯化反应合成了穿心莲内酯-14-乙酸酯(111a)、穿心莲内酯-14-丙酸酯(111b)、穿心莲内酯-14-丁酸酯(111c)、穿心莲内酯-14-己酸酯(111d)和穿心莲内酯-14-月桂酸酯(111e),合成路线见图32。发现这些衍生物比穿心莲内酯具有更好的抗菌活性,其抗菌活性随烷基取代链长度的增加而变化。

图32 穿心莲内酯的结构修饰策略31Fig.32 Structural modification strategy 31 of andrographolide
1.4 抗病毒活性
2008年,Xue等[45]建立了H9N2禽流感病毒鼠肺适应株模型,比较了穿心莲内酯、亚硫酸氢钠穿心莲内酯、穿心莲内酯衍生物(112)、炎琥宁(113)对抗H9N2禽流感病毒的活性,发现穿心莲内酯衍生物112、炎琥宁(113)具有显著的抗H9N2禽流感病毒作用,构效关系表明,炎琥宁是在穿心莲内酯六元环上引入双酯结构,使其溶解性增加,药效也产生了相应的改变(见图33)。

图33 穿心莲内酯的结构修饰策略32Fig.33 Structural modification strategy 32 of andrographolide
2016年,Xiao[46]随机将100名儿童腺病毒肺炎患儿分为两组作对比实验,组1为观察组,注射喜炎平注射液(穿心莲内酯磺化物)和静脉用丙种球蛋白。组2为对照组,只注射静脉用丙种球蛋白,连续治疗3~5天后,经观察、统计发现观察组总有效率高于对照组,差异有统计学意义,这表明穿心莲内酯磺化物具有抗腺病毒活性(见表1)。

表1 抗腺病毒疗效评定Table 1 Evaluation of anti-adenovirus efficacy
2017年,Feng[47]随机将100名甲型H1N1流感病毒患者分为两组,组1使用喜炎平注射液联合扎那米韦、组2使用扎那米韦,连续治疗5天后,经观察、统计发现注射了喜炎平注射液(穿心莲内酯磺化物)的一组患者疗效更好,这表明穿心莲内酯磺化物具有抗甲型H1N1流感病毒活性(见表2)。

表2 抗甲型H1N1流感病毒疗效评定Table 2 Evaluation of efficacy against influenza A H1N1 virus
2017年,Li等[48]随机将102名登革热患者分为两组,组1采用正常治疗,组2在正常治疗的基础上联合注射喜炎平注射液,连续治疗5~7天,经观察、统计发现组2患者退热天数、登革热症状消失天数、皮疹消失天数均少于组1患者,这表明穿心莲内酯磺化物具有抗登革热病毒活性,且无明显不良反应(见表3)。

表3 抗登革热病毒疗效评定Table 3 Evaluation of efficacy against dengue virus
2017年,Nie等[49]通过将62例儿童呼吸合胞病毒肺炎患儿随机分为两组做对比试验,组1给予利巴韦林,组2注射喜炎平注射液(穿心莲内酯磺化物),经观察、统计发现组2患儿的治愈率高于组1患儿,这表明穿心莲内酯磺化物具有抗呼吸道病毒的活性(见表4)。
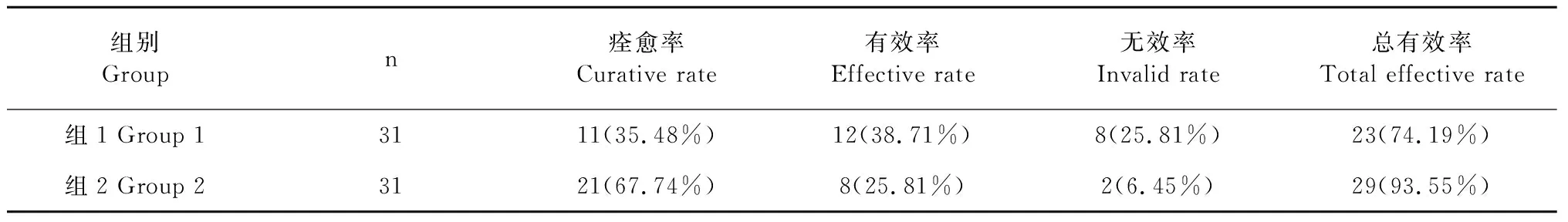
表4 抗呼吸道病毒疗效评定Table 4 Evaluation of efficacy against respiratory virus
2020年,Li等[50]以穿心莲内酯为原料,设计、合成了16个新的衍生物(114a~121a、114b~121b),合成路线见图34。并对其进行了抗ZiKa(寨卡)病毒感染试验,筛选发现衍生物120b的抗寨卡病毒活性最强。

图34 穿心莲内酯的结构修饰策略33Fig.34 Structural modification strategy 33 of andrographolide
2 构效关系总结
通过系统总结各研究小组的工作,对穿心莲内酯的结构修饰及构效关系总结如下(见图35)。

图35 穿心莲内酯的结构修饰构效关系图Fig.35 Structure-activity relationship diagram of structural modification of andrographolide
抗肿瘤活性:对穿心莲内酯的C-14位羟基进行酯化,会提高抗肿瘤活性;C-14α位引入1,4-二取代-1,2,3-三唑酯,也可以提高抗肿瘤活性;C-3、C-19位羟基形成环缩醛,会提高抗肿瘤活性;C-12位引入杂芳硫醚、芳基磺酰胺,会提高抗肿瘤活性;同时,穿心莲内酯的五元内酯环是抗肿瘤活性的关键药效团。
抗菌活性:研究发现,C-14羟基部位是抗菌活性必需基团;C-14羟基连接芳氧基,可以增强抗菌活性;C-14位内酯环上酰基部分的链长是决定抗菌活性的重要因素;同时发现,对C-19位羟基乙酰化,会使抗菌活性降低。
抗炎活性:我们总结发现,A环形成己内酰胺,会提高抗炎活性;C-15位引入苄基,会增强抗炎活性;五元内酯环内存在不饱和键可以提高抗炎活性,同时,小分子酚类化合物可以作为内酯环的生物等价体,提高抗炎活性;对C-19位羟基选择性酯化,会增强抗炎活性。
3 结论
穿心莲内酯衍生物具有广泛的药理活性,各课题组仍致力于以其作为先导化合物,合成一系列活性更好的穿心莲内酯新衍生物。目前,穿心莲内酯的修饰类型多集中在对羟基的酯化、醚化、氧化、酰化、酰胺化、双键的加成、氧化、迈克尔加成反应以及分子内环化反应等,新合成得到的衍生物分子表现出相对较强的抗炎、抗肿瘤、抗菌和抗病毒活性,其中化合物69因其具有良好的水溶性和低细胞毒性,有望成为治疗炎症的候选药物,化合物94a有望开发为新的抗菌药物。但目前对衍生物分子活性的作用机制大多还未研究清楚,因此多数活性衍生物还未很好地应用于临床。因此,在未来的衍生物合成和活性筛选工作中,要应用计算机辅助药物设计等手段,结合活性验证实验,研究探讨活性衍生物分子的作用靶点,指导化合物的结构修饰工作,从而能使更多的衍生物分子能作为候选药物进入临床研究,甚至开发成新药应用于临床。综上所述,多年来各国科研工作者对穿心莲内酯衍生物的研究从未停止,他们基于前人的研究成果,不断寻求新路线以期合成新的穿心莲内酯衍生物。这些研究,为基于穿心莲内酯作为先导化合物的新药研发工作奠定了坚实的基础。

