脑胶质瘤的MRI诊断及预后影响因素分析
于 虹 王 娜 徐苗苗 王嘉奇
1.上海市质子重离子医院放射诊断科 (上海 201315)
2.上海市放射肿瘤学重点实验室 (上海 201315)
3.上海质子重离子放射治疗工程技术研究 中心 (上海 201315)
4.北京善方医院有限公司放射科 (北京 100027)
5.中国医科大学附属第一医院放射科 (辽宁 沈阳 110000)
脑胶质瘤病(gliomatosis cerebri,GC)是临床较为常见的一种颅内肿瘤疾病,约占全部颅内肿瘤40%,发病率高、复发率高且预后较差[1-2]。GC临床表现较为复杂,且其影像学表现容易与其他疾病混淆,临床诊断难度较大[3]。且GC类型多样,部分患者在采用手术及术后放化疗的方式治疗后预后依旧不够理想,且术后复发率较高[4-5]。核磁共振成像(Magnetic Resonance Imaging,MRI)可清晰显示GC的形态特征,是诊断及评估预后的首选检查方式[6]。本研究在诊断GC中采用MRI,探讨其对GC的诊断价值,同时通过对本文120例患者临床资料进行分析,研究影响GC患者预后的主要因素,以期为临床GC诊断及制定针对性治疗方案提供参考依据,报告如下。
1 资料与方法
1.1 一般资料对象选自2018年8月至2019年8月我院收治确诊为脑胶质瘤患者120例。
纳入标准:参考《实用外科学》[7],符合GC诊断标准;病例资料完整。排除标准:合并其他类型脑部肿瘤;以往有其他脑部肿瘤病史者。本次研究共纳入120例患者。其中男性78例,年龄5岁~71岁,平均年龄(39.63±6.31)岁;女性42例,年龄6岁~72岁,平均年龄(40.21±6.28)岁。依据WHO中枢神经系统肿瘤分类标准(2016年)[8],其中弥漫型星形细胞瘤(Diffuseastrocytoma,DA)患者有33例,胶质母细胞瘤(Glioblastomamultiforme,GBM)患者有21例,少突胶质细胞瘤(Oligodendroglioma,OD)患者有15例,室管膜瘤(ependymomas,EPN)患者有14例,脉络丛乳头状瘤(choroid plexus papilloma,CPP)患者有10例,毛细胞型星形细胞瘤(Pilocyticastrocytoma,PA)患者有10例,混合性胶质瘤(Mixed glioma,MG)患者有9例,间变型星形细胞瘤(anaplastic astrocytoma,AA)患者有5例,间变型室管膜瘤(Anaplastic ependymoma,AE)患者有3例。
1.2 检查方法选择采用超导型磁共振扫描仪(型号:GE1.5T及3.0T,厂家:深圳市贝斯达医疗股份有限公司,中国),常规行轴切位、矢状位以及冠状位扫描。扫描参数:视野(Field of vision,FOV)24cm,层厚6mm,间距2mm,矩阵256×256,激励次数(NEX)2。本研究所有患者均进行MRI平扫和增强扫描。增强扫描剂使用钆喷替酸葡甲胺(Gadoliniumdiethylenetetramine pentaacetic acid,Gd-DTPA),0.2mL/kg,流率3 mL/s。
MRI影像结果由两名影像诊断工作时间10年以上经验丰富的医生进行双盲阅片,如同一张影像学图片出现阅片结果不一致的情况,则由二人共同探讨得出最后一致结果。
1.3 统计学方法使用SPSS 22.0统计软件处理数据,计量资料以()表示,采用 t检验;计数资料以率(%)表示,采用χ2检验或Fisher确切概率分析,单因素分析采用χ2检验,有统计学意义数据进行多因素Logistic回归分析,筛选影响因素,P<0.05,代表差异有统计学意义。
2 结果
2.1 不同类型GC的MRI影像学特点
2.1.1 DA的MRI影像学特点 在33例DA患者中7例影像学特征为MRI T1加权成像(T1-weighted images,T1WI)低信号,MRI T2加权成像(T2-weighted images,T2WI)高信号,瘤周可见明显水肿;7例患者发生薄壁环样强化患者,其中花环样4例,单环样3例;26例为T1WI等低信号,T2WI等高信号,瘤体周未发生明显水肿。扫描增强之后15例无强化,8例不均匀斑点、片状轻中度强化,3例出现斑片样明显强化。
2.1.2 AA的MRI影像学特点 5例AA患者MRI影像学特征为T1WI等低信号、T2WI等高信号,瘤周可见明显水肿,扫描增强之后3例呈不规则环样强化,囊壁厚薄不均,2例呈明显团块样强化,内散在分布囊变区。
2.1.3 PA的MRI影像学特点 10例PA患者MRI影像学特征为5例为囊实性,3例为大囊壁伴壁结节,T1WI呈等低信号,T2WI等高信号,瘤体周无水肿,扫描增强之后扫描实性部分、壁结节明显强化,囊壁的最长直径可达5.5 cm,2例为T1WI呈低信号,T2WI高信号,瘤体周围无水肿,扫描增强之后无强化。
2.1.4 OD的MRI影像学特点 15例OD患者MRI影像学特征均为T1WI等低信号,T2WI高信号,囊变及钙化灶,瘤体周围轻中度水肿,扫描增强之后呈轻中度斑点和线条状强化。
2.1.5 EPN的MRI影像学特点 17例EPN患者中有14例MRI影像学特征为6例T1WI低信号,T2WI高信号,8例MRI表现为T1WI等低信号,T2WI等高信号,病变囊性成分较多,实性部分偏侧性,瘤周无明显水肿,扫描增强之后呈不规则环状强化。3例AE的MRI影像学特征为T1WI等低信号、T2WI等高信号,囊性成分相对而言更多,瘤体周围水肿明显,扫描增强之后呈明显环状样强化。
2.1.6 CPP的MRI影像学特点 10例CPP患者MRI影像学特征均为T1WI及T2WI均为分叶状等信号,脑室系统扩大,扫描增强之后呈显著均匀性强化。
2.1.7 GBM的MRI影像学特点 21例GBM患者MRI影像学特征为T1WI等低信号、T2WI等高信号,瘤体周围水肿明显扫描增强之后11例患者花环样明显强化,7例其壁厚薄呈不均匀花环样,3例为多发薄壁花环样及结节样强化。
2.1.8 MG的MRI影像学特点(9例) 9例MG患者中6例少突星形细胞瘤MRI影像学特征均为T1WI低信号,T2WI高信号,扫描增强之后病灶3例无变化,2例不规则环样强化,1例斑片样强化;3例间变型少突星形细胞瘤MRI影像学特征为T1WI等低信号、T2WI等高信号,瘤体周围水肿情况明显,扫描增强之后,囊壁厚薄不均,呈不规则环样强化。
2.2 典型影像学图像
2.3 120例GC患者预后单因素分析本研究随访时间至2020年8月,共生存70例,死亡50例,生存率为58.33%。结果显示,年龄<60岁、完全切除病灶、术后进行化疗、肿瘤分级Ⅰ-Ⅱ级、肿瘤直径<5 cm、术前卡氏预后评分(Karnofsky Performance Status,KPS)[9]≥70分患者生存率高于年龄≥60岁、部分切除病灶、术后不进行化疗、肿瘤分级III-IV级、肿瘤直径≥5 cm、术前KPS评分<70分患者,比较差异具有统计学意义(P<0.05),见表1。
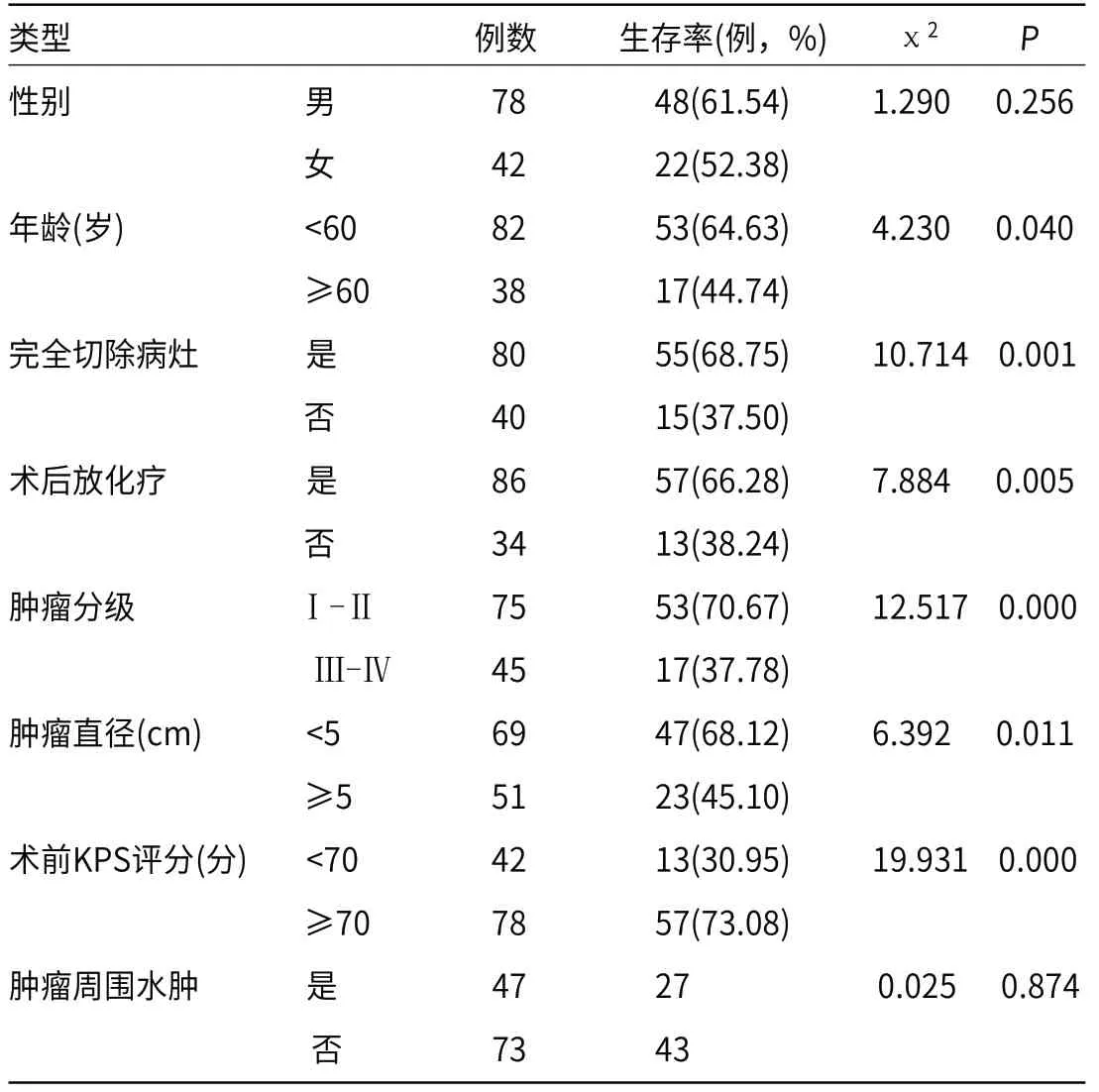
表1 120例GC病例预后单因素分析
2.4 120例脑胶质瘤患者预后影响因素分析将前述组间具有统计学意义指标进行Logistic回归分析,(年龄<60岁=0,≥60=1;完全切除病灶=1,部分切除病灶=0;术后进行化疗=0,术后不进行化疗=1;肿瘤分级v级=0,肿瘤分级Ⅲ-Ⅳ级=1;肿瘤直径<5 cm=0,肿瘤直径≥5 cm=1;术前KPS评分≥70分=0,术前KPS评分<70分=1),结果显示,年龄、切除病灶方式、术后化疗、肿瘤分级及肿瘤直径为脑胶质瘤患者预后的影响因素,见表2。
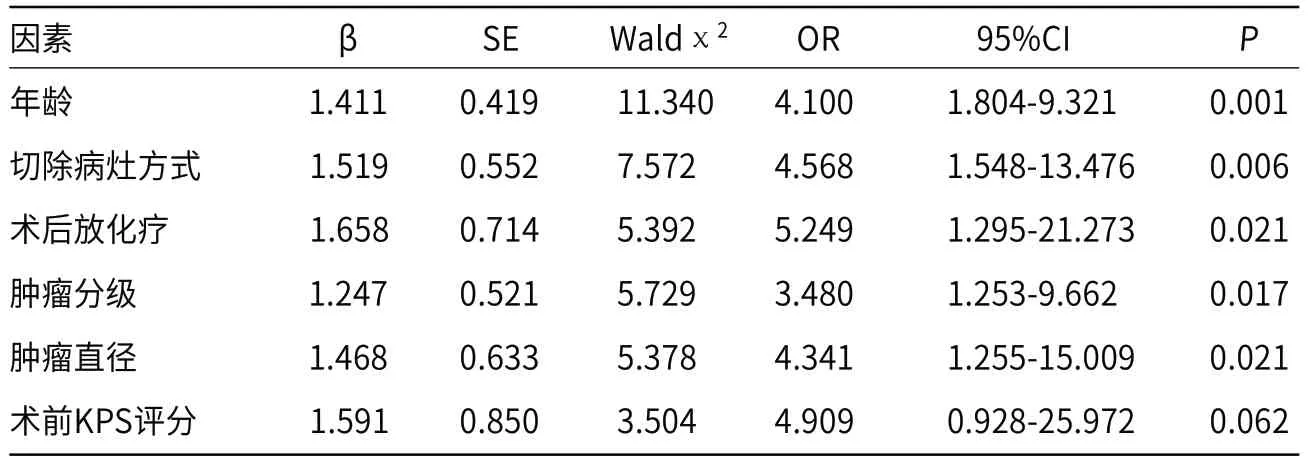
表2 脑胶质瘤患者预后影响多因素分析
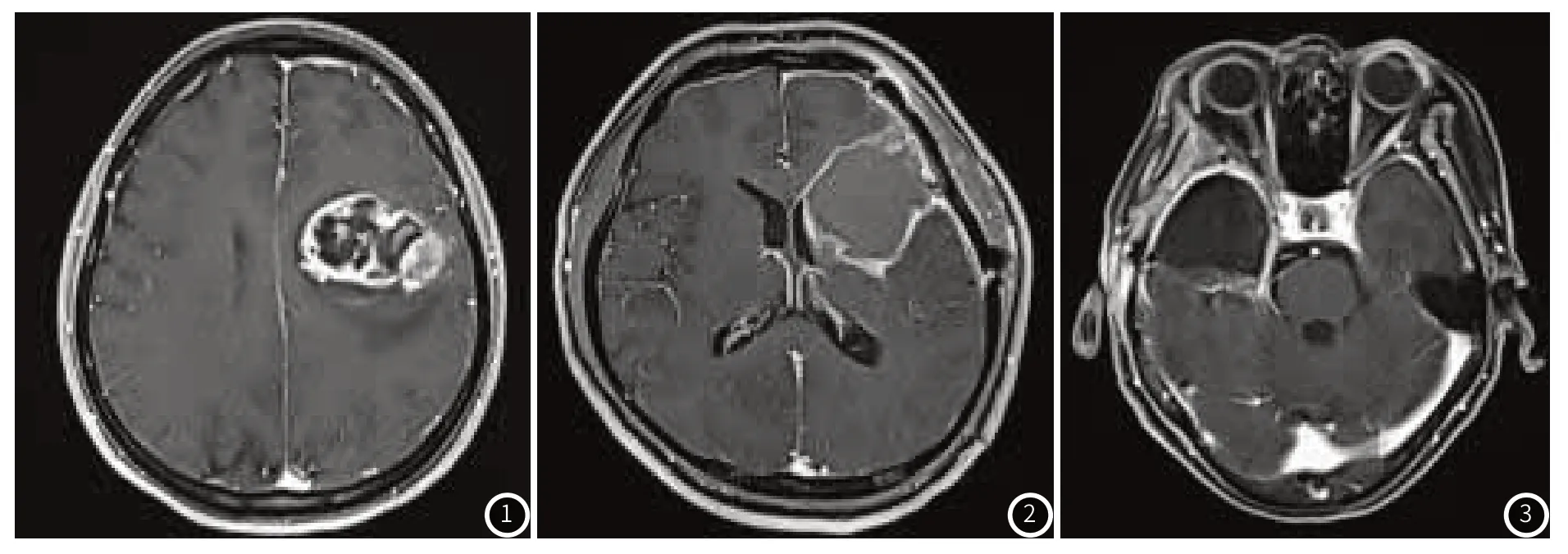
图1 为额叶胶质瘤;图2 为星形细胞瘤;图3 为胶质母细胞瘤
3 讨论
GC为起源于脑神经上皮组织内胶质细胞的原发性颅脑肿瘤,其在中枢神经系统肿瘤中占比高达30%[10]。按照肿瘤细胞形态学分类可分为GBM、EPN以及CPP等。
PA为GC良性高发于儿童及青少年,主要发病部位为小脑半球,病灶界限清晰,内壁光滑,可表现为囊性病变,在MRI增强扫描后可出现明显强化现象;DA多发于20岁~40岁人群,主要发病部位为大脑半球白质,在MRI增强扫描后可出现轻度斑点状或无强化现象,其中少数患者可出现明显强化现象,临床多与血管母细胞瘤做鉴别区分,血管母细胞瘤MRI增强征象多为明显强化现象[11]。CPP发病部位在侧脑室时,需与临床脑膜瘤进行鉴别诊断,脑膜瘤多发于成年人,且边缘光滑。EPN发病部位位于四脑室时需与髓母细胞瘤进行鉴别诊断,多数髓母细胞瘤病灶边界清晰,MRI征象为均匀实质信号,在MRI增强扫描后表现为明显强化现象[12]。OD需与低级别星形细胞瘤进行鉴别诊断,低级别星形细胞瘤发病人群年龄较小,主要发生部位位于大脑深部,肿瘤四周未见明显水肿与强化现象[13],若出现明显钙化现象,结果应倾向于OD。
本研究结果显示,在随访一年时间内120例脑胶质瘤患者共生存70例,死亡50例,生存率为58.33%,与以往结论一致[14],说明影响患者预后的因素较多,带有不确定性,需对其预后相关因素进行深入分析。本研究经多因素分析结果表明年龄、切除病灶方式、术后化疗、肿瘤分级及肿瘤直径为GC患者预后的影响因素。本文结果显示年龄<60岁生存率高于年龄≥60岁患者,与前研究结论一致[15],得出年龄越小患者生存时间越长的结论。同时本文结果显示,肿瘤分级Ⅰ-Ⅱ级、完全切除病灶患者生存率高于肿瘤分级Ⅲ-Ⅳ级、部分切除病灶患者。分析原因为低分级GC病灶恶性程度较低,病灶生长速度较慢,且病灶浸润程度不高,有利于手术切除病灶[16],说明当GC病灶病理分级越高,患者预后越差。本文结果还发现,肿瘤直径<5cm的患者接受治疗后生存率明显高于肿瘤直径≥5cm的患者。说明当肿瘤直径较小时患者生存率可明显上升,分析原因为患者在接受手术治疗后进行放化疗后可稳定手术效果,清除肿瘤细胞,与李康等[17]研究结果相似,证实肿瘤直径越小,患者预后越好的观点。有研究指出[18],当患者接受手术治疗后联合放疗可使得脑胶质瘤患者5年生存率提高15%以上,本研究结果显示,当患者在手术治疗后进行放化疗后生存率高于未进行放化疗的患者,得出在接受手术治疗后应用放化疗可有效提高患者生存率的观点。
综上所述,不同类型GC患者MRI影响结果具有特异性,可对其进行较为详细的诊断,为临床鉴别诊断疾病提供参考依据;且本研究发现年龄、切除病灶方式、术后化疗、肿瘤分级及肿瘤直径为脑胶质瘤患者预后的影响因素,需针对以上影响因素进行相对应处理措施。

