固本安神方对绝经综合征模型大鼠的作用及作用机制*
郭珊珊,周晓辉,王淑梅,宗传杰,刁 丽
(河北省沧州市人民医院,河北 沧州 061000)
绝经综合征又称围绝经期综合征或更年期综合 征,症状轻重不一,持续时间不一,严重影响成年女性的身心健康和生活质量[1-2]。我国处于绝经期女性有1.3亿人,其中90%出现绝经综合征[3]。固本安神方由葛根、黄芩、五味子、生地黄、淫羊藿、巴戟天等12味中药组方,具有滋阴补阳、交通心肾之功效,用于绝经前后诸证属阴阳两虚者,为临床有效的验方[4],由二仙汤基础上化裁加味而来。二仙汤出自《中医方剂临床手册》,临床常用于治疗阴阳两虚型绝经综合征。在本方基础上,加丹皮、黄芩清热,加酸枣仁、远志、夜交藤养心安神并交通心肾。本研究中探讨了固本安神方治疗绝经综合征模型大鼠的作用及作用机制,为其临床应用和新药开发提供实验基础。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:移液器(20~200µL,芬兰Finnpipette公司);TGL16M型高速冷冻台式离心机(上海卢湘仪离心机仪器有限公司);LAbOSPECT-008AS型全自动生化分析仪(日本株式会社日立制作所);PH-140型恒温培养箱(武汉一恒苏净科学仪器有限公司);Tianshi-988型洗板机(北京天石天力医疗器械技术开发中心);PHY-Ⅲ型病理组织漂烘仪,PBM-B型包埋机(普瑞斯星医疗器械有限公司);LEICARM2235型切片机(德国徕卡公司);Rayto RT-6100型酶标仪(深圳雷杜生命科学股份有限公司);Mettler Toled 0型电子天平(瑞士梅特勒-托利多公司,精度为万分之一);OLYMPUSBX43型显微镜(日本奥林巴斯公司);NANO 2000型紫外分光光度计(美国赛默飞公司);Exicycler 96型荧光定量聚合酶莲式反应(PCR)仪(韩国Bioneer公司);WD-9405B型水平摇床,DYY-7C型电泳仪,DYCZ-40D型转移槽,WD-9413B型凝胶成像系统,购于北京六一仪器厂。
试药:固本安神方由葛根、黄芩、五味子、生地黄、淫羊藿、巴戟天等12味中药组方,按处方工艺用10倍量水浸泡0.5 h后,按每次90 min和60 min分别回流提取2次,合并2次煎液,并浓缩至每1 mL药液含生药总量1.8 g;更年安片(中药阳性对照药,江西南昌桑海制药有限公司,批号为190387);戊酸雌二醇片(西药阳性对照药,Delpharm Lille S.A.S.,批号为491A)。大鼠促黄体生成素(LH)、大鼠促卵泡生长激素(FSH)、大鼠雌二醇(E2)酶联免疫吸附(ELISA)试验试剂盒(江苏酶免实业有限公司,批号分别为MM-0624R1,MM-0566R1,MM-0575R1);无机磷(P)、钙(Ca)检测试剂盒(富士胶片和光纯药株式会社,批号分别为003052,011286);血脂4项[三酰甘油(TG)、胆固醇(CHO)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)]试剂盒(中生北控生物科技股份有限公司,批号分别为198031,192061,211491,201401);伊红(生工生物工程股份有限公司,批号为A600190);无水乙醇(国药集团化学试剂有限公司,批号为10009218);TRIpure,RNase inhibitor(北京Bio Teke公司,批号分别为RP1001,RP5602);BeyoRTⅡM-MLV反转录酶(上海碧云天公司,批号为D7160L);苏木精(批号为H8070),2×Taq PCR Master Mix,SYBR Green(批 号 分 别 为PC1150,SY1020),均购自北京Solarbio公司;PCR检测反应引物(金斯瑞生物科技有限公司),其序列见表1。

表1 PCR检测反应引物序列Tab.1 Primer sequences for PCR detection
动物:3月龄SD雌性大鼠80只,健康清洁级,体质量220~250 g,由辽宁长生生物技术股份有限公司提供,实验动物合格证号SCXK(辽)2020-0001。本研究方案经医院医学伦理委员会审查批准(批件号为2020KY038)。
1.2 试验方法
造模:将80只大鼠适应性喂养7 d后,随机取70只,用水合氯醛麻醉后行双侧卵巢切除术,以构建绝经综合征模型大鼠。大鼠麻醉后侧卧于手术台上,肋脊角下方2 cm与脊柱外侧2 cm交叉处剪毛,消毒;切开皮肤,钝性剥离筋膜膜层、肌肉层、腹膜层,可见脂肪团,翻开脂肪团褶皱处可见粉红色菜花样卵巢组织;结扎输卵管和周围脂肪组织后,再剪去卵巢及周边脂肪组织,将脂肪组织回填腹腔复位后,分层缝合各层组织,消毒皮肤,撒敷适量抗菌药物,另一侧卵巢同法切除。假手术组大鼠仅切除卵巢周围适量脂肪组织,手术方法同上。术后第5天开始,对每只大鼠进行阴道涂片检查,每天1次,连续7 d,通过涂片确认动情周期反应进行,以此确认造模是否成功[5-6]。
分组与给药:将上述造模成功的大鼠随机分为模型对照组(C组),中药对照组(D组),西药对照组(E组),固本安神方高、中、低剂量组(F1组、F2组、F3组),假手术大鼠作为假手术对照组(B组),剩余未做手术的大鼠作为空白对照组(A组),各10只。A组、B组、C组大鼠按每100 g体质量1 mL灌胃生理盐水。其余各组大鼠灌胃相应药物,根据人与大鼠用药换算系数计算大鼠每日每千克体质量的给药量。F1组、F2组、F3组分别给予相当于每千克体质量的生药18.0,9.0,4.5 g,D组给予0.56 g/kg更年安片,C组给予0.1 mg/kg戊酸雌二醇片。
样本采集:造模成功后1周开始给药,给药周期为4周,自适应性喂养开始,每周定期称定体质量。于给药4周后取材,取材前12 h禁食不禁饮,于末次给药30 min后,麻醉取材。于髂主动脉采血,分别置装有不同抗凝剂的采血管中。另取下丘脑组织,用滤纸吸干表面水分及少许血液,迅速装入冻存管,置-80℃冰箱保存,用于PCR检测。再取大鼠子宫、肾上腺、胸腺和脾脏,分别称定质量,计算脏器指数。另取大鼠子宫固定于10%甲醛溶液中,用于病理形态学观察。
1.3 指标检测
血浆中E2,Ca,P及血脂4项水平的检测:用枸橼酸钠抗血凝,以3 000 r/min的转速离心10 min,取上层血浆,按试剂盒说明操作,检测E2,Ca,P的含量。再取上层血浆,用全自动生化分析仪测定血浆中CHO,TG,HDL-C,LDL-C的水平。
子宫、肾上腺、胸腺、脾脏脏器指数测定:取大鼠的子宫、肾上腺、胸腺、脾脏,称定其湿质量,脏器指数计算公式:脏器指数=脏器质量×1 000÷体质量。
子宫组织病理形态学检测:取2.1.3项下固定于甲醛溶液中的子宫组织适量,经常规包埋,切片,透明,脱蜡,脱水,苏木精染色8 min,水洗后伊红染色2 min,再次水洗,脱水,透明2次,中性树胶封片,置光镜下观察。
下丘脑组织中促性腺激素释放激素(GnRH)、磷脂酶C-β(PLC-β)、肌醇1,4,5-三磷酸受体1(IP3R1)mRNA表达水平检测:取2.1.3项下下丘脑组织样本5 mg,先进行总RNA提取(TRIpure裂解→氯仿萃取→分离水相→异丙酮提取→乙醇沉淀→RNasefree ddH2O溶解,即得样本总RNA),然后进行RNA浓度检测(紫外分光光度计于260 nm及280 nm波长处检测吸光度,计算浓度),再进行反转录(按反转录试剂盒说明书合成cDNA,用PCR仪完成反转录,得到20 µL cDNA样本),最后使用2×Taq PCR MasterMix试剂盒反应进行实时荧光定量PCR定量分析(反应体系:cDNA模板1µL,上下游引物各0.5µL,SYBR GREEN mastermix 10 µL,ddH2O 8 µL。反应条件:94℃预热5 min,94℃变性10 s,60℃退火20 s,72℃延伸30 s,40个循环)。以β-actin作为内参,采用2-ΔΔCt法分析目的mRNA的相对表达水平。
1.4 统计学处理
采用SPSS 22.0统计学软件分析。计量资料以±s表示,多组间比较采用单因素方差分析;组间两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 对体质量的影响
与C组比较,A组和B组大鼠第3周至第7周的体质量均显著降低(P<0.05),D组大鼠第7周的体质量显著降低(P<0.05),E组和F1组大鼠第4周至第7周的体质量均显著降低(P<0.05),F2组、F3组大鼠各时间段的体质量均无显著变化(P>0.05)。详见表2。
表2 各组大鼠体质量变化比较(±s,g,n=10)Tab.2 Comparison of body mass changes in each group(±s,g,n=10)

表2 各组大鼠体质量变化比较(±s,g,n=10)Tab.2 Comparison of body mass changes in each group(±s,g,n=10)
注:与C组比较,*P<0.05,**P<0.01。表3至表6同。Note:Compared with those in the group C,*P<0.05,**P<0.01(for Tab.2-6).
组别A组B组C组D组E组F1组F2组F3组第1周205.15±3.72 206.18±10.05 205.41±7.07 204.76±8.21 203.14±7.10 205.98±9.57 205.78±8.58 204.44±6.48第3周227.01±3.25**228.60±10.18**256.26±13.79 253.54±11.85 257.23±10.49 256.76±9.91 258.61±12.61 259.93±7.37第4周236.13±5.16**237.76±12.85**281.49±20.17 265.32±25.13 265.89±11.35*253.38±14.35**267.54±12.74 269.55±16.66第5周246.67±6.34**248.31±13.96**300.67±23.41 281.30±26.99 278.29±11.63*268.91±17.57**284.38±11.93 295.99±8.58第6周256.58±3.44**259.38±15.34**312.07±21.88 294.68±21.54 276.41±24.77**282.89±12.40**296.51±15.73 308.17±13.42第7周269.80±4.08**265.03±14.33**321.93±20.68 302.86±19.87*297.10±15.29**291.06±13.02**306.15±16.36 313.41±16.24
2.2 对血浆中E2,Ca,P水平的影响
与C组比较,A组、B组、D组、E组、F1组、F2组大鼠血浆中E2水平均显著升高(P<0.05),F3组大鼠血浆中E2水平无显著变化(P>0.05);A组、B组和D组、E组、F1组、F2组、F3组大鼠血浆中Ca和P水平均显著升高(P<0.05)。详见表3。
表3 各组大鼠血浆中E2,Ca,P水平比较(±s,n=10)Tab.3 Comparison of E2,Ca and P levels in plasma in each group(±s,n=10)
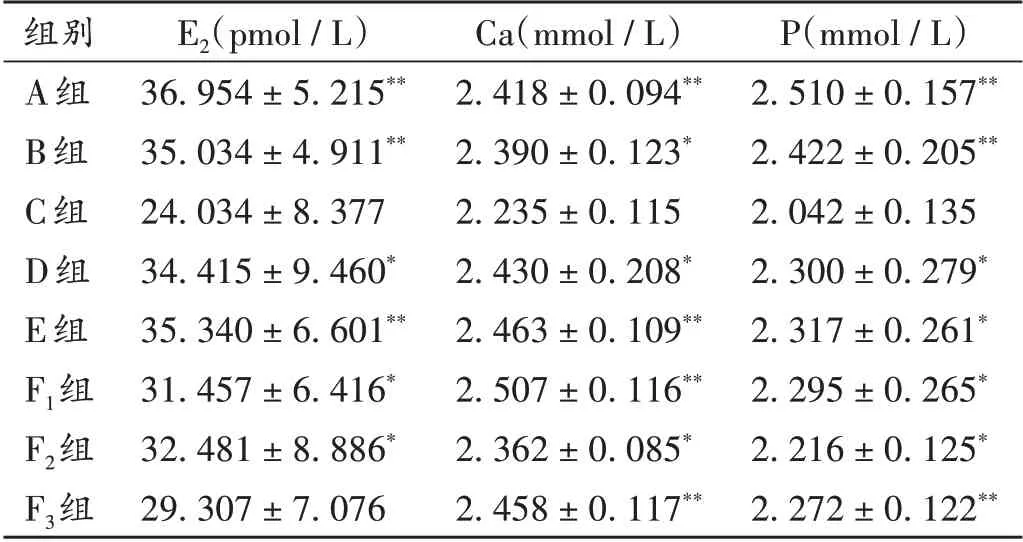
表3 各组大鼠血浆中E2,Ca,P水平比较(±s,n=10)Tab.3 Comparison of E2,Ca and P levels in plasma in each group(±s,n=10)
组别A组B组C组D组E组F1组F2组F3组E2(pmol/L)36.954±5.215**35.034±4.911**24.034±8.377 34.415±9.460*35.340±6.601**31.457±6.416*32.481±8.886*29.307±7.076 Ca(mmol/L)2.418±0.094**2.390±0.123*2.235±0.115 2.430±0.208*2.463±0.109**2.507±0.116**2.362±0.085*2.458±0.117**P(mmol/L)2.510±0.157**2.422±0.205**2.042±0.135 2.300±0.279*2.317±0.261*2.295±0.265*2.216±0.125*2.272±0.122**
2.3 对血脂4项水平的影响
与C组比较,A组、B组、D组、E组、F1组、F2组、F3组大鼠血浆中CHO和LDL-C水平均显著降低(P<0.05),A组、B组、D组、E组、F1组、F2组、F3组大鼠血浆中TG和HDL-C水平均无显著差异(P>0.05)。详见表4。
表4 各组大鼠血脂4项水平比较(±s,mmol/L,n=10)Tab.4 Comparison of levels of four blood lipid indexes in each group(±s,mmol/L,n=10)

表4 各组大鼠血脂4项水平比较(±s,mmol/L,n=10)Tab.4 Comparison of levels of four blood lipid indexes in each group(±s,mmol/L,n=10)
组别A组B组C组D组E组F1组F2组F3组CHO 1.414±0.268**1.474±0.446**2.000±0.247 1.788±0.219*1.727±0.304*1.752±0.137*1.802±0.170*1.781±0.210*TG 0.240±0.034 0.279±0.077 0.314±0.128 0.267±0.057 0.356±0.077 0.300±0.042 0.280±0.058 0.294±0.063 HDL-C 1.583±0.065 1.624±0.142 1.617±0.162 1.629±0.137 1.709±0.250 1.651±0.125 1.601±0.189 1.636±0.180 LDL-C 0.622±0.083*0.527±0.146**0.771±0.126 0.675±0.088*0.646±0.115*0.661±0.065*0.671±0.078*0.668±0.063*
2.4 对胸腺、脾脏、肾上腺、子宫脏器指数的影响
与C组比较,A组、B组大鼠胸腺、脾脏、肾上腺、子宫脏器指数均显著升高(P<0.05),D组、E组、F1组、F2组、F3组大鼠胸腺、肾上腺、子宫脏器指数均显著升高(P<0.05),D组、F1组、F2组、F3组大鼠脾脏脏器指数均显著升高(P<0.05),E组大鼠脾脏脏器指数无显著差异(P>0.05)。详见表5。
表5 各组大鼠胸腺、脾脏、肾上腺、子宫脏器指数比较(±s,n=10)Tab.5 Comparison of indexes of thymus,spleen,adrenal gland and uterus in each group(±s,n=10)

表5 各组大鼠胸腺、脾脏、肾上腺、子宫脏器指数比较(±s,n=10)Tab.5 Comparison of indexes of thymus,spleen,adrenal gland and uterus in each group(±s,n=10)
组别A组B组C组D组E组F1组F2组F3组胸腺2.352±0.180**2.427±0.459**1.531±0.387 2.201±0.552**2.081±0.426**1.990±0.437*2.100±0.381**1.957±0.387*脾脏2.515±0.175**2.556±0.323**2.212±0.204 2.592±0.339**2.221±0.243 2.439±0.260*2.466±0.273*2.470±0.317*肾上腺0.279±0.064*0.290±0.049**0.229±0.028 0.277±0.071*0.261±0.031*0.261±0.041*0.262±0.033*0.255±0.026*子宫2.107±0.328**2.370±0.374**0.529±0.062 0.625±0.140*1.056±0.493**0.584±0.048*0.613±0.018**0.588±0.062*
2.5 对子宫组织病理形态学的影响
A组和B组大鼠子宫管径粗大,有皱襞,内膜层深厚,腺体丰富,单层柱状上皮细胞排列整齐;C组大鼠子宫壁明显变薄,管腔狭窄,固有层细胞密集,无皱襞;D组和E组大鼠子宫管径粗大,有皱襞,内膜层较深厚,腺体较丰富,单层柱状上皮细胞排列较整齐;F1组大鼠子宫管径变大,出现皱襞,腺体增多,固有层细胞较不密集,单层柱状上皮细胞排列较整齐;F2组大鼠子宫管径变大,腺体增多,固有层细胞较不密集;F3组大鼠子宫腺体增多,固有层细胞略密集。详见图1。

A,A'.A组B,B'.B组C,C'.C组D,D'.D组E,E'.E组F,F'.F1组G,G'.F2组H,H'.F3组图1各组大鼠子宫组织病理形态改变(A-H,×100;A'-H',×200)A,A'.Group A B,B'.Group B C,C'.Group C D,D'.Group D E,E'.Group E F,F'.Group F1 G,G'.Group F2 H,H'.Group F3Fig.1 Pathomorphological changes of uterus tissue in each group(A-H,×100;A'-H',×200)
2.6 对下丘脑组织中GnRH,PLC-β,IP3R1 mRNA相对表达水平的影响
与C组比较,A组、B组、D组、E组、F1组、F2组、F3组大鼠下丘脑组织中GnRH,PLC-β,IP3R1 mRNA相对表达水平均显著升高(P<0.05)。详见表6。
表6 各组大鼠下丘脑组织中GnRH,PLC-β,IP3R1 mRNA相对表达水平比较(±s,n=10)Tab.6 Comparison of relative expression levels of GnRH,PLC-β and IP3R1 mRNA in hypothalamic tissue in each group(±s,n=10)

表6 各组大鼠下丘脑组织中GnRH,PLC-β,IP3R1 mRNA相对表达水平比较(±s,n=10)Tab.6 Comparison of relative expression levels of GnRH,PLC-β and IP3R1 mRNA in hypothalamic tissue in each group(±s,n=10)
组别A组B组C组D组E组F1组F2组F3组GnRH 1.00±0.08**1.01±0.08**0.41±0.03 0.59±0.03**0.83±0.05**0.86±0.06**0.80±0.04**0.81±0.04**PLC-β 1.00±0.08**1.05±0.10**0.48±0.01 0.84±0.03**0.53±0.04*0.95±0.03**0.73±0.03**0.73±0.01**IP3R1 1.00±0.08**0.96±0.05**0.51±0.04 0.81±0.06**0.85±0.08**0.80±0.06**0.68±0.04*0.60±0.05**
3 讨论
中医古籍文献并无绝经综合征的专门记载,根据该病的症候特点,诸多论述多归属“郁证”“不寐”“百合病”“藏燥”等病证范畴[7-8]。《内经》中早有关于女子“七七任脉虚,太冲脉衰少,天癸竭,地道不通”的记载,是中医学对女子生理变化的早期古朴唯物论的认识,认为女子年满“七七”后,冲、任两脉虚衰,阴阳失衡,肾气渐衰,天癸枯竭[9]。随着现代社会节奏的加快,女性社会压力逐渐增大,更年期症状愈发明显,患病率也逐渐升高。西医的激素代替疗法技术相对成熟、疗效显著,但还需进一步验证,以降低不良反应[10]。中医中药的安全性和有效性经过了几千年的实践验证,故对中医中药治疗绝经综合征的深入研究具有重要价值。
固本安神方具有滋阴补阳、交通心肾之功效,用于绝经综合征证属阴阳两虚者,是临床应用多年的有效验方。去势动物模型的复制周期短、操作简单、重复性和稳定性均高,是研究围绝经期的最佳动物模型,能体现大多数人类绝经期出现的循环系统疾病、代谢紊乱、骨质疏松等并发症[11]。本研究中采用双侧卵巢切除术构建绝经综合征模型,各组大鼠阴道分泌物涂片发现,A组与B组大鼠的动情周期变化与术前基本相同,其余各组均发生明显改变,镜下见大量白细胞,无成熟上皮细胞,表明去势手术彻底、绝经综合征动物模型复制成功,实验后期的性激素水平、病理检查等相关指标检测结果均证明模型复制成功。
基于下丘脑-垂体-卵巢轴理论,卵巢的分泌活动接受下丘脑和垂体的调控,卵巢分泌的激素影响子宫内膜周期性变化,丘脑-垂体-卵巢轴维持青春期发育和生殖等重要生理过程[12-13]。E2主要由卵巢分泌,反馈性调节下丘脑GnRH分泌,GnRH促进垂体前叶产生并分泌FSH和LH,FSH和LH促进卵巢分泌E2,以维持子宫内膜周期性变化,从而出现动情周期[5]。该过程中受PLC信号级联调节,GnRHR与Gq/11蛋白结合,激活PLC信号,并将信号传递给二酰基甘油(DAG)和肌醇1,4,5-三磷酸(IP3)刺激细胞内钙离子释放[14-15]。本研究结果发现,C组大鼠体质量显著升高,血浆中E2,Ca,P水平均显著降低,血脂中CHO和LDL-C水平均显著升高,胸腺、脾脏、肾上腺、子宫脏器指数均显著降低,子宫病理形态学上子宫壁显著变薄,管腔狭窄,固有层细胞密集,无皱襞,下丘脑组织中的GnRH,PLC-β,IP3R1 mRNA表达量均显著降低。经固本安神方治疗后,上述指标均被逆转,表明该药可有效降低绝经综合征模型大鼠的体质量,升高血浆中E2,Ca,P水平,降低血脂水平,增加子宫脏器指数,改善子宫病理形态学,升高肾上腺、胸腺和脾脏脏器指数,升高下丘脑组织中GnRH,PLC-β,IP3R1 mRNA相对表达水平。且F2组在改善相关指标的趋势上要优于F1组和F3组,这可能与中药复方具有双向调节特点有一定关系,后续研究中将继续探讨。
本研究中发现,固本安神方与中药阳性对照药更年安、西药阳性对照药戊酸雌二醇这2种临床常用药在各项指标上表现出了相同的作用趋势,也证明了其在治疗绝经期综合征的作用效果,其作用机制可能与调节GnRH/PLC-β信号通路相关,后续将对其作用机制进行深入研究,为中药新药的研究奠定实验基础。

