卡格列净通过SIRT1-FOXO3α信号通路改善小鼠肾小球系膜细胞自噬功能*
蔡 翔 , 王美君 , 徐 芬 , 梁小奇 , 梁 华 , 石 怡 , 周安东 , 蔡梦茵 △
(1中山大学附属第三医院内分泌与代谢疾病学科,广东 广州 510630;2广东省糖尿病防治重点实验室,广东 广州 510630)
糖尿病在中国已经成为一个重大的公共卫生问题,至2017年,中国糖尿病患病率已达11.2%[1]。糖尿病患者中,大约40%的病人伴有糖尿病肾病(diabetic kidney disease, DKD)。如今,DKD已经成为慢性肾脏疾病的首要原因,给家庭和社会带来巨大的经济负担[2]。
DKD的发病机制复杂,遗传因素、氧化应激和炎症等均参与了DKD的发生发展[3]。近年来,越来越多的研究表明自噬功能障碍参与了DKD的发生发展,恢复自噬功能起着有效的肾脏保护作用[4]。作为治疗糖尿病的新型药物,钠-葡萄糖协同转运蛋白2抑 制 剂(sodium-glucose cotransporter 2 inhibitor,SGLT2i)受到广泛关注。SGLT2i在DKD中的肾脏保护作用显著,大型随机双盲对照试验CREDENCE显示,SGLT2i卡格列净(canagliflozin)可有效降低2型糖尿病合并肾脏病患者肾衰竭的风险[5]。然而,SGLT2i肾脏保护功能的分子机制尚未完全明确,既往研究显示,改善自噬功能可能参与其中[6],但SGLT2i调控自噬的具体机制尚未完全阐明。
沉默信息调节蛋白1(sirtuin1, SIRT1)是一种去乙酰化酶,在维持葡萄糖代谢稳态和改善胰岛素抵抗上发挥重要作用[7]。SIRT1是自噬的正向调控蛋白[8], DKD中,SIRT1表达下降可导致肾脏细胞自噬功能的损伤[9]。既往研究证实,SIRT1和叉头框蛋白O3α(FOXO3α)在DKD中下调,激活SIRT1进而上调FOXO3α的表达,可以改善氧化应激或促进FOXO3α下游自噬基因的转录,从而改善DKD[10-11]。已有研究显示,SIRT1的上调参与了SGLT2i在DKD的肾脏保护作用[12],但 SIRT1-FOXO3α信号通路是否参与了卡格列净对肾脏细胞的自噬调节作用尚待研究。肾脏纤维化是糖尿病肾病主要的病理改变之一,而肾脏纤维化是导致终末期肾功能衰竭的最终共同途径[13]。既往研究显示,自噬功能受损促进肾脏纤维化的发生发展,一方面,在自噬调控关键蛋白beclin-1敲减的小鼠模型中,自噬功能受损直接导致原代肾脏系膜细胞I型胶原蛋白表达升高[14];另一方面,自噬活性的下降也可以通过减少TGF-β的降解而导致肾小管TGF-β的累积,进而促进肾脏间质纤维化的发生[15]。在糖尿病肾病患者的肾脏标本中,研究人员检测到肾脏纤维化与自噬功能受损有关[16]。既往研究观察到,提高肾脏细胞的自噬功能可以改善糖尿病肾病肾脏纤维化[17-19]。因此,调节自噬功能成为治疗肾脏纤维化的靶点之一。
本研究通过体外细胞实验,检测卡格列净对高糖干预的小鼠肾小球系膜细胞(SV40 Mes13)自噬功能和纤维化指标的调节作用,并探究SIRT1-FOXO3α信号通路是否参与其中。
材料和方法
1 主要试剂和仪器
小鼠SV40 Mes13细胞购自中国科学院细胞库;携带SIRT1shRNA的慢病毒购自上海吉凯基因化学有限公司;自噬双标腺病毒mRFP-GTP-LC3购自上海汉恒生物科技有限公司;D-葡萄糖、DMEM液体培养液和胎牛血清购自Gibco;核蛋白提取试剂盒购自Beyotime;兔抗SIRT1、FOXO3α、p62、微管相关蛋白1轻链 3B(LC3B)及β-actin抗体购自Cell Signaling Technology;兔抗αSMA抗体,COL1A1和COL3A1抗体购自Abcam;辣根过氧化物酶(horseradish peroxidase, HRP)偶联的Ⅱ抗购自Abcam;Trizol购自Invitrogen;PrimeScript™ RT Master Mix逆转录试剂盒和TB Green Premix Ex Taq Ⅱ均购自TaKaRa;所用引物由广州天一辉远基因科技有限公司设计合成,见表1。垂直电泳-转膜装置和化学发光成像系统(Bio-Rad)。
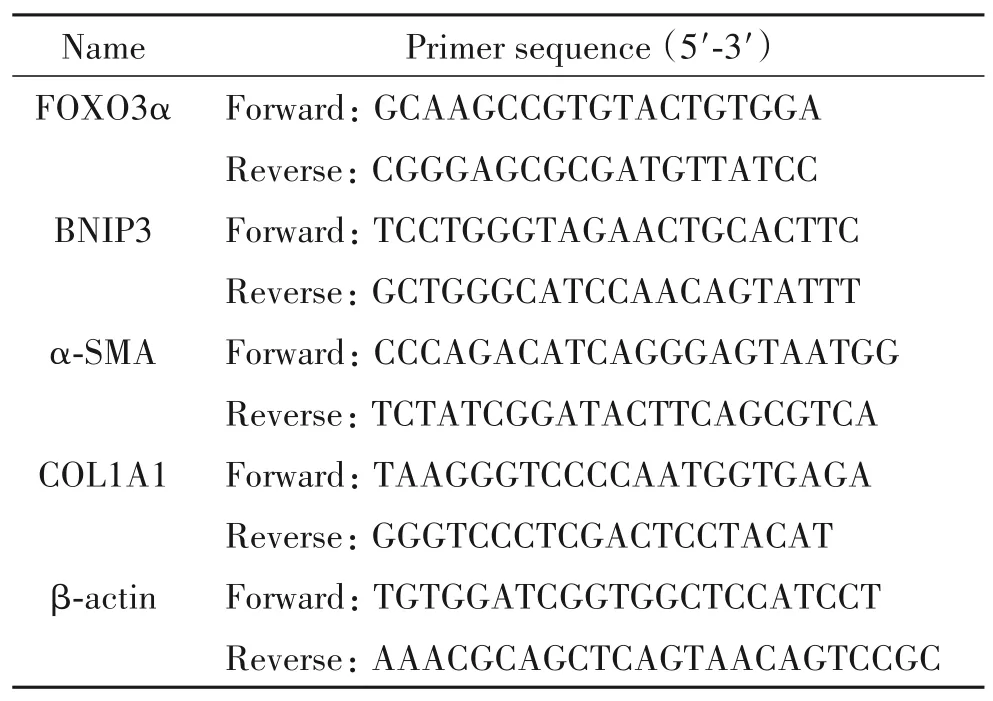
表1 RT-qPCR引物序列Table 1. Sequences of the primers for RT-qPCR
2 主要方法
2.1 SV40 Mes13细胞的培养和分组 取小鼠肾小球系膜细胞SV40 Mes13细胞种植于6孔板中,分为3组,分别用5.6 mmol/L葡萄糖(NG)、30 mmol/L葡萄糖(HG)[20]及 100 nmol/L卡格列净[21]和30 mmol/L 葡萄糖共干预48 h。
2.2 敲减SIRT1的SV40 Mes13细胞系构建 取生长良好的SV40 Mes13细胞接种于6孔板内,细胞密度达到30%时,用表达SIRT1短发夹RNA (shRNA)序列的慢病毒载体或空载慢病毒作为对照转染SV40 MES13细胞,并按照说明书在病毒转染12 h后进行细胞换液,换上新鲜培养液。病毒转染72 h后对SV40 Mes13细胞采用Western blot检测SIRT1表达情况,验证慢病毒干扰效率。确认慢病毒转染成功后进行后续实验。
2.3SIRT1敲减后SV40 Mes13细胞培养 慢病毒转染SV40 Mes13细胞36 h后,将细胞分别置于NG、HG或HG和100nmol/L卡格列净共干预3种条件下继续培养48 h。
2.4 细胞核浆蛋白分离 用PBS清洗细胞后,用细胞刮收集细胞,得到的细胞悬液经100×g离心得到细胞沉淀,按照试剂盒说明书依次加入试剂盒中的细胞浆蛋白抽提试剂A和细胞浆蛋白抽提试剂B,于4 ℃、15 000×g离心得到的上清为浆蛋白,最后向沉淀中加入试剂盒中的细胞核蛋白抽提试剂,每3 min高速涡旋混匀一次,30 min后于4 ℃、15 000×g离心,得到的上清保存为核蛋白。分别将得到的浆蛋白和核蛋白置于-80 ℃保存,用于后续Western blot实验。
2.5 Western blot 用细胞裂解液提取各组细胞总蛋白,蛋白上样量为30 μg。用12.5% PAGE凝胶进行电泳分离蛋白,后采用280mA恒流进行转膜,转膜时间为80 min。转膜结束后,将PVDF摸放入5%脱脂奶粉封闭液,室温封闭1 h后分别加入相应的Ⅰ抗:兔抗 LC3B 抗体(1∶500)、兔抗 p62抗体(1∶1 000)、兔抗SIRT1抗体(1∶1 000)、兔抗FOXO3α抗体(1∶1 000)、兔抗 α-SMA 抗体(1∶1 000)、兔抗COL1A1抗体 (1∶1 000)、兔抗 COL3A1抗体(1∶1 000)和兔抗β-actin抗体(1∶1 000),4 ℃孵育过夜。然后加入辣根过氧化物酶(horseradish peroxidase,HRP)偶联的Ⅱ抗(1∶10 000)常温孵育60 min后,使用化学发光检测系统观察蛋白质条带。
2.6 自噬双标腺病毒mRFP-GFP-LC3转染实验观察细胞内自噬流 将慢病毒转染成功后的SV40 Mes13细胞接种于培养皿中,待细胞铺满30%时采用自噬双标腺病毒mRFP-GFP-LC3转染细胞,按照说明书观察细胞转染情况并进行换液[22]。腺病毒转染36 h后将细胞分组,分别给予NG、HG或HG和100 nmol/L卡格列净共干预48 h。干预结束后,用0.4%多聚甲醛固定细胞,在荧光显微镜下观察。每孔取5个视野观察并拍照。红、绿荧光合并后可观察到黄色斑点为自噬体,红色斑点为自噬溶酶体,记录每组每个细胞黄色斑点和红色斑点的数目,进行统计分析。
2.7 RNA提取和RT-qPCR检测 用Trizol提取细胞RNA。参考试剂盒说明书,将RNA用PrimeScript RT Master Mix逆转录试剂盒逆转录为cDNA后,再使用TB Green Premix Ex Taq Ⅱ试剂盒进行RT-qPCR反应,参照试剂盒说明书配制反应体系。采用2-△△Ct方法分析计算目的基因的相对表达水平。
3 统计学处理
应用GraphPad Prism 8.0统计学软件分析数据并绘制统计分析图。数据均采用均数±标准差(mean±SD)表示,用单因素方差分析检测多组之间的差异,进一步两两比较使用Tukey检验。P<0.05表示差异具有统计学意义。
结 果
1 卡格列净改善高糖干预下SV40 Mes13细胞的自噬功能
Western blot结果显示,与NG组相比,HG组SV40 Mes13细胞自噬底物p62蛋白水平上升,LC3B-II/LC3B-I下降(P<0.05),100 nmol/L卡格列净与HG共干预48 h后,SV40 Mes13细胞p62蛋白水平较HG组下降,LC3B-II/LC3B-I较HG组上升(P<0.05),见图1。
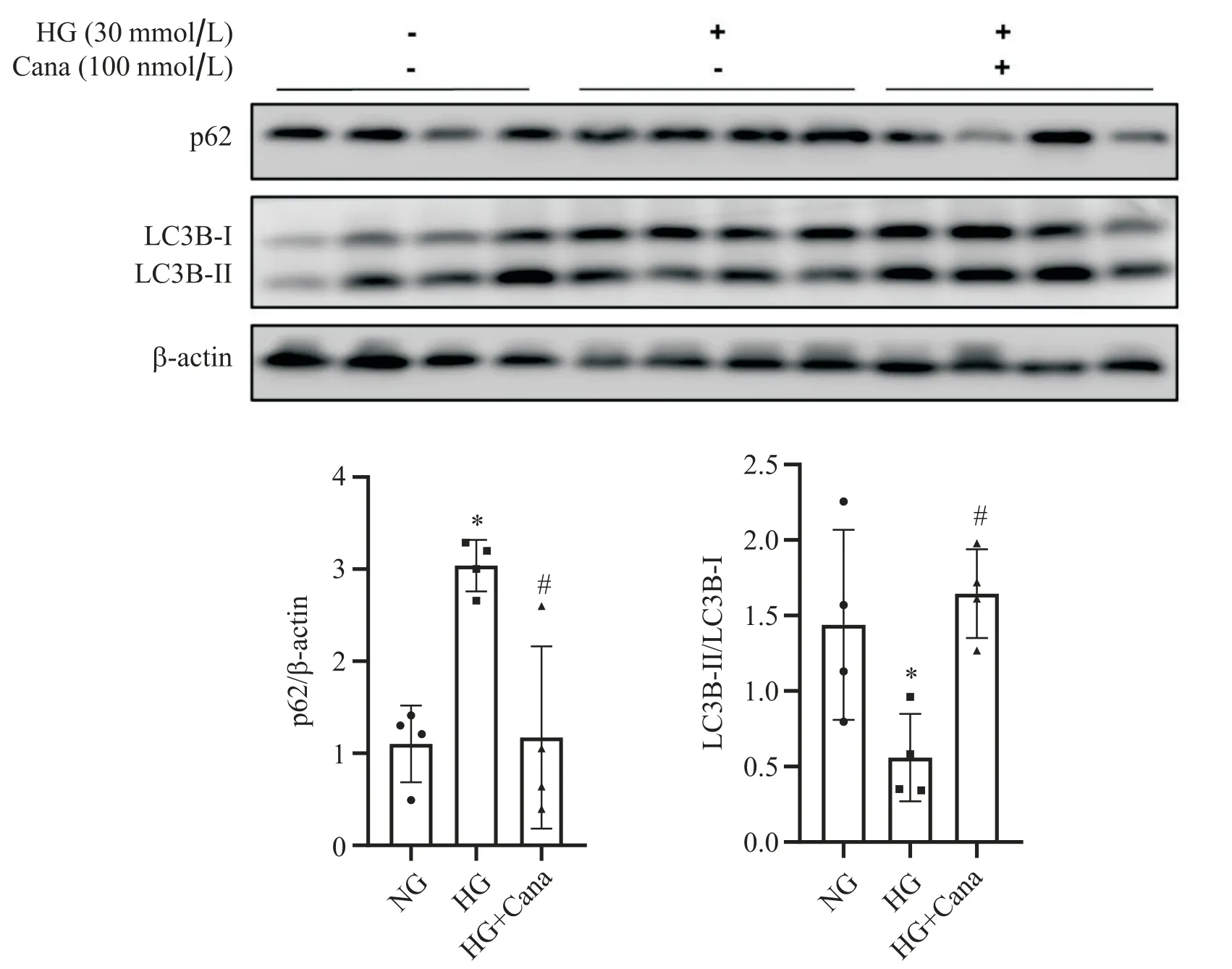
Figure 1. Canagliflozin (Cana) improved autophagy in SV40 Mes13 cells under high glucose (HG) condition. Western blot analysis for p62 and LC3B expression in SV40 Mes13 cells treated with normal glucose (NG; 5.6 mmol/L glucose), HG (30 mmol/L glucose) and HG with Cana (100 nmol/L). Mean±SD. n=4. *P<0.05 vs NG group; #P<0.05 vs HG group.图1 卡格列净改善高糖环境下SV40 Mes13细胞的自噬水平
2 卡格列净上调高糖干预下SV40 Mes13细胞中SIRT1与FOXO3α的表达水平
用Western blot检测3组细胞中SIRT1与FOXO3α达情况。结果显示,与NG组相比,HG组中SV40 Mes13细胞中SIRT1和FOXO3α蛋白水平下降, 100 nmol/L卡格列净与HG共干预48 h后,SIRT1与FOXO3α的蛋白水平较HG组上调(P<0.05),见图2。RT-qPCR结果显示,与NG组相比,HG组SV40 Mes13细胞中FOXO3α及FOXO3α下游与自噬靶基因BNIP3水平下降,100 nmol/L卡格列净与HG共干预48 h后,FOXO3α和BNIP3 mRNA水平较HG组上调(P<0.05),见图3。
3 卡格列净上调SV40 Mes13 细胞中FOXO3α核转位的作用依赖于SIRT1
用携带SIRT1shRNA的慢病毒转染SV40 Mes13细胞,敲减SIRT1,以进一步明确SIRT1在卡格列净上调FOXO3α中的作用。Western blot结果显示,与空载病毒对照组相比,SIRT1敲减组中SIRT1蛋白表达量降低大于 75%(P<0.05),说明敲减SIRT1的SV40 Mes13细胞系构建成功。对照组中,卡格列净上调HG干预下FOXO3α蛋白核浆比及FOXO3α和BNIP3水平(P<0.05),敲减SIRT1后,卡格列净上调HG干预下FOXO3α蛋白核浆比、FOXO3α和BNIP3的作用消失(P>0.05),见图4、5。
4 卡格列净改善SV40 Mes13细胞自噬水平的作用依赖于SIRT1
Western blot结果显示,SIRT1敲减组,卡格列净与HG共干预后,SV40 Mes13细胞p62蛋白及LC3BII/LC3B-I水平与HG组相比无统计学差异,卡格列净改善SV40 Mes13细胞自噬功能的作用消失(P>0.05),见图6。自噬双标腺病毒mRFP-GFP-LC3实验结果显示,空载病毒对照组中,与NG组相比,HG组SV40 Mes13细胞中黄色斑点增多,红色斑点相对减少,即自噬溶酶体减少,自噬小体增多;卡格列净与HG共干预48 h后,SV40 Mes13细胞中黄色斑点相对HG组减少,红色斑点增多,自噬溶酶体增多,自噬流得到改善。而敲减SIRT1后,卡格列净改善自噬流的作用消失,见图7。
5 卡格列净改善SV40 Mes13细胞纤维化的作用依赖于SIRT1
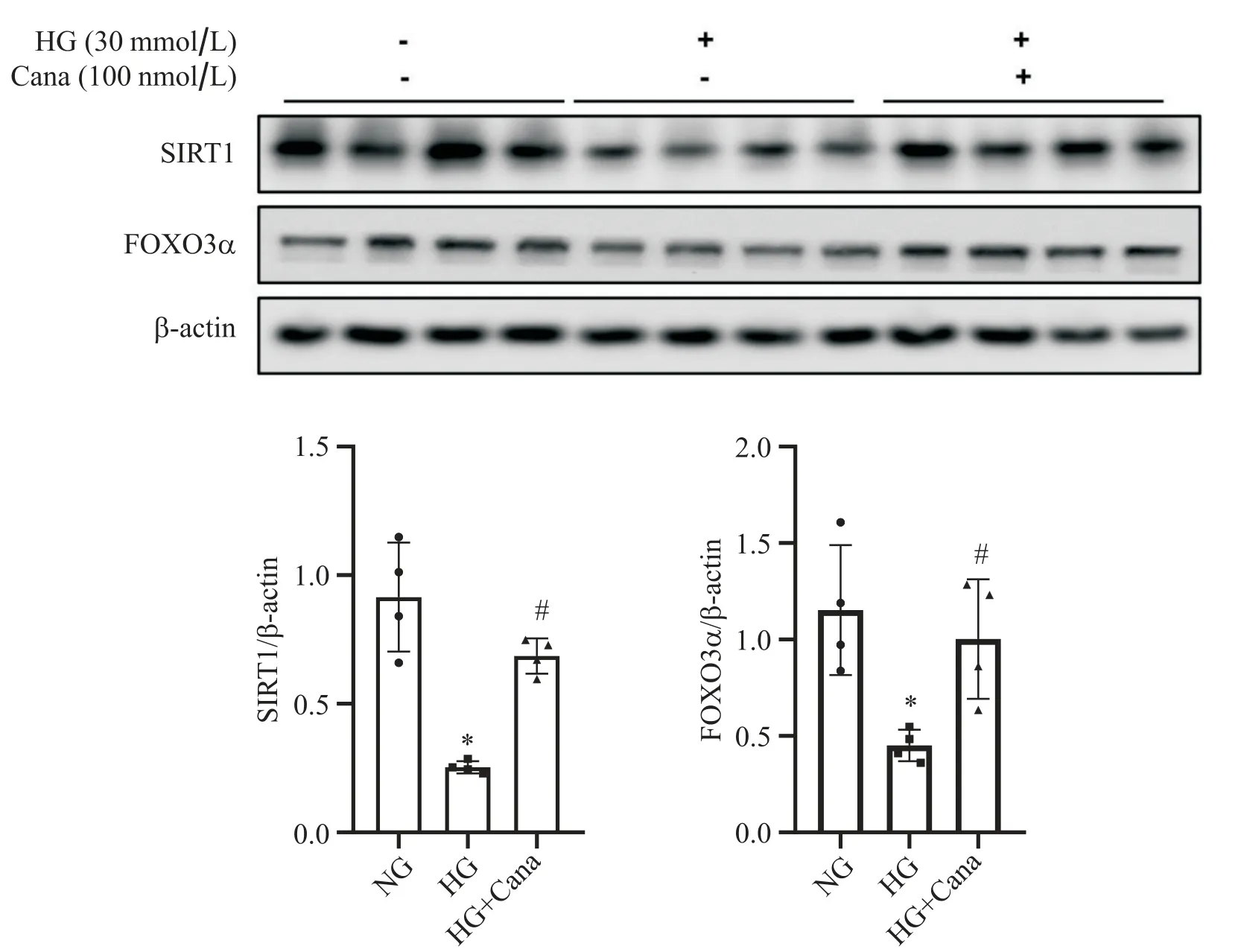
Figure 2. Canagliflozin (Cana) up-regulated SIRT1 and FOXO3α in SV40 Mes13 cells under high glucose (HG) environment. Western blot analysis for SIRT1 and FOXO3α expression in SV40 Mes13 cells treated with normal glucose(NG), HG or HG with Cana. Mean±SD. n=4. *P<0.05 vs NG group; #P<0.05 vs HG group.图2 卡格列净上调高糖环境下SV40 Mes13细胞SIRT1和FOXO3α蛋白表达

Figure 3. Canagliflozin (Cana) up-regulated the mRNA levels of FOXO3α (A) and BNIP3 (B) in SV40 Mes13 cells under high glucose (HG) environment. Mean±SD. n=3. *P<0.05 vs normal glucose(NG) group; #P<0.05 vs HG group.图3 卡格列净上调高糖环境下SV40 Mes13细胞中FOXO3α及BNIP3的mRNA表达水平
在空载病毒对照组中,与NG组相比,HG组SV40 Mes13细胞纤维化指标α-SMA、COL1A1和COL3A1蛋白水平上升,α-SMA与COL1A1 mRNA水平上升(P<0.05);100 nmol/L卡格列净与HG共干预48 h后,α-SMA、COL1A1和COL3A1蛋白水平较HG组下降,α-SMA与COL1A1水平较HG组下降(P<0.05),SIRT1敲减后,卡格列净干预组纤维化指标蛋白水平及mRNA水平与HG组相比无显著差异(P>0.05),见图8。
讨 论
DKD作为一种糖尿病并发症,已成为我国终末期肾病的首要病因。系膜细胞等肾脏固有细胞的自噬功能受损参与到了 DKD 的发生发展中[4,19,23]。因此,改善肾脏细胞的自噬功能对延缓DKD进展起着十分关键的作用。SGLT2i在DKD中肾脏保护作用显著,恢复肾脏细胞自噬功能是其可能的肾脏保护机制之一[6]。已有多项研究证实SGLT2i促进肾脏细胞自噬。既往研究报道,高糖条件下,达格列净激活人肾小管细胞AMPK,并抑制mTOR,改善细胞自噬[24]。Lee等[25]观察到,在STZ诱导的DKD小鼠模型肾脏以及高糖干预的人肾小管细胞中,恩格列净通过激活AMPK增强细胞自噬。卡格列净是首个在肾脏终点研究中被证实肾脏硬终点获益的降糖药[5],但目前关于其调节肾脏细胞自噬功能的研究尚少。在本研究中,我们观察到在高糖环境中,小鼠肾系膜细胞系SV40 Mes13细胞自噬功能受损,而卡格列净可以促进SV40 Mes13细胞自噬。

Figure 4. Canagliflozin (Cana) up-regulated FOXO3α nuclear translocation in SV40 Mes13 cells in a SIRT1-dependent manner.Western blot analysis of SIRT1, nuclear FOXO3α and cytoplasmic FOXO3α in SV40 MES13 cells transfected with lentiviral SIRT1 shRNA or scrambled shRNA and treated with normal glucose (NG), high glucose (HG) and HG with Cana.Mean± SD. n=3. *P<0.05 vs NG group; #P<0.05 vs HG group.图4 卡格列净促进SV40 Mes13细胞FOXO3α核转位的作用依赖于SIRT1
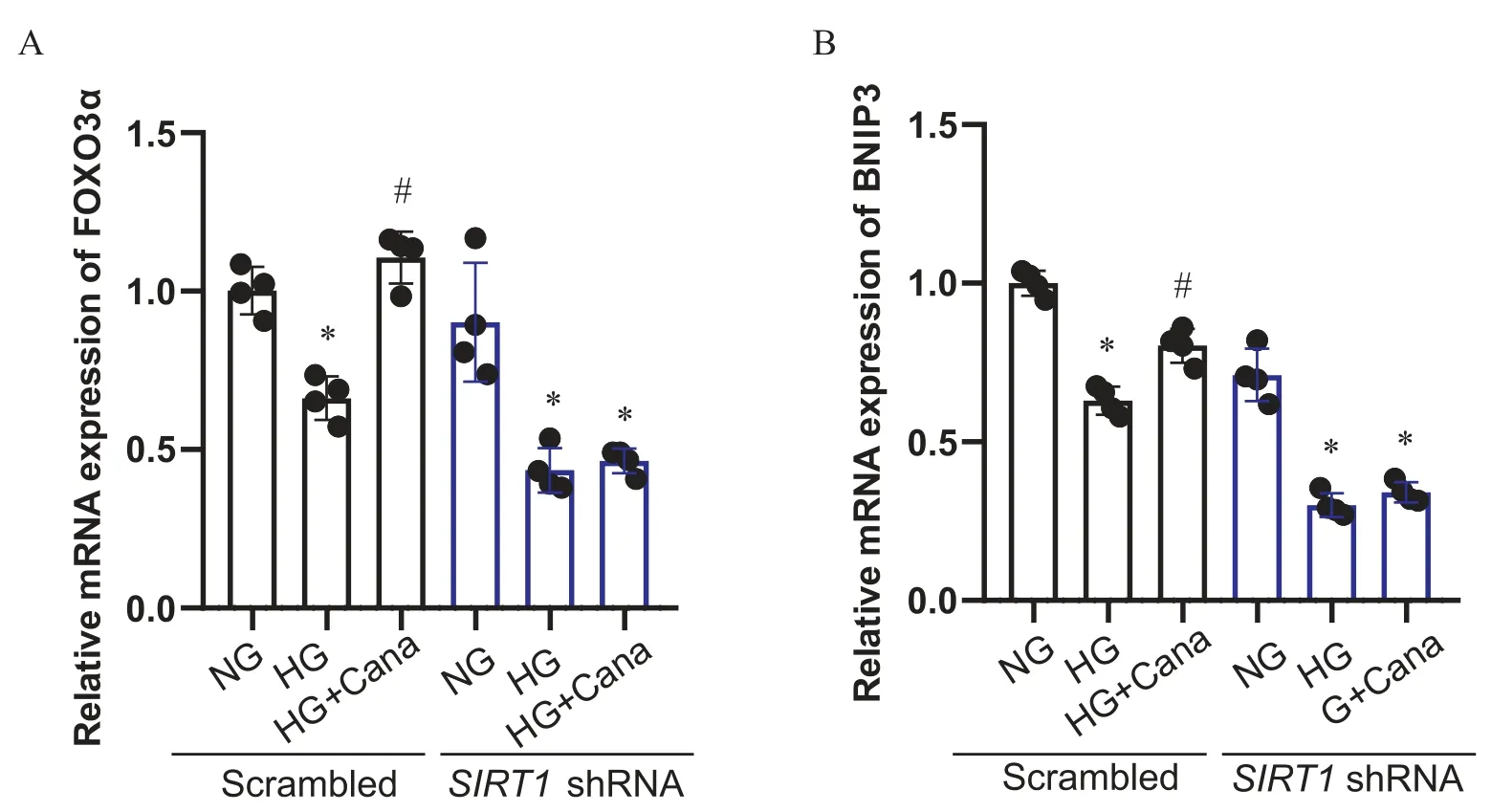
Figure 5. Canagliflozin (Cana) up-regulated the mRNA expression of FOXO3α (A) and BNIP3 (B) in a SIRT1-dependent manner.Mean±SD. n=4. *P<0.05 vs normal glucose (NG) group; #P<0.05 vs high glucose (HG) group.图5 卡格列净上调SV40 Mes13细胞FOXO3α和BNIP3的作用依赖于SIRT1
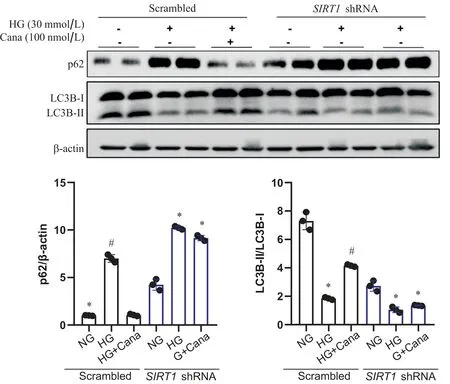
Figure 6. The effect of canagliflozin(Cana) on improving autophagy in SV40 Mes13 cells was dependent on SIRT1. Western blot analysis of p62 and LC3B in SV40 Mes13 cells transfected with lentiviral SIRT1 shRNA or scrambled shRNA and treated with normal glucose (NG), high glucose(HG) and HG with canagliflozin. Mean±SD. n=3. *P<0.05 vs NG group; #P<0.05 vs HG group.图6 卡格列净改善SV40 Mes13细胞自噬水平的作用依赖于SIRT1

Figure 7. Changes of autophagy in SV40 Mes13 cells transfected with mRFP-GFP-LC3. The autophagic flux was observed by mRFPGFP-LC3(the yellow dots indicate autophagosomes, while the red dots indicate autophagolysosomes in merged images).Numbers of autophagosomes (yellow dots in merged images) per cell and numbers of autophagolysosomes (red dots in merged images) per cell were shown. Mean±SD. n=5. *P<0.05 vs normal glucose(NG) group; #P<0.05 vs high glucose(HG) group.图7 mRFP-GFP-LC3腺病毒转染后SV40 Mes13细胞内自噬流情况的变化
SGLT2i促进肾脏细胞自噬的分子机制研究尚未完全阐明,目前已有的研究主要集中于AMPK/mTOR信号通路[6,24-25],而与 SIRT1有关的自噬信号通路少有报道。既往研究结果显示,在DKD小鼠模型中,肾脏组织SIRT1表达下调[26-29]。本研究观察到,高糖环境下,小鼠SV40 Mes13细胞SIRT1的表达下降。SIRT1在DKD中起肾脏保护作用,可以通过去乙酰化修饰自噬蛋白促进肾脏细胞自噬,延缓DKD[8-9]。Packer[30]总结,SGLT2i通过促进葡萄糖排泄,模拟机体营养剥夺的生理状态,上调肾脏的SIRT1表达。本研究结果显示,高糖环境中,卡格列净恢复SV40 Mes13细胞SIRT1的表达水平。研究显示,在DKD大鼠足细胞中,SGLT2i上调SIRT1,同时增强足细胞自噬,缓解足细胞损伤[31]。但该研究并未通过敲除大鼠肾脏SIRT1来进一步明确SIRT1是否介导了SGLT2i改善足细胞自噬的作用。本研究观察到,高糖环境中,SIRT1被敲减后,卡格列净改善SV40 Mes13细胞的自噬功能的作用消失。以上结果说明,SIRT1介导了卡格列净促进SV40 Mes13细胞自噬的作用。
除了直接乙酰化调节自噬蛋白,SIRT1还可以通过去乙酰化修饰转录因子FOXO3α,激活FOXO3α的转录活性,促进FOXO3α下游自噬靶基因的表达[32]。既往研究显示,在DKD小鼠肾脏足细胞中,SIRT1-FOXO3α通路受抑制,P2Y2R敲减后,SIRT1和FOXO3α表达上调,FOXO3α的转录活性增强,足细胞自噬功能改善[11]。本研究观察到,在小鼠肾系膜细胞系SV40 Mes13细胞中,高糖环境中,随着SIRT1表达下降,FOXO3α的表达下降,核转位减少,Mammucari等[33]报道,FOXO3α主要通过上调Bnip3改善自噬,因此,Bnip3可以作为反映FOXO3α转录活性的指标之一。并且,BNIP3在DKD中起肾脏保护作用。BNIP3的下降与DKD患者微量蛋白尿的发生有关[34]。通过上调BNIP3,可以促进自噬,改善DKD肾脏纤维化[35]。本研究观察到,在SV40 Mes13细胞中,高糖环境中,随着SIRT1表达下降,FOXO3α的表达下降,核转位减少,下游Bnip3下降;卡格列净增强FOXO3α核转位的同时上调Bnip3;SIRT1被敲减后,卡格列净上述作用消失。以上结果说明,在SV40 Mes13细胞中,高糖抑制SIRT1-FOXO3α通路,而卡格列净激活SIRT1-FOXO3α通路,进而促进其下游自噬基因的表达,促进细胞自噬。

Figure 8. The effect of canagliflozin(Cana) on fibrosis in SV40 Mes13 cells was dependent on SIRT1. A: Western blot analysis of COL1A1, COL3A1 and α-SMA in SV40 Mes13 cells transfected with lentiviral SIRT1 shRNA or scrambled shRNA and treated with normal glucose (NG), high glucose (HG) and HG with Cana; B and C: the mRNA levels of α-SMA and COL1A1 in SV40 Mes13 cells treated with NG, HG and HG with Cana transfected with lentiviral SIRT1 shRNA or scrambled shRNA. Mean±SD. n=3. *P<0.05 vs NG group; #P<0.05 vs HG group.图8 卡格列净改善SV40 Mes13细胞纤维化的作用依赖于SIRT1
系膜细胞自噬功能受损是小鼠肾脏纤维化的原因之一。Kim等[14]观察到,抑制系膜细胞自噬功能导致胞外胶原蛋白I的沉积,而诱导自噬可促进胶原蛋白I的降解,从而改善肾脏纤维化。既往研究显示,在DKD体内及体外模型中,增强肾系膜细胞自噬功能有利于改善其纤维化[23,36]。Chen 等[23]观察到,在STZ诱导的DKD小鼠模型及体外高糖培养的小鼠肾系膜细胞中,lncRNA SOX2OT通过抑制Akt/mTOR促进肾系膜细胞自噬,改善系膜细胞的过度增殖和纤维化,延缓DKD的进展。另有研究结果显示,在高糖培养的SV40 Mes13细胞中,FBW7通过抑制mTOR改善细胞自噬,从而改善SV40 Mes13细胞炎症和纤维化[36]。在肾小管细胞中,恩格列净通过改善高糖环境下细胞的自噬功能,下调纤维化指标[37]。本研究结果显示,在小鼠肾系膜细胞系SV40 Mes13细胞中,卡格列净改善高糖环境下自噬功能,同时下调纤维化指标α-SMA、COL1A1和COL3A1的表达。SIRT1被敲减后,卡格列净改善SV40 Mes13细胞自噬功能和改善纤维化的作用同时消失。因此,通过改善自噬可能是卡格列净改善SV40 Mes13细胞纤维化的机制之一。
综上所述,本研究显示,高糖抑制SV40 Mes13细胞SIRT1-FOXO3α通路,导致细胞自噬功能受损及细胞纤维化。高糖环境下,卡格列净可通过激活SIRT1-FOXO3α通路,增强SV40 Mes13细胞自噬,并改善SV40 Mes13细胞纤维化。本研究为进一步理解卡格列净对肾脏系膜细胞的保护作用提供参考资料。由于本研究仅在小鼠肾系膜细胞系中进行实验,此后还需在其他不同类型的肾脏细胞和DKD动物模型中进一步探索卡格列净对SIRT1-FOXO3α通路的影响。

