学科融合视野下的探究教学实践*
——以物质结构与性质模块“元素周期律”教学为例
朱少娇
(广东华侨中学 广东 广州 510000)
学科融合是指在承认学科差异的基础上不断打破学科边界,促进学科间相互渗透、交叉的活动。学科融合不仅是学科发展的趋势,也是学术研究产生重大创新性成果的方式之一。
现实生活中任何有意义的问题都具有综合性和复杂性,单一的学科知识不能充分解释或解决这些问题,这要求在分科教学的背景下实施学科融合教学。在教育部颁布的《普通高中化学课程标准(2017年版)》[1]中,也明确提出教师应适当融合跨学科知识,拓宽学生知识视野,丰富教学情境,让学生切身感受化学与科学、技术、社会和环境的密切联系,以及学习化学的意义,发展学生解决综合问题的能力。
一、教材分析
“元素周期律”是2019人教版高中化学选择性必修二物质结构与性质模块第一章第二节第二课时内容。该课时内容相当丰富,包括原子半径、第一电离能、电负性共三部分知识,4张数据彩图,2个“思考与讨论”栏目,1个“探究”栏目,1个资料卡片。从教材编排上看,该课时内容出现在学生学习完元素周期表之后,在分子结构与性质、晶体结构与性质之前,承载着整个选择性必修二模块编排中承前启后的功能。一方面,元素周期律是元素周期表的“灵魂”所在,是学生在全面认识了元素周期表构造之后,结合本章第一节所学电子排布的结构知识,对元素性质规律进行全面、系统的解释与总结,形成“位—构—性”系统的思维方法,可用于解释和预测一些陌生元素的性质。另一方面,学习完本节内容(电离能和电负性)后,形成了学生分析第二章分子结构与性质、第三章晶体结构与性质的重大的理论基础和依据。
在教材中,“第一电离能”的周期性变化图数据信息量极大,很考验学生读取信息、分析数据和提取有效信息的能力。面对如此大信息量的数据图表,很多学生一下子找不到分析的角度和思路。为化解学生学习“第一电离能”的难点,笔者采用了“化整为零”的教学策略。首先利用第一电离能数据,采用数学方法作图(包括柱状图、折线图、散点图等),以此作为课堂主要的教学素材,将“第一电离能”的概念及其变化规律分解为三个学生探究活动:同一元素逐级电离能的变化规律、同主族元素第一电离能变化规律、同周期元素第一电离能变化规律。此外,利用教材“探究”栏目,对电负性的变化规律进行第四个探究活动。学生从数据、图表中分析思考、描点作图、获取证据、小组讨论、得出规律。课堂中学生在语言描述、师生评价、生生评价等活动中逐步建构认识“原子半径”“第一电离能”“电负性”的角度和方法,最后“合零为整”,形成元素周期律的周期性变化规律。
二、教学设计
1.教学与评价目标
如表1所示。

表1 “元素周期律”教学与评价目标
2.教学思路设计
以“寻找定量衡量原子吸引电子能力的参数”为探究线索,采用化学与数学学科融合的教学手段,从宏观到微观,从定性到定量,从单一指标到综合指标,让学生依次探究“原子半径”“第一电离能”“电负性”作为衡量原子吸引电子的参数的演变过程,逐步构建元素周期律认知模型。教学思路整体设计如图1所示。
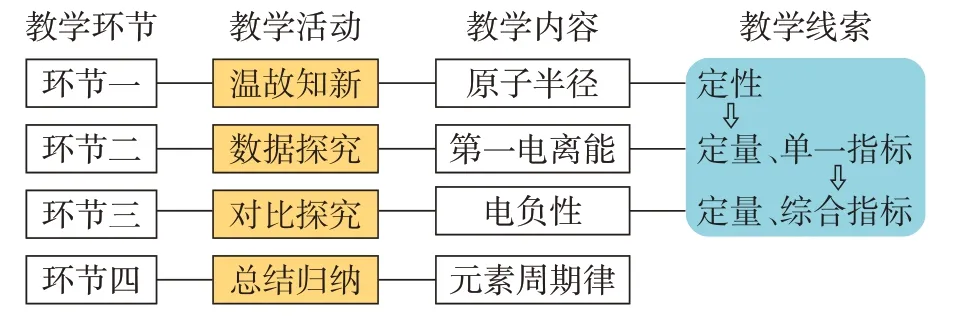
图1 教学流程图
三、教学片段
引入:1869年,俄国化学家门捷列夫在总结前人经验的基础上,编制出世界上第一张元素周期表。周期表不是一张简单的表格,它有着丰富的内涵,今天我们一起来挖掘和探讨周期表中呈现的规律。
环节一:温故知新,解释原子半径周期性变化规律
【教师】周期表中的原子是按照一定的规律“排好队”的,请回顾必修模块所学元素周期律知识,说出周期表中同周期和同主族的原子半径的大小变化规律,思考原子半径受哪些因素影响?
【学生】同主族原子从上到下,电子能层数递增,原子半径变大;同周期原子从左到右,电子能层数相同,但核电荷数递增,原子半径变小。
【教师】同主族从上往下,原子电子能层数增多(导致原子半径增大)的同时,核电荷数也在变大(导致原子半径变小)。如何解释同主族原子半径逐渐增大呢?同周期从左到右,核电荷数增大的同时,价电子数也在增大,可原子半径逐渐减小。这又该如何解释呢?
【学生思考与讨论】对原子半径大小影响程度排序:电子能层数变化>核电荷数变化>价电子数变化。
【教师点拨】当多个因素同时产生影响时,应抓住主要矛盾。总的来说,原子半径随原子序数的递增,呈现周期性变化规律,如图2所示。
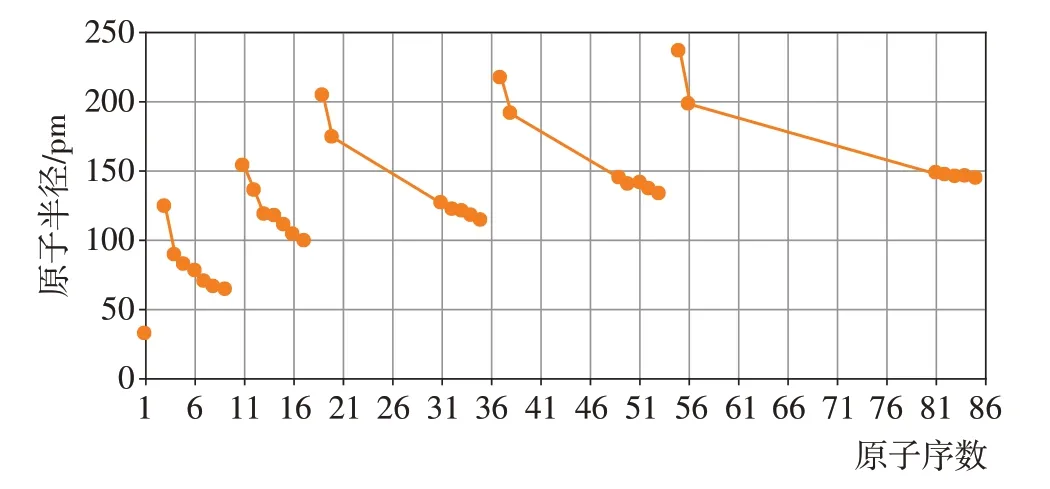
图2 主族元素原子半径变化的周期性
人们可以定性地根据原子半径大小来分析元素原子得失电子能力强弱。
环节二:数据探究,剖析第一电离能周期性变化规律
过渡:“得失电子能力强或弱”都是定性的描述,这在科学研究和生产实践中是不够的。有没有具体的、量化的指标,可以定量衡量原子吸引电子能力呢?
探究1:同一元素逐级电离能变化规律探究
【问题1】电离能是基态气态原子失去电子过程中,克服核电荷对电子的引力所需要的最小能量,单位kJ/mol,符号I。“基态、气态原子”的界定是为了保证能量最低。以镁为例,请思考为什么镁原子的逐级电离能越来越大(如表2所示)?
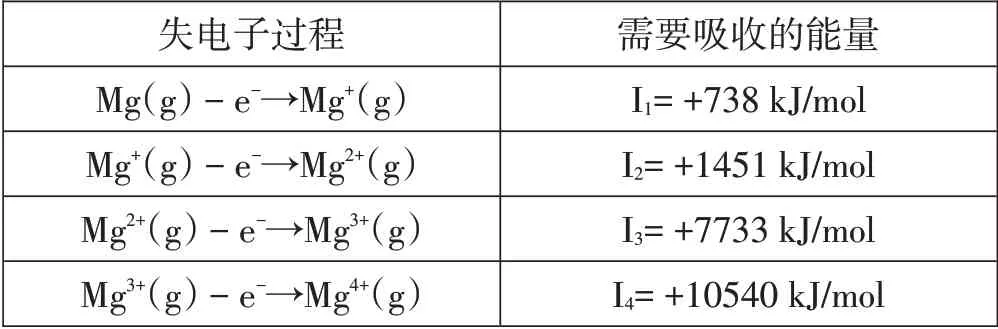
表2 1 mol气态基态镁原子逐级失去电子吸收的能量表
【学生思考与讨论1】失去的第二个、第三个、第四个电子距离原子核比较近,原子核对它们的吸引力大,失去所需能量就高。
【学生思考与讨论2】每失去一个电子,原子正电性增强,对其余电子的吸引力增大,所以越是失去电子,所需的能量越大。
【问题2】逐级电离能数据和元素化合价有什么关系?(如表3所示)
【教师】以镁为例,它核外的电子一个一个地失去,失去几个比较常见呢?为什么?
【学生】镁原子常见失去两个电子,因为最外层价电子数是2。
【教师】你能用逐级电离能来解释为什么失去两个电子比较常见吗?
【学生】从逐级电离能的角度看,前两级电离能比较小,第三电离能开始大很多。
【教师】同学们很细心,观察到第三电离能跟第二电离能相比大很多,失去第3个电子需要的能量很高,我们称这个是“突增”点(如图3所示)。所以,镁原子一般失去几个电子,镁元素化合价是多少?
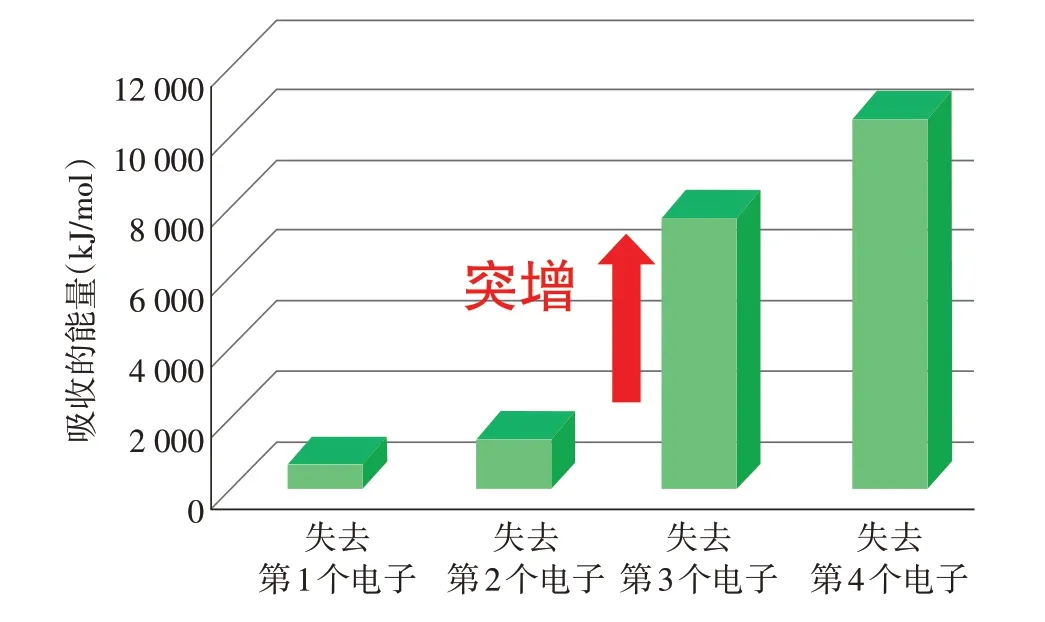
图3 1 mol气态基态镁原子逐级失去电子吸收的能量图
【学生】镁原子一般失去2个电子,镁元素化合价为+2价。
【教师】同样道理,钠和铝元素的电离能的突增点分别在哪里?一般失去几个电子?化合价是多少?
【学生】钠元素的突增点在第一和第二电离能之间,钠原子一般失去1个电子,钠元素化合价为+1价。铝元素的突增点在第三和第四电离能之间,铝原子一般失去3个电子,铝元素化合价为+3价。
探究2:同主族元素第一电离能变化规律探究
【预测】根据同主族元素原子半径变化规律,预测同主族元素第一电离能的变化趋势。
【观察】观察同主族元素第一电离能的变化趋势(见图4),思考原因。
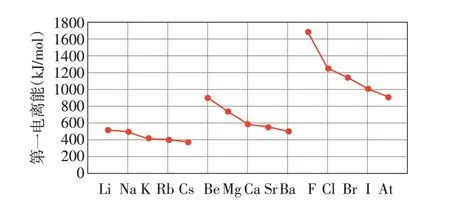
图4 同主族元素(ⅠA、ⅡA、ⅦA)第一电离能变化趋势
【解释】原子半径越大,原子核对价电子吸引力减小,失去一个价电子所需能量变低,元素第一电离能减小。
探究3:同周期元素第一电离能变化规律探究
【预测】根据同周期元素原子半径变化规律,预测同周期元素第一电离能的变化趋势。
【观察】观察第三周期各元素实际电离能数据(见表4),绘图分析。[2]

表4 第三周期各元素实际电离能数据
学生活动:分别以元素的原子序数为横坐标、第一电离能为纵坐标,描点法绘出第三周期元素第一电离能,并连成折线,观察其变化趋势。
【解释】为什么有些元素的电离能“异常高”?
【教师】从绘图结果(见图5)可以看出,第三周期元素电离能总体趋势符不符合我们的预测?全部元素都符合吗?
【学生】Mg、P元素的第一电离能不符合递增规律,比预测的偏高。
【教师】同学们观察到Mg、P元素电离能偏高导致该曲线出现锯齿形。这条曲线哪个元素电离能最高?为什么最高?
【学生】稀有气体Ar第一电离能最高,因为它最外层八个电子,结构稳定,不易失电子。
【教师】那我们能不能这样大胆地作出推断:Mg、P元素的核外电子排布结构比它们相邻的元素稳定?
【学生】能!应该是!
【教师】我们做科学研究,大胆推断完,就要小心求证。请同学们画出第三周期所有元素价电子轨道式,画完后我们再来观察(见图6)。
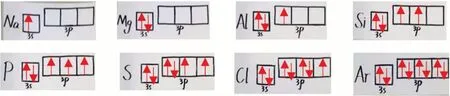
图6 学生作品:第三周期所有元素价电子轨道式
【学生】洪特规则告诉我们,当电子排布为全充满、半充满或全空时,结构是比较稳定的。从轨道式中可看出:Mg元素的3p轨道全空、3s轨道全满,因此结构比较稳定。P元素的3p轨道为半满,因此结构也比较稳定。因此Mg、P元素的第一电离能比其相邻元素的高。
【教师】请根据第三周期元素的变化规律,预测第二周期元素从左到右第一电离能的变化趋势。
【小结】每周期元素总体趋势:碱金属第一电离能最小,随后越来越大,稀有气体的第一电离能最大(IIA族和VA族异常高,如图7所示);同族元素(从上到下):第一电离能递减(如图8所示)。总的来说,元素第一电离能随原子序数递增呈现周期性变化规律。
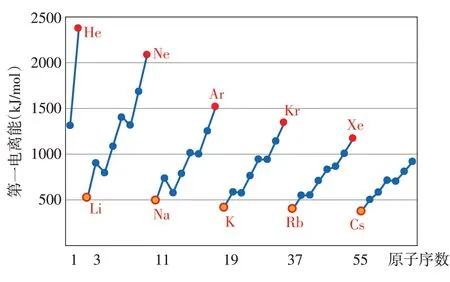
图7 各周期元素第一电离能与原子序数的关系
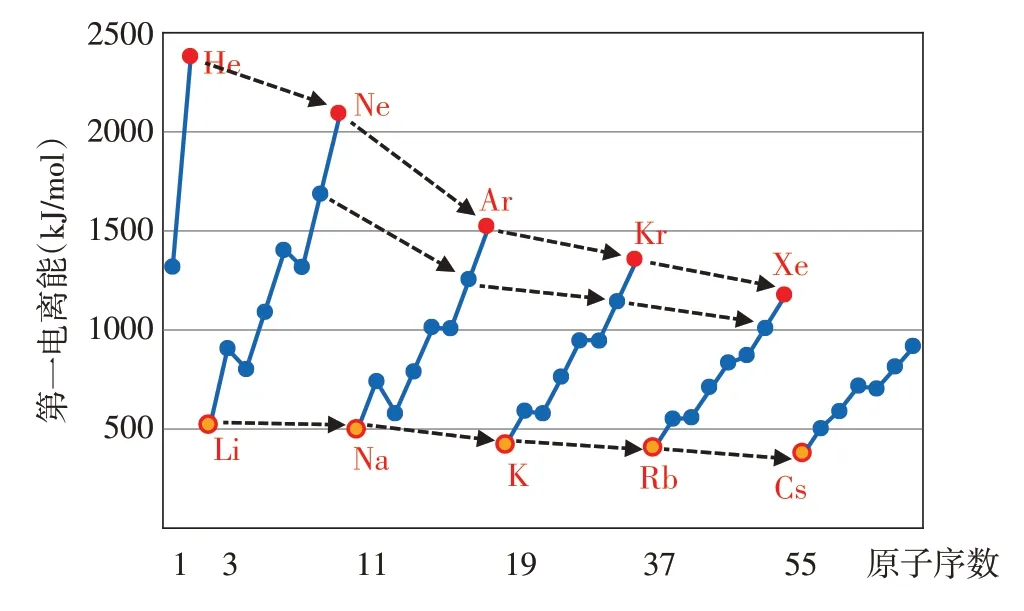
图8 各族元素第一电离能与原子序数的关系(虚线部分)
环节三:对比探究,揭秘元素电负性周期性变化规律
过渡:电离能的提出,能够解决衡量原子得失电子能力的定量问题,是非常了不起的。但是它过于单一。实际上,原子在得失电子形成化学键的过程中,还受到很多因素的影响。1932年,两次获得诺贝尔奖的美国化学家——鲍林,他在参考电离能、电子亲和能、有效核电荷、原子半径等数据的基础上,估算并提出了“电负性”的概念,它能够综合地、简洁地衡量化合物中原子吸引电子的能力。电负性是指原子对键合电子吸引力的大小。电负性值越大,吸引键合电子能力越强。
探究4:对比探究第三周期、IA族、VIIA族元素的电负性及其第一电离能变化规律
【教师】请完成教材“探究”栏目(元素的电负性变化趋势)的活动,分别绘制第三周期元素、第ⅠA和ⅦA族元素的电负性变化图,并找出其变化趋势。
【学生】绘制变化图(见图9),并比较各周期/族元素的电负性与其第一电离能变化趋势的异同。
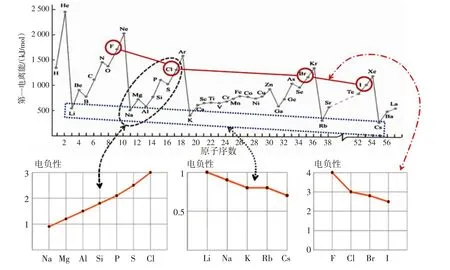
图9 第三周期元素、第ⅣA族元素、第ⅦA族元素电负性与原子序数的关系
环节四:总结归纳,形成元素性质周期性变化的认知模型
四、教学反思与总结
整节课围绕线索“寻找定量衡量原子吸引电子能力的参数”,通过四个探究活动,从宏观到微观,从定性到定量,从单一指标到综合指标,采用化学与数学学科融合的教学手段,让学生从数据、图表中分析、思考、获取证据、讨论交流、得出规律,依次认识和探究了用“原子半径”“第一电离能”“电负性”作为衡量原子吸引电子的参数的演变过程。通过学生个体思考、小组讨论、描点作图、语言描述、师生评价、生生评价等活动,逐步构建元素周期律认知模型,发展了学生“宏微辨析”“证据推理”“科学探究”等核心素养。
本节课不足之处在于数据量较大,制作数据图表耗费时间长。此外,本节知识容量较大,建议分为1.5课时来实施,以保证学生有充足的思考时间。

