左乙拉西坦缓释片制备工艺研究*
杨 鑫,杨广德,张继业,徐 晶
(1.西安交通大学第二附属医院,陕西 西安 710004;2.西安交通大学医学部药学院,陕西 西安 710061;3.陕西省人民医院,陕西 西安 710068)
我国癫痫总体患病率7.0‰,年发病率28.8/10万,每年新增癫痫患者40 万,其在我国已成为仅次于头痛的第二大常见病[1-2]。左乙拉西坦(LEV)属吡咯烷酮衍生物,主要用于治疗局限性及继发性全身性癫痫[3-5],高效低毒,口服吸收快且安全,生物利用度几近100%,其药物代谢动力学(简称药代动力学)分布与抗癫痫药物理想的动力学分布模型相似[6-7]。2008 年美国批准UCB 公司的左乙拉西坦缓释片(levetiracetam,Keppra XRTM)上市。2006 年11 月原国家食品药品监督管理局(SFDA)批准进口LEV。目前国内仅原研产品在售,LEV原料药成本较低,因此,其缓释片的仿制药在国内具有广阔的应用前景。本研究中参考相关文献、UCB公司在美国上市申请的专利、《美国药典》(USP32-NF27)及《欧洲药典》(EP8.0)关于LEV 质量标准的规定,拟研制以羟丙甲基纤维素(HPMC)为骨架材料、与Keppra XRTM的释药行为相似的LEV 缓释片(规格为每片500 mg),且所建制备工艺需简单易行,适合大规模生产,以为国产LEV缓释片的开发提供参考。现报道如下。
1 仪器与试药
1.1 仪器
高效液相色谱系统(含SPD -10Avp 型紫外检测器、LC-10ATvp,LC-Solution 色谱工作站)、AY120 型电子天平(日本Shimadzu 公司);ZRS -8G 型溶出度测试仪、YD -I 型片剂硬度测试仪、CS -2 型脆碎度测试仪(天津市鑫洲科技有限公司);DP -30A 型单冲压片机(北京国药龙立科技有限公司);TD 型电子天平(余姚市金诺天平仪器有限公司);电热鼓风干燥箱(天津市泰斯特仪器有限公司);PHS -29A 型pH 计(上海雷磁创益仪器仪表有限公司);KH5200 型超声波清洗器(昆山禾创超声仪器有限公司);SHZ-D(Ⅲ)型循环水式真空泵(巩义市予华仪器有限责任公司);CH-10 型槽型混合机、YK-160 型摇摆式颗粒剂(上海天和制药机械有限公司);HPX -250B 型恒温恒湿箱(上海悦车仪器仪表有限公司)。
1.2 试药
LEV原料药(北京师宏药物研制中心);LEV对照品(美国国家标准局);左乙拉西坦酸对照品(北京百灵威科技有限公司);左乙拉西坦缓释片(比利时UCB 公司,商品名开浦兰);HPMC(上海卡乐康公司,黏度类型包括K4M、K15M、K100M);滑石粉(广西龙胜华美滑石开发有限公司);硬脂酸镁、二氧化硅(浙江湖州展望药业);聚乙烯吡咯烷酮K30(PVPK30,西安富力化学厂);无水乙醇(广东省化学试剂工程技术研究开发中心);乙腈(天津市科密欧化学试剂有限公司);硫酸(北京化工厂);磷酸二氢钾、氢氧化钠(广东光华化学厂有限公司);氢氧化钾(中国化学试剂三厂);异丙醇(美国TEDIA公司);正己烷(美国Tedia公司)。
2 方法与结果
2.1 处方筛选
粘合剂选择:称取500 mg 左乙拉西坦原料药和200 mg HPMC K15M,混匀后加入不同的粘合剂(85%乙醇、5%PVP溶液、10%PVP溶液、90%乙醇、95%乙醇)制软材,过筛制颗粒,烘干,整粒后将干颗粒与5 mg二氧化硅、10 mg 硬脂酸镁混匀、压片,制备样品缓释片。原研片质量为(715 ± 15)mg,平均硬度为23,而两种PVP 溶液作为粘合剂制备得到的样品片剂硬度值均小于12,不符合要求;90%乙醇溶液制备得到的样品片剂硬度大于18,同时片剂表面光滑无斑点,可压性好,故选择90%乙醇溶液作为粘合剂[8]。
缓释材料选择:称取500 mg 左乙拉西坦原料药和200 mg 不同黏度HPMC[9],分别混匀后加入90%乙醇制软材,过筛制颗粒,烘干,整粒后将干颗粒与5 mg二氧化硅、10 mg 硬脂酸镁混匀、压片,制备样品缓释片,溶出曲线见图1 A。可见,随着HPMC 黏度的增加,药物溶出度呈逐渐降低趋势。K4M 溶出较快,8 h 时即基本释放完全,与原研片溶出曲线的相似因子(f2)值为60.06(>60 为相似性较好),但与12 h 缓释的实验目的不符;K100M 和K15M 在前期溶出与原研片的溶出量差距较大,其12 h溶出曲线与原研片溶出曲线的f2值均小于60[10]。故考虑单用1 种缓释材料不能很好控制LEV的12 h 有效释放,采用不同配比的HPMC K15M 及HPMC K100M作为混合缓释材料。结果配比为7∶3、8∶2、9∶1(m/m)时的f2值分别为78.61,68.5,65.9,可见,以7∶3 为配比的混合缓释材料溶出曲线与原研片的溶出曲线相似度最高,12 h溶出释放效果最理想,故选择。溶出曲线见图1 B。

图1 溶出曲线A.Samples prepared by a single sustained-release material and original tablets B.Samples prepared by sustained-release materials with different ratios and original tabletssFig.1 Dissolution profiles
2.2 工艺筛选
制片方法:预试验考察了粉末直接压片法和湿法制粒压片法对药物释放的影响。湿法制粒压片法制得的样品片剂表面光滑,质量为(720 ± 25)mg,且硬度值大于22,形状与原研片接近;粉末直接压片法制得的片剂可压性差,片剂外表面光滑性较差,易松散,且制得的片剂质量差异较大,含量均匀度不如湿法制粒压片。故选用湿法制粒压片法。
筛网大小:根据常用筛网大小和文献[11],按处方湿法制粒后分别过16 目和24 目筛,烘干后制备样品片剂。两种筛网制得的样品片剂在质量、硬度及药物释放方面无明显差异,但24目筛所得样品片剂表面更光滑、色泽更均匀。故选择24目筛。
压片压力:一般通过控制片剂硬度来控制压片压力的大小。根据原研片的硬度和缓释制剂常见硬度[12],根据处方湿法制粒并干燥后考察,压力为7 N 时,制得的样品片剂表面光泽度较差,且有斑点出现,硬度值小于12,而压力为8 N 及9 N 时,样品片剂外观无明显差异,但以9 N 压力压制样品片剂的硬度及质量均匀度与原研片更接近。故选择压片压力为9 N。
2.3 中试样品制备
按处方量1 万片称取LEV 原料药粉末及选定的混合缓释材料粉末,在槽型混合机中混匀,平行3 个批次(批号分别为20120209,20120210 -1,20120210 -2),按每片消耗约0.8 mL 90%乙醇制备软材,使用摇摆式制粒机制成湿颗粒,放入真空干燥箱中70 ℃干燥3 h,取出,整粒。称取处方量的二氧化硅、硬脂酸镁和滑石粉粉末混合后,与整粒后的颗粒混匀,调节好压力(9 N)及填充量后用单冲压片机压片。压片得到的样品片剂使用欧巴代包衣液包衣后进行包装放置,即得中试样品片剂3万片。
2.4 中试样品片剂质量检查
硬度测定:取3 批中试样品片剂各10 片,使用硬度仪测定中试样品片剂和原研片的硬度值(长端)。结果3 批次中试样品片剂硬度值与原研片接近,RSD均小于4.0%(n=10),符合检查标准。详见表1。

表1 中试样品片剂硬度测定结果(n=10)Tab.1 Results of the hardness test of pilot sample tablets(n=10)
质量差异:取3 批中试样品片剂各20 片,精密称定总质量并计算平均片质量,再分别精密称定各片的质量。比较每片质量与平均每片质量,超出质量差异限度的片剂不得多于2片,且不得有1片超出限度1倍。结果3 批中试样品片剂质量差异小(RSD均小于2%),符合检查标准。详见表2。

表2 中试样品片剂质量差异测定结果(n=20)Tab.2 Results of the determination of weight difference of pilot sample tablet(n=20)
脆碎度测定:按2015 年版《中国药典》片剂脆碎度检查法检查。取3 批中试样品片剂各10 片,称定初始质量,吹去脱落粉末,精密称定质量,置脆碎度检查仪圆筒中,25 r/min转动4 min;取出,同法除去粉末,精密称定质量,计算减失的质量,观察片剂本身有无断裂、龟裂及粉碎。详见表3。

表3 中试样品片剂脆碎度检查结果(n=10)Tab.3 Results of the fragility assay of pilot sample tablets(n=10)
含量测定:取3批中试样品片剂各10片,精密称定,研成细粉,分别称取约72 mg,置50 mL 容量瓶中,加入40 mL流动相,超声(功率200 W,频率40 kHz,下同)处理20 min后,放至室温,用流动相定容,摇匀,经0.45 μm滤膜滤过,取续滤液作为供试品溶液;取1 mL,置100 mL容量瓶中,用流动相定容,摇匀,作为自身对照溶液。取LEV 对照品和左乙拉西坦酸对照品适量,分别制成质量浓度为1 mg/ mL 的LEV 对照品溶液及质量浓度为0.78 μg/ mL 的左乙拉西坦酸对照品溶液,各取适量,进样测定,计算样品片剂中LEV 及左乙拉西坦酸的含量[13]。结果样品片剂中LEV 含量为98%~102%,左乙拉西坦酸含量小于0.3%,供试品溶液和自身对照溶液中未检测到杂峰。详见表4。

表4 中试样品片剂中左乙拉西坦及左乙拉西坦酸含量测定结果Tab.4 Results of content determination of levetiracetam and levetiracetamic acid of pilot sample tablets
溶出均一性考察:参照国家药品监督管理局药品审评中心局《普通口服固体制剂溶出度试验技术指导原则》,量取经脱气处理的溶出介质(pH 6.0 PBS)900 mL,置溶出杯,在溶剂温度(37 ± 0.5)℃,转速100 r/ min条件下,取同一批中试样品片剂6 片,分别投入6 个转篮,至1,2,4,6,8,12 h 时吸取溶出液1 mL(立即补加等温等量溶出介质)、经0.45 μm 滤膜滤过,取续滤液,进样测定,计算溶出液中LEV 浓度并计算该批制剂不同时间累计溶出度,结果的RSD均小于3%(n=6),详见表5。表明其批内均一性良好。

表5 中试样品片剂累计溶出率(%)Tab.5 Cumulative dissolution percentage of pilot sample tablets(%)
稳定性考察:取中试样品片剂适量,分别在高温(40 ℃、60 ℃)、高湿[相对湿度(RH)为75%、92.5%]和强光照[(4 500±500)lx]条件下贮存5 d 和10 d 时各取10 片,研成细粉,分别取3 份72 mg 粉末,置50 mL 容量瓶中,加入40 mL 流动相超声处理20 min,放至室温,加流动相定容,摇匀,经0.45 μm滤膜滤过,取续滤液进样测定。结果左乙拉西坦、左乙拉西坦酸含量均符合《美国药典》和《欧洲药典》标准(正常值分别为98%~102%,<0.3%),表明样品片剂在高温、高湿、光照条件下稳定性良好。详见表6。
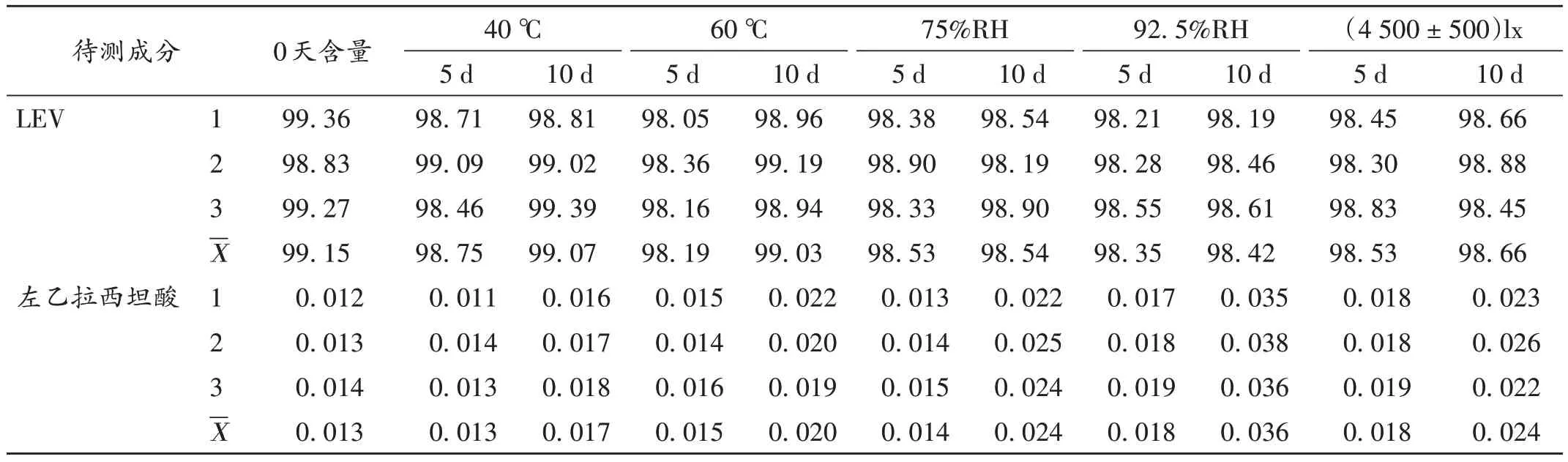
表6 样品片剂高温、高湿、光照条件下放置后含量测定结果(%)Tab.6 Results of content determination of sample tablets after placing under high temperature,high humidity and light conditions(%)
3 讨论
LEV 缓释片是比利时UCB 公司开发的抗癫痫新药,与传统抗癫痫药物相比,其药效好、安全性高、耐受性好,临床广泛应用[14-15],但其作用机制尚未明确。LEV 缓释片可减少血药浓度的峰谷现象,从而提高药物的安全性;其次,LEV 缓释片使血药浓度在较长时间内维持在有效治疗浓度范围内,可降低给药频率,使用更方便。但该药也存在一些不足,如生产工艺较普通制剂复杂,需特别谨慎对待药物突然释放导致的中毒,不能灵活调节给药剂量和时间等[16]。
本研究结果显示,中试样品片剂质量差异及脆碎度检查符合2015 年版《中国药典(二部)》中有关规定,样品片剂的硬度与原研片相近。不同溶出介质中12 h溶出曲线与原研片溶出曲线的相似度符合要求,两者12 h 溶出度无明显差异。还发现,中试样品片剂中LEV含量、杂质含量及溶出度在加速和长期试验放置后稳定性良好。本研究中确立了自制缓释片剂处方及制备工艺和质量标准,对于国产LEV 缓释片的早日问世具有一定意义。

