醋酸钠水解温度变化的实验细究
姜绍南
(江苏省扬州市第一中学 江苏 扬州 225001)
一、问题的由来
1.醋酸钠溶液的pH-T曲线
图1是2019年北京高考的化学学科试卷中的图,比较直观地显示了0.5mol·L-1醋酸钠溶液、水、0.5mol·L-1硫酸铜溶液的pH与温度的关系。

图1 0.5mol·L-1醋酸钠溶液、水、0.5mol·L-1硫酸铜溶液的pH与温度的关系
2.看图结论
在25~60℃范围内,温度升高时,醋酸钠溶液的pH变小的幅度缓于水;硫酸铜溶液的pH变小的幅度大于水。
醋酸钠水解温度升高pH变小、碱性增强,与常温下pH变大、碱性增强不同,不易于理解。
二、温度升高,醋酸钠水解的碱性增强
1.教材中的实验
人民教育出版社化学室编著的全日制普通高级中学教科书(试验修订本·必修加选修)化学第二册在“盐类的水解”一节有醋酸钠水解的经典实验[1]:在1支试管里加入3mL醋酸钠溶液,滴入2滴酚酞试液,观察溶液的颜色。再取1支试管,把前一试管里的混合液混合均匀后分一半到此试管里,给其中1支试管里的溶液加热,比较两支试管里溶液的颜色。待受热试管中的溶液恢复至室温,再比较两支试管里溶液的颜色。
这个实验的目的是要让学生了解升高温度能促进强碱弱酸盐的水解。醋酸钠在水中的少量水解可以看作是醋酸和氢氧化钠溶液发生中和反应的逆过程,是吸热过程,升高温度能促进它的水解。所以,温度升高,溶液的碱性增强。
GB/T694-2015对化学试剂无水醋酸钠的pH要求是:25℃,50g·L-1的水溶液pH为7.5~9.0。GB/T693-1996对化学试剂结晶醋酸钠(CH3COONa·3H2O)的pH要求是:25℃,50g·L-1的水溶液pH为7.5~9.0。大多数厂家生产的化学试剂醋酸钠,能够满足这个经典实验的要求。通常的实验现象是:当室温较高、浓度高的醋酸钠溶液滴入酚酞试液后显示为浅粉红色,加热后红色变深。因为在这个碱性范围,按照室温情况下的常理来看,酚酞的红色变深与OH-的浓度增大有直接的关系,实验证实了这个结果。
2.对照实验的探究
(1)设计对照实验的原因
Ⅰ.查阅分析化学手册得知:当温度升高时,温度对酚酞的变色范围有影响。[2]
上述经典实验中醋酸钠的温度发生了变化,酚酞的颜色变深有没有可能是因为温度的升高而影响到酚酞的变色范围造成的?
Ⅱ.常温或略低于常温的0.1mol·L-1醋酸钠溶液滴加酚酞试液并不变红,有悖于计算得出的pH。
上述经典实验对醋酸钠溶液的浓度未做要求,但是,理论推导得到的醋酸钠水解的pH计算公式[3]却是基于稀溶液。
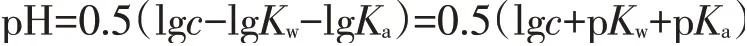
式中c为醋酸的物质的量浓度,Kw为溶液温度对应的纯水的离子积常数,Ka为溶液温度对应的醋酸的电离常数。
按照理论推导,25℃时,用不含二氧化碳的蒸馏水配制的0.1mol·L-1醋酸钠溶液的pH=8.88,25℃用实验室购买的蒸馏水配制的0.1mol·L-1醋酸钠溶液的pH用上海仪电科学仪器股份有限公司生产的pHS-3C型pH计测得值为8.3-8.4。这个pH数值的醋酸钠溶液和氢氧化钠溶液各取10mL加入2滴酚酞试液均为无色,而pH=8.8的氢氧化钠溶液同样情况下已经呈现较深的红色。
(2)对照实验
因为pH计测定的pH具有一定范围内的漂移,为了考虑这些因素的影响,笔者设计了以下的对照实验。
因为醋酸钠在水溶液中少量水解为氢氧化钠和醋酸,单纯含有少量氢氧化钠的水溶液中的OH-浓度随温度的升高可以用来做对照。采用很稀的氢氧化钠溶液,主要考虑到醋酸钠水解后的pH在此附近,温度升高后水分子自身的电离造成的因素相似。仿照上述的经典实验,同步做了两种稀的氢氧化钠溶液、0.1mol·L-1醋酸钠溶液的受热变色情况的实验。三种溶液各取6mL,分别加入2滴酚酞试液,振荡均匀后,每一种溶液分成二等分,分别分装在两个试管里,便于比较。三种溶液均用实验室购买的蒸馏水配制而成。
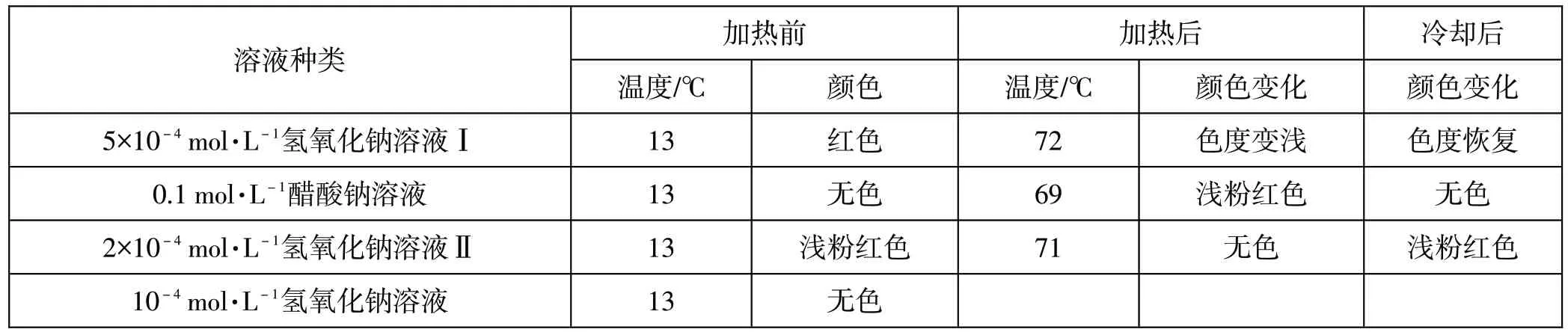
表1 两种很稀的氢氧化钠溶液Ⅰ、Ⅱ与0.1mol·L-1醋酸钠溶液的受热变色比较
由于酚酞变色跟c(OH-)及c(OH-)/c(H+)有关,有了很稀的氢氧化钠溶液Ⅰ、Ⅱ做对照,可以看到温度升高,受水的电离增大的影响,溶液Ⅰ的c(OH-)与c(H+)都变大,但碱性c(OH-)/c(H+)变小,所以温度升高,红色变浅;溶液Ⅱ则更加明显。而0.1mol·L-1醋酸钠溶液的变色与它们相反,由此看到在同样浓度的酚酞存在的背景下强碱溶液和醋酸钠溶液随温度升高变化的不同,直观地感受到水的电离随温度的变化和升高温度醋酸钠溶液的碱性增强。
三、温度升高,醋酸钠溶液的pH变小,碱性增强
1.稀溶液的pH随温度升高而降低
我们知道,水的离子积常数Kw=K·c(H2O)=c(H+)·c(OH-),K为水的电离常数,c为物质的量浓度。在一定温度下,纯水和稀溶液中c(H2O)可视为定值。这样,在稀溶液中,水的离子积常数Kw可以看成等同于纯水的离子积常数。不同温度的纯水的离子积常数[4]和由此计算出的理论pH见表2。
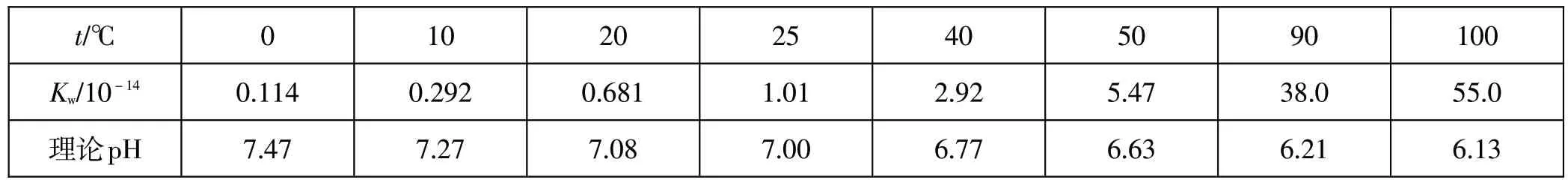
表2 不同温度的纯水的离子积常数和理论pH
图1以水的pH与温度的关系做对照。如上所述,稀溶液的pH随温度升高而降低。
2.由精确测定的pH计算c(OH-)/c(H+)感知温度升高,醋酸钠水解的碱性增强
当温度变化、碱性较弱[c(OH-)仅仅稍大于c(H+)]的时候,比较酸碱性强弱用c(OH-)/c(H+)的比值来衡量,比看pH数据显得更为直观而易于理解。
表3是将测得的0.1mol·L-1醋酸钠溶液的pH数据用来计算c(OH-)/c(H+)得到的数据。考虑到pH计的仪器示值误差为±0.02pH,由此很明显地看出:30℃以上,随着温度的升高,c(OH-)、c(H+)都增大,且c(OH-)/c(H+)也在增大,pH虽然变小,即c(H+)增大,但c(OH-)增大的更多,所以,碱性增强。
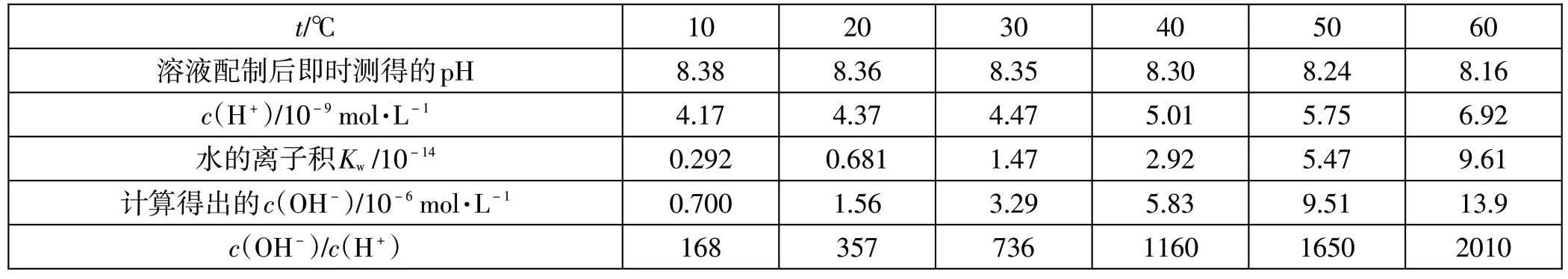
表3 不同温度测得的pH、计算得到的c(OH-)与c(OH-)/c(H+)
四、二氧化碳等因素对醋酸钠溶液的影响
扬州大学化学学院嵇正平等用仪器研究认为,2mol·L-1醋酸钠溶液加热后的碱性增强,有一部分原因是配制溶液用的蒸馏水中溶解的二氧化碳的逸出和醋酸钠水解产生的醋酸的挥发。[5]后者的气味笔者在加热醋酸钠浓溶液至沸腾后确实能够闻到。
为了研究二氧化碳对醋酸钠溶液的影响,笔者做了下列对比实验。
将表3所使用的0.1mol·L-1醋酸钠溶液暴露在空气中放置5小时后,再次测定不同温度下的pH,得到表4。
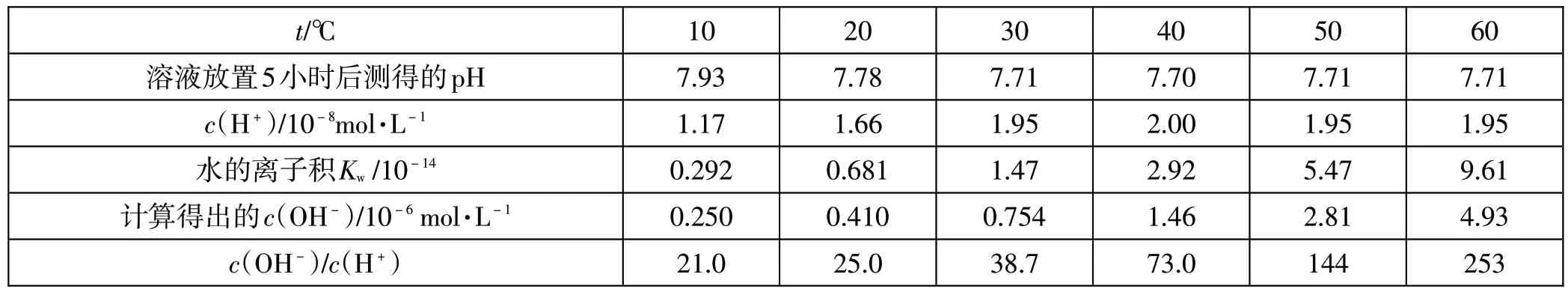
表4 放置5小时后不同温度测得的pH、计算得到的c(OH-)与c(OH-)/c(H+)
弱碱性的醋酸钠溶液暴露在空气中吸收了部分二氧化碳,致使溶液的pH降低,而当温度升高到30℃,溶液的pH几乎不变,说明这时候二氧化碳从溶液中逐渐逸出。


