罗氏沼虾3个不同群体线粒体COⅠ基因序列变异及遗传多样性分析
蒋 飞 ,戴习林
(1.上海市水产研究所,上海市水产技术推广站,上海 200433;2.上海海洋大学,水产科学国家级实验教学示范中心,农业部淡水水产种质资源重点实验室,水产动物遗传育种中心上海市协同创新中心,上海 201306)
罗氏沼虾(Macrobrachiumrosenbergii),俗称泰国虾或马来西亚大虾等,原产于东南亚、南亚和西太平洋岛屿,在我国有两大主要产区,包括两广地区和江浙沪一带。因其营养丰富、体型较大、生长速度快,抗病能力强,罗氏沼虾已成为我国主要的淡水养殖虾类[1]。虽然人工育苗技术的突破和养殖技术的提升提高了罗氏沼虾的养殖产量,但是近年来罗氏沼虾的种质退化现象日益凸显,影响了我国罗氏沼虾养殖业的健康可持续发展。因此,需要开展不同地区罗氏沼虾种群的遗传多样性分析,以更好地指导罗氏沼虾养殖生产。
近年来,国内外关于罗氏沼虾在细胞遗传学、生化遗传学以及分子遗传学等方面的研究都已有报道[2-5]。线粒体脱氧核糖核酸(Deoxyribonucleic acid,DNA)具有结构简单、分子量小、呈母系遗传、进化速度快等优点,在水产动物群体遗传学和系统进化研究中已得到广泛应用,其中COⅠ基因长度适宜、进化速率适中且遗传信息量较大,也常被用于种群分析[6-8]。本实验拟通过线粒体COⅠ基因序列分析,对上海选育群体(SC)、浙江养殖群体(ZJ)和泰国野生群体(TL)进行遗传多样性分析,以期在线粒体水平上了解罗氏沼虾的遗传背景,为罗氏沼虾遗传改良和可持续健康发展提供理论参考。
1 材料与方法
1.1 实验材料
上海选育群体(SC):2014年7月采自上海申漕特种水产开发公司养殖基地(上海漕泾镇)。浙江养殖群体(ZJ)来源于2014年7月浙江南太湖种业有限公司。泰国野生群体(TL)采自2014年7月泰国天然水域中。
上海选育群体(SC)和浙江养殖群体(ZJ)各随机采样90尾,泰国野生群体(TL)随机采样雌、雄各15尾,所有样本浸泡于无水乙醇中,带回实验室,-80℃保存备用。
1.2 基因组DNA提取并检测
从3个罗氏沼虾群体中分别随机选取10个样本,共计30个样本,罗氏沼虾基因组DNA的提取主要参考Moore D D等[9]的方法并稍作改进。采用蛋白酶K裂解液消化、酚-氯仿法抽提并纯化DNA、-20℃无水乙醇沉淀的方法提取肌肉组织中的DNA,TE缓冲液稀释后用1%琼脂糖凝胶电泳检测。
1.3 PCR扩增和序列测定
COⅠ基因片段扩增引物为COⅠ-F(5′-ATTGTCACTGCCCACGCATT-3′ )、COⅠ-R(5′-TGTTGGTAGAGGATCGGGTC-3′ )。所用引物由生工生物工程(上海)股份有限公司合成。PCR扩增产物经1.0% EB-琼脂糖凝胶电泳检测验证,结果符合测序要求,由生工生物工程(上海)股份有限公司进行纯化和测序。
1.4 数据处理与分析
将测得的序列用BioEdit 7.0.5.2进行序列比对,并辅以人工校对,去除两端冗余序列;用DNSP 5.1软件计算群体遗传变异参数:单倍型数量(Number of haplotypes)、单倍型多样性指数(Haplotype diversity index,Hd)、核苷酸多样性指数(Nucleotide diversity index,π)和平均核苷酸差异数(Average number of nucleotide differences,K);用Arlequin 3.1软件统计分子多态性指数,并对群体遗传变异进行分子方差分析(Analysis of molecular variance,AMOVA)和遗传分化系数(Fixation index statistics,Fst)检验。用MEGA 5.0软件中的Kimura双参数模型计算各群体内和群体间遗传距离,并基于遗传距离构建群体间的分子系统进化树。
2 结果与分析
2.1 罗氏沼虾线粒体COⅠ序列特征
对测得的序列采用BioEdit软件进行比对分析,去除两端多余序列,得到458 bp有效长度的序列,并对其进一步分析。在458 bp COⅠ基因序列中,共检测到8个变异位点,并且全部单碱基突变,无碱基颠换,群体间的碱基差异较小。MEGA 5.0软件分析显示,所有样本序列的A、T、C和G碱基含量的平均值分别为26.3%、28.1%、26.1%和19.6%,A+T的含量为54.4%,高于G+C的含量45.7%。3个罗氏沼虾群体中共有4种单倍型,SC群体、ZJ群体和TL群体的基因型种类分别为1、2和3种。
2.2 罗氏沼虾遗传多样性
对3个罗氏沼虾群体的遗传多样性进行分析(表1),结果显示群体SC、ZJ和TL的单倍型多样性指数(Hd)依次为0、0.356和0.733;核苷酸多样性指数最高的是ZJ群体(π=0.005),其次是TL群体(π=0.002),SC群体最低(π=0)。对3个群体的遗传多样性进行Tajima′s D中性检验,结果范围为0~1.337,3个群体Tajima′s D 的P值均大于0.05,差异不显著,说明COⅠ基因序列核苷酸的变化符合中性突变假说。
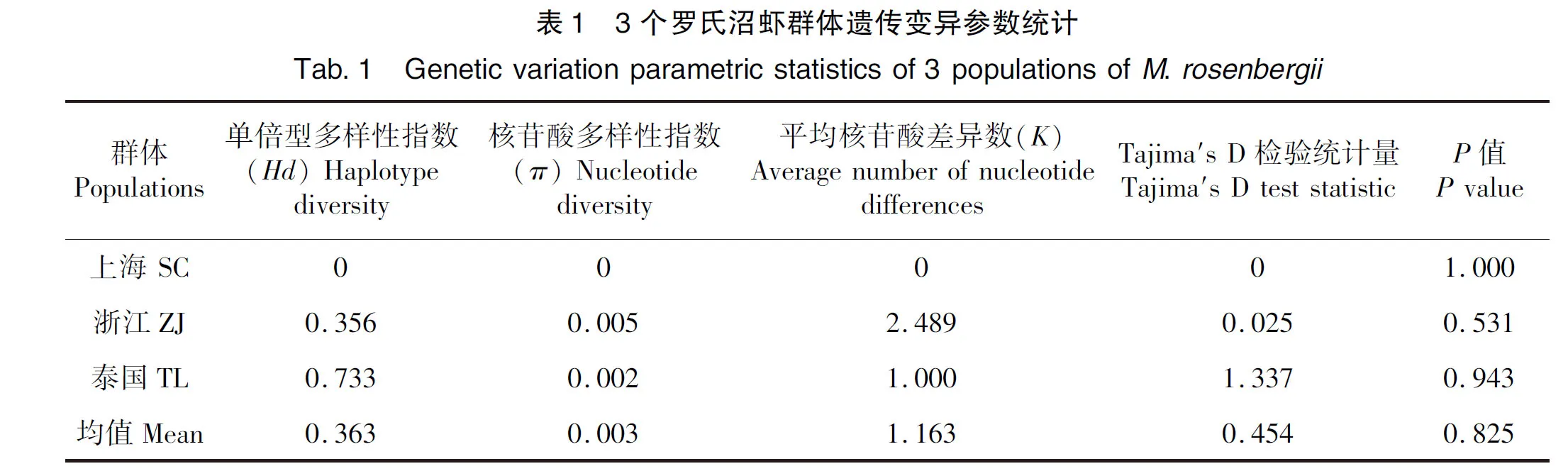
2.3 罗氏沼虾群体遗传分化与遗传距离
用Arlequin 3.1软件进行AMOVA分析,3个罗氏沼虾群体的遗传变异结构和变异来源见表2。AMOVA的分析结果表明,在罗氏沼虾3个群体的遗传结构差异中,有74.5%遗传差异来源于群体间,25.5%遗传差异来源于群体内。群体间的遗传变异明显高于群体内的遗传变异。
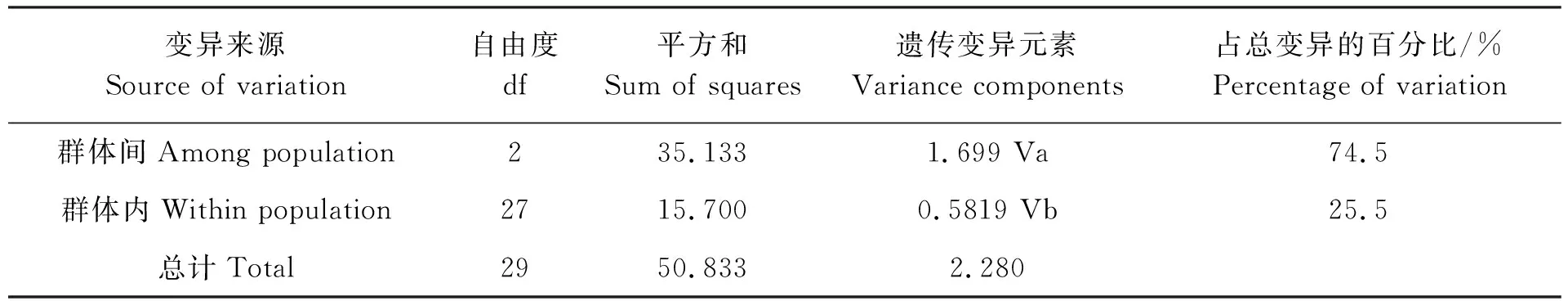
表2 3个罗氏沼虾群体间和群体内的分子方差分析(AMOVA)
3个群体间的遗传分化指数(Fst)和遗传距离结果如表3所示,SC群体与TL群体遗传分化指数最高(Fst=0.925),其次是ZJ群体与TL群体(Fst=0.687),SC群体与ZJ群体的遗传分化指数最低(Fst=0.111);SC群体与ZJ群体的遗传距离较近,约为0.003,而与TL群体的遗传距离较远,约为0.013。
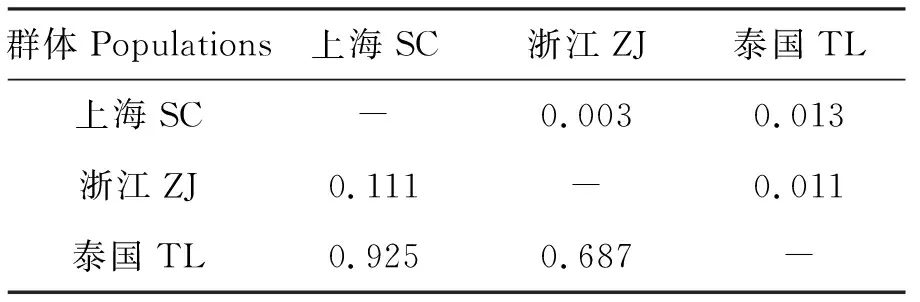
表3 3个罗氏沼虾群体间遗传分化指数和群体遗传距离
2.4 基于COⅠ基因序列的罗氏沼虾分子系统树
根据COⅠ基因序列,从GenBank中下载与罗氏沼虾同属不同种的日本沼虾(Macrobrachiumnipponense,Mn)(登录号:FM958077)作为外群,采用NJ法和UPMGA法构建系统进化树。由图1可知,2种方法构建的系统进化树趋于一致,沼虾属的2个种聚为两大支:日本沼虾的遗传距离与罗氏沼虾3个群体均明显偏远,单独聚为一支;SC群体与ZJ群体遗传距离最近,首先聚在一起成为一小支,然后再与TL群体聚为另一支。

注:SC、ZJ、TL分别是来自上海、浙江、泰国的罗氏沼虾;Mn为日本沼虾。
3 讨论
3.1 罗氏沼虾线粒体COⅠ序列变异分析
线粒体DNA作为核外遗传物质,普遍存在于真核细胞中,由于具有结构简单、进化速度快、母系遗传、变异性大、核苷酸替代率高等优点[8,10],其已经成为物种鉴定、系统发育以及种群遗传等研究中一种有效的分子标记[11]。mtDNA序列分析是DNA多态性分析技术中重要的方法之一,不论是群体还是个体,任何的遗传变异或者多态都是DNA序列的差异,mtDNA序列分析可以检测到碱基的插入、缺少和替换等变异信息,从而在分子水平上检测个体、群体及种间的多态及遗传差异[12]。COⅠ基因作为mtDNA的主要分子标记之一,适用于种、亚种及地理种群间的系统关系研究[13]。COⅠ序列在虾类的分子系统学中被广泛应用,如Carini G等[14]和 Vassilios K等[15]分别研究了澳洲沼虾(M.australien)的遗传结构和不同地理种群的欧洲龙虾(Homarusgammarus)的系统进化关系。
本研究初步分析了3个罗氏沼虾群体线粒体COⅠ序列的差异,共检测出8个变异位点、4个单倍型。变异位点和单倍型数量少可能是由于各群体样品检测数量偏低或COⅠ基因序列无法将其很好地区分开。但是TL群体的单倍型数量(3个)分别高于SC群体(1个)和ZJ群体(2个)的单倍型数量,这至少可以说明浙江养殖群体和上海选育群体因长期的人工养殖和选育,导致其遗传多样性较野生群体有所降低。碱基组成分析表明,A+T的平均含量(54.4%)高于G+C的平均含量(45.7%),这与许多研究者在其他虾蟹类线粒体基因中检测到的结果类似,如姜虎成等[16]研究发现,淮河水系日本沼虾(Macrobrachiumnipponense)A+T的含量(59.0%)高于G+C含量(41.0%);葛家春等[17]研究发现中华绒螯蟹(Eriocheirsinensis)G+C含量(37.6%)低于A+T的含量(62.4%)。
3.2 罗氏沼虾的遗传变异分析
当采用线粒体DNA研究群体遗传多样性时,核苷酸多样性指数(π)和单倍型多样性指数(Hd)均是衡量群体遗传多样性的2个重要指标[18]。有些群体通过变异积累了单倍型的多态性,而并不能积累核苷酸序列的多样化[19]。本研究结果表明,TL群体的单倍型多样性指数较高(Hd=0.733),但其核苷酸多样性指数(π=0.002)明显偏低,说明TL群体可能是由少量个体扩增形成的一个小种群。SC群体和ZJ群体的Hd值和π值均较低,造成这一现象的主要原因可能是这两个群体在长期人工养殖和选育过程中发生了遗传漂变(Genetic drift)、近交(Inbreeding)或奠基者效应(Founder effect)[20-21]。
群体间遗传分化系数(Fst)经常用于衡量群体间基因分化的程度[22],Fst值的大小与群体遗传分化水平符合正相关关系。在0~1的范围内,Fst值为0~0.05属于遗传分化微弱;Fst值在0.05~0.15之间属于中度遗传分化;Fst值为0.15~0.25属于高度遗传分化;Fst值在0.25以上属于极高度遗传分化[23]。本研究中,SC群体与ZJ群体(Fst=0.111)属于中度遗传分化;SC群体与TL群体(Fst=0.925)、ZJ群体与TL群体(Fst=0.687)都属于极高度遗传分化,由此证明长期闭锁选育和人工养殖对罗氏沼虾的遗传结构都产生了影响。
3.3 罗氏沼虾群体间遗传距离和系统发育分析
Hebert P D N等[24]曾经对动物界的11门13 320个物种的线粒体COⅠ基因进行序列比较分析,得出物种内的遗传距离大部分小于0.010,很少有大于0.020的结论;本研究中,根据罗氏沼虾3个不同群体的遗传距离和系统进化树可以看出,基于线粒体COⅠ基因序列的3个罗氏沼虾群体间的种内遗传距离为0.003~0.013,与其研究结果一致。SC群体与ZJ群体遗传距离最小,为0.003,亲缘关系较近。SC群体和ZJ群体与TL群体的遗传距离分别为0.013和0.011,遗传距离相对较大,亲缘关系也较远。基于遗传距离构建的NJ和UPMGA系统进化树趋于一致,SC群体首先与ZJ群体聚在一起成为一小支,然后再与TL群体聚为另一支,结果表明3个群体的遗传距离进化关系与聚类关系类似。产生这样结果的原因可能是SC群体和ZJ群体的遗传背景相似,而与TL群体遗传背景差异较大,亦或是SC群体、ZJ群体与TL群体存在养殖地理环境的差异。
鉴于本研究是从一个线粒体基因对罗氏沼虾3个不同群体的遗传多样性进行评估,且样本量有限,因此上述结果只可作初步参考,而后期有必要增加检测样本数量,同时将从其他多个线粒体基因并配合核DNA遗传分析,以期得到更全面和客观的结果。

