人呼吸道合胞病毒疫苗研发的突破及挑战
虞结梅
北京交通大学生命科学与生物工程研究院
郑妍鹏
北京交通大学生命科学与生物工程研究院
彭向雷
北京交通大学生命科学与生物工程研究院
付远辉
北京交通大学生命科学与生物工程研究院
何金生*
北京交通大学生命科学与生物工程研究院
2023年是人呼吸道合胞病毒(human respiratory syncytial virus,RSV)疫苗研发史上值得纪念的一年。自1957年RSV被发现[1-2]至今,经过科学家们60 多年的不懈努力,在走出20世纪60年代RSV 疫苗研发失败的阴影后,终于成功研发出可预防RSV 感染的疫苗。2023年5月,美国食品药品监督管理局(FDA)先后批准了葛兰素史克(GSK)和辉瑞(Pfizer)研发的有佐剂的Arexvy 和无佐剂的Abrysvo 两款亚单位疫苗(subunit vaccine),用于预防60 岁及以上老年人群RSV 感染。这两款亚单位疫苗均由RSV融合前融合糖蛋白(prefusion fusion glycoprotein,preF)组成,其中辉瑞的Abrysvo 疫苗是由RSV 的A和B亚型preF 蛋白组成的二价疫苗。2023年8月,FDA 又批准了辉瑞的Abrysvo疫苗用于32~36 周孕妇,为0~6个月的新生儿提供保护。在此之前,FDA 于2023年7月还批准了阿斯利康(AstraZeneca)和赛诺菲(Sanofi)的preF 蛋白Ø 表位特异性的长效单抗尼塞维(nirsevimab,商品名为Beyfortus),用于8个月以下的所有新生儿及8~19 个月有高致死风险的婴幼儿预防RSV 感染。至此,新生儿及早产儿和患先天性心肺疾病的高风险婴幼儿可通过被动免疫安全度过出生后1~2 个RSV 流行的秋冬季风险期,而老年人群则可通过接种疫苗获得免疫保护。除了RSV亚单位疫苗外,还有多种候选疫苗已经进入Ⅱ期或Ⅲ期临床试验阶段,包括RSV 减毒活疫苗(live-attenuated vaccine,LAV)、mRNA 疫苗、腺病毒载体疫苗(adenovirus-vectored vaccine)和颗粒疫苗等,相信未来将有更多RSV 疫苗进入临床。
尽管RSV 疫苗研发已取得阶段性成果,但要从根本上解除RSV 感染对人类健康的威胁,仍任重而道远。美国疾病控制与预防中心(CDC)监测数据显示,在2022~2023年RSV 流行季,因RSV 感染相关疾病住院的人群中,6~24 个月婴幼儿住院人数约为65 岁以上人群的22 倍,婴幼儿人群疾病负担远超老年人群[3]。然而,针对6 个月~5 岁的婴幼儿和低龄儿童,尚缺乏安全、有效的RSV 疫苗。
现阶段,可用于保护老年人及新生儿的RSV 疫苗研发实现了突破性进展,加快研发可用于低龄儿童的RSV 疫苗尤为迫切。本文结合笔者课题组研发经历及国内外RSV 疫苗研发情况,对可用于预防婴幼儿及低龄儿童RSV感染的疫苗及其研发进展进行介绍与讨论。
1 背景
1.1 RSV 的致病性
RSV是单股负链、有包膜的RNA 病毒,基因组共有10 个基因,编码11 种蛋白[4]。2016年,国际病毒分类委员会(ICTV)把RSV 从副黏病毒科肺病毒属改划至新设立的肺病毒科正肺病毒属[5-6]。
越来越多的流行病学研究显示,RSV 是引起包含新生儿及婴幼儿在内的5 岁以下低龄儿童肺炎的重要病原和引起老年人群肺炎的重要病原。全球每年大约有3300 万5 岁以下儿童患下呼吸道感染(low respiratory tract infection,LRTI),其中约有360 万人需住院治疗,10 万余人死亡,大多数(>97%)死亡病例发生在中低收入国家。包括我国在内的全球5 个国家(印度、中国、尼日利亚、巴基斯坦和印度尼西亚)的RSV 疾病负担约为全球的50%,RSV 对于低龄儿童的疾病负担远远超过流感,同时,RSV 也是65 岁以上老年人群肺炎的重要病原。数据显示,美国每年有6 万~16 万老年人因感染RSV 住院治疗,0.6 万~1 万老年人因感染RSV 死亡;全球有33.6 万老年人需住院治疗,院内死亡人数达1.4 万[7-9]。在我国,RSV 也是5 岁以下儿童肺炎的重要病原[10]。此外,在低收入国家,RSV 感染是6 个月以下婴幼儿死亡的主要原因,推测因感染RSV致死导致的全球负担可能被低估了,同时低龄儿童一旦罹患肺炎,对其肺脏功能会产生持续性损害[11-12]。
1.2 FI-RSV 疫苗及其ERD
鉴于RSV 感染对人类健康的严重威胁,早在20 世纪60年代科学家们就开始了基于福尔马林灭活RSV 全病毒(formalininactivated whole RSV,FIRSV)的疫苗研究。与对照组(5%儿童因自然感染RSV 住院)相比,接种FI-RSV 疫苗(Lot 100)的美国儿童中,在随后因RSV 自然感染住院的患儿人数高达80%,并有2 名婴幼儿死亡[13]。研究显示,FI-RSV 疫苗引起了呼吸道或RSV 疾病增强作用(enhanced respiratory/ RSV diseases,ERD)[14]。FI-RSV疫苗研发的失败对此后相关研究产生了持续的负面影响,RSV 疫苗研发一度陷入停滞状态。
关于FI-RSV 疫苗引起的ERD,有3 个问题已经明确:一是ERD 只发生于接种FI-RSV的血清学阴性(RSV-naive)的儿童;二是ERD 的临床表现为增强的肺部炎症(细支气管周围炎和肺泡炎);三是与FI-RSV类似、不能在体内从头合成的亚单位疫苗存在ERD 风险。关于ERD 的发生机制,目前得到较广泛认可的观点是:诱导辅助型T细胞2(Th2)偏向的免疫应答、伴嗜酸性粒细胞增加;诱导产生的病毒结合抗体缺乏中和抗体活性,与病毒形成免疫复合物沉积到肺脏组织,并激活补体[14]。
1.3 RSV preF 构象疫苗
结构性或构象疫苗概念的提出及结构稳定的RSV preF 的成功设计,有力推动了近10年来RSV 疫苗的突破性研究(图1)。研究数据显示,结构稳定的preF 是产生高效主动免疫的关键因素,以preF 接种成人诱导的中和抗体滴度能够增加10倍以上,而以RSV 融合后融合糖蛋白(postfusion fusion glycoprotein,postF)免疫仅能产生约2 倍的增加[15-18]。基于preF 设计的、以老年人或孕妇为目标人群的4 款RSV 疫苗都取得了很好的保护效果,包括Ad26.RSV.preF(表 达preF 的26 型重组腺病毒)与RSV preF(preF亚单位疫苗)混合疫苗(强生)[19]、AS01E-佐剂的RSV preF 亚单位疫苗(葛兰素史克)[20]、无佐剂的RSV preF亚单位二价疫苗(辉瑞)[21-22]、表达preF 的mRNA疫苗mRNA-1345(莫德纳)[23]。而未采用preF 设计的多款疫苗虽然在Ⅰ期或Ⅱ期临床试验中取得了较好结果,但均因未达到临床试验终点,先后宣布不进入Ⅲ期临床试验或Ⅲ期临床试验失败(表1),如Novavax 公司的RSV 纳米颗粒疫苗、葛兰素史克公司的ChAd155.RSV(FNM2-1)和Bavarian Nordic 公司的MVABN-RSV(FG2NM2-1)等[24-30]。值得一提的是,在宣布退出Ⅲ期临床试验的疫苗中,强生于2023年3月29日突然宣布终止其正在进行的上述混合疫苗的Ⅲ期临床试验,该决定引起了业界的多种猜测。这是因为其Ⅱb 期临床试验达到了主要和关键性次要终点,在含安慰剂对照组的5782 名65 岁以上老年人中,该疫苗针对RSV 相关的严重下呼吸道感染的保护效力为80.0%(94.2%CI,52.2%~92.9%),针 对RSV 相关的下呼吸道感染任何症状的保护效力为69.8%(94.2%CI,42.7%~85.1%)[19]。并且,在其此前进行的Ⅱa 期、健康成人人体病毒攻击(human viral challenge,HVC)临床试验中,与对照组相比,疫苗接种组在感染风险、疾病严重程度和病毒载量等方面也都有很大程度的降低[31]。现推测强生做出这一决定与RSV等病毒疫苗的研发格局有关。此后,强生又宣布停止包括RSV 疫苗在内的其他病毒疫苗的研发。
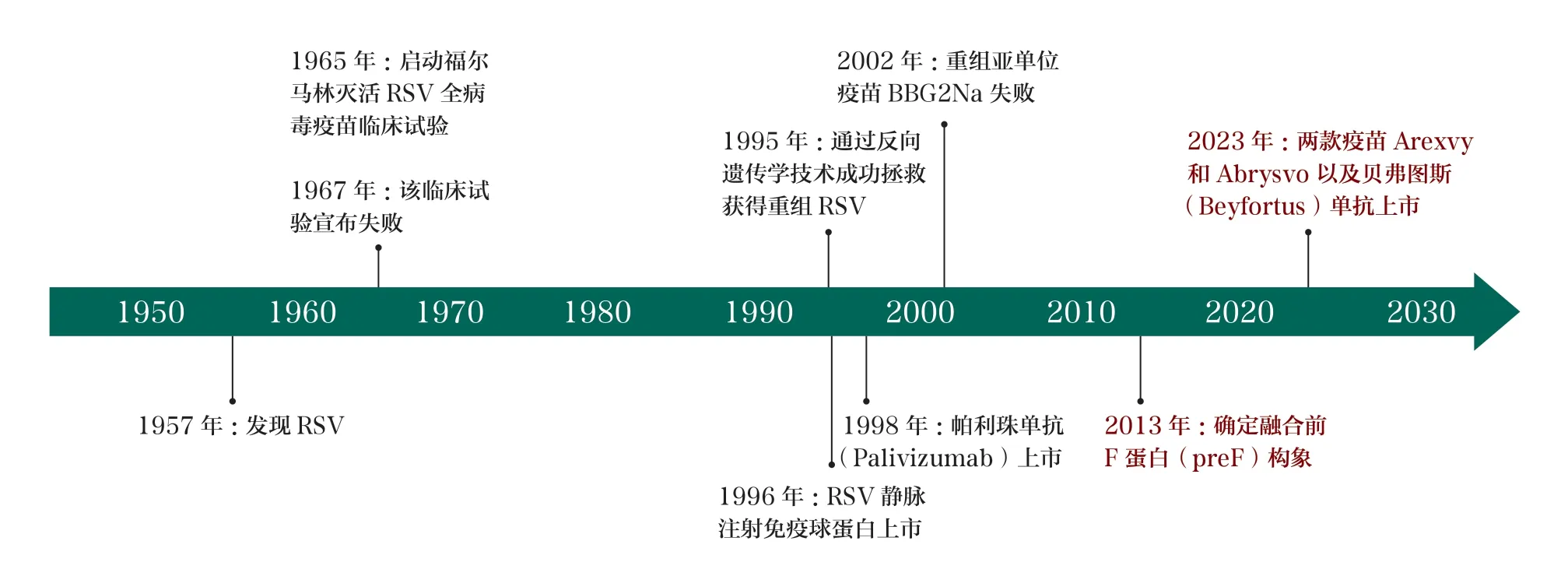
图1 1957~2023年RSV 疫苗研发主要事件
2 适用于婴幼儿及低龄儿童的RSV 疫苗研发面临的主要挑战
2.1 RSV不同易感人群适用不同形式的RSV 疫苗
FI-RSV 疫苗引起的ERD仅见于RSV 血清学阴性儿童。也就是说,只有给没有自然感染过RSV 的儿童接种FI-RSV 才有发生ERD 的风险,而经历过RSV 自然感染的人群或实验感染的动物,即使以FI-RSV 等非活疫苗(non-live vaccine)进行接种也是安全的[32-33]。这是因为RSV 自然感染虽然不能诱导宿主产生持久的保护性免疫,但是能产生CD8+CTL 等细胞活化的Th1 偏向的免疫应答,这些人群接种非活疫苗不会再出现Th2偏向的应答,因此没有ERD 的风险。这提示我们,针对经历或未经历过自然感染RSV 的不同易感人群,应采取不同预防策略。例如,尚未经历RSV 自然感染的、0~6 个月的新生儿由于免疫系统发育不成熟及受母传抗体干扰,主动免疫难以诱导产生及时、有效的免疫保护作用,可采用以preF 亚单位疫苗免疫第三孕期的孕妇或用“疫苗样”长效单抗免疫新生儿的策略。2023年8月3日,美国CDC 推荐经FDA 批准的贝弗图斯单抗,用于8 个月以下的所有新生儿预防RSV 感染。此外,FDA 还批准了辉瑞的二价亚单位疫苗经免疫孕妇为新生儿提供抗体保护。值得关注的是,采用母乳喂养同样能为新生儿提供安全且容易获得的高效预防作用。而针对经历过RSV 自然感染的60 岁以上老年人,获FDA 批准的亚单位疫苗显示有很好的保护作用。另外,腺病毒载体疫苗和mRNA 疫苗等也能诱导老年人群产生很好的保护性免疫应答。
2.2 婴幼儿RSV 疫苗研发面临的挑战
除了新生儿和老年人群,婴幼儿及低龄儿童同样面临RSV感染带来的巨大危害,迄今尚无安全、有效的疫苗。这是因为研发适用于该群体的RSV 疫苗必须确保不能发生ERD,而该群体中6~24 个月的婴幼儿许多为血清学阴性。因此,要研发适用于该人群的RSV 疫苗必须把握好以下问题。
研究者在以BALB/c 和棉鼠为动物模型的研究中发现,与FI-RSV 疫苗类似,亚单位疫苗等新一代非活疫苗由于诱导产生Th2 或Th17 偏向的细胞免疫应答,虽然可产生较好的中和抗体,但接种RSV 血清学阴性的婴幼儿后仍存在ERD 风险,甚至当采用结构稳定的preF 蛋白和Th1 偏向的佐剂时,这种风险仍然不能避免[34-36]。由于ERD 仅发生于血清学阴性的儿童,为了避免进入临床试验的亚单位等非活候选RSV 疫苗用于血清学阴性儿童时出现ERD,可以利用动物模型去证实是否存在这种风险。然而,由于ERD 的产生具有复杂性(RSV F-DNA 疫苗和表达G 蛋白的痘苗病毒载体疫苗等也能诱导ERD 的产生),以及尚无可用于判断的清晰明确的生物标志物,即使逐一进行评估,采用现有的动物模型也并不能确保ERD 完全再现(较强的中和抗体应答可掩盖ERD),即现阶段的临床前试验尚无法排除亚单位等候选RSV 儿童疫苗的ERD风险[14,29,36-40]。因此,亚单位疫苗和蛋白疫苗等非活疫苗难以用于接种婴幼儿等RSV 血清学阴性儿童。另外,与SARSCoV-2 和脊髓灰质炎等呼吸道和肠道感染病原相似,如果能同时诱导黏膜局部和系统免疫应答,不仅能减轻疾病,还可通过黏膜免疫力降低病毒感染及其传播。同时,由于婴幼儿体内存在的母传抗体对疫苗的免疫效力有干扰作用,与肌内注射接种相比,滴鼻免疫能更好突破这种干扰作用。因此,黏膜疫苗更适合婴幼儿等低龄儿童接种。
3 有望用于婴幼儿及低龄儿童的RSV 疫苗主要形式及研发进展
3.1 可用于婴幼儿及低龄儿童的RSV 疫苗
理论上,可以在细胞内从头合成蛋白的RSV 候选疫苗(包括RSV LAV、嵌合疫苗、病毒载体疫苗和mRNA 疫苗等),可像自然感染一样同时诱导中和抗体和CD8+T 细胞免疫应答,产生Th1 偏向的免疫应答,不会引起ERD,因此是有望用于预防婴幼儿及低龄儿童感染RSV 的主要疫苗形式。其中,RSV LAV、B/HPIV3-F 和ChAd155-RSV载体疫苗等在血清学阴性儿童开展的临床试验中,都未发生ERD[30,41-42]。另外,RSV LAV 和腺病毒载体疫苗等均可经滴鼻途径接种,除了系统免疫外,还可同时诱导包括分泌型免疫球蛋白A(SIgA)和黏膜局部定居记忆性T 细胞(mucosal tissue-resident memory T cells,TRM)的黏膜免疫和记忆性固有免疫(trained innate immunity,TII)等三重免疫应答,因此除了能够减轻疾病,还能更有效地阻止病毒在上下呼吸道黏膜的定殖、抵抗早期感染、阻断病毒感染和传播。与病毒载体和mRNA 等疫苗相比,RSV LAV 能表达可诱导细胞免疫的所有病毒抗原,而且表达的F 蛋白主要以preF 形式存在。同时需要指出的是,结合RNA 病毒反向遗传学技术和对病毒致病机制的新认识,通过缺失RSV的NS2 和M2-2 蛋白的编码基因和进行密码子去优化等,可产生比野毒株毒性减弱(如因抑制宿主干扰素应答的NS2基因或抑制病毒mRNA 合成、促进病毒基因组合成的M2-2等毒力相关基因缺失,导致病毒感染宿主后复制能力下降)而免疫原性更强(如NS2基因缺失导致的宿主干扰素应答增强,或M2-2基因缺失导致包括中和抗原F 和G 蛋白等其他病毒抗原表达量增加,从而引起增强的适应性免疫应答)的第二代RSV LAV[41,43]。研究显示,部分LAV(如黄热病疫苗等)在没有佐剂的情况下,单次免疫可产生终生保护作用,因此LAV 常具有很好的免疫原性[33]。目前,已有多个进入Ⅱ期临床试验或获得美国FDA 快速通道资格认定的(fast-track-designation)RSV LAV,根据已发表的论文、临床试验信息等[29,41,43-46],本文推测了有望进入Ⅲ期临床试验的RSV LAV(表2)。
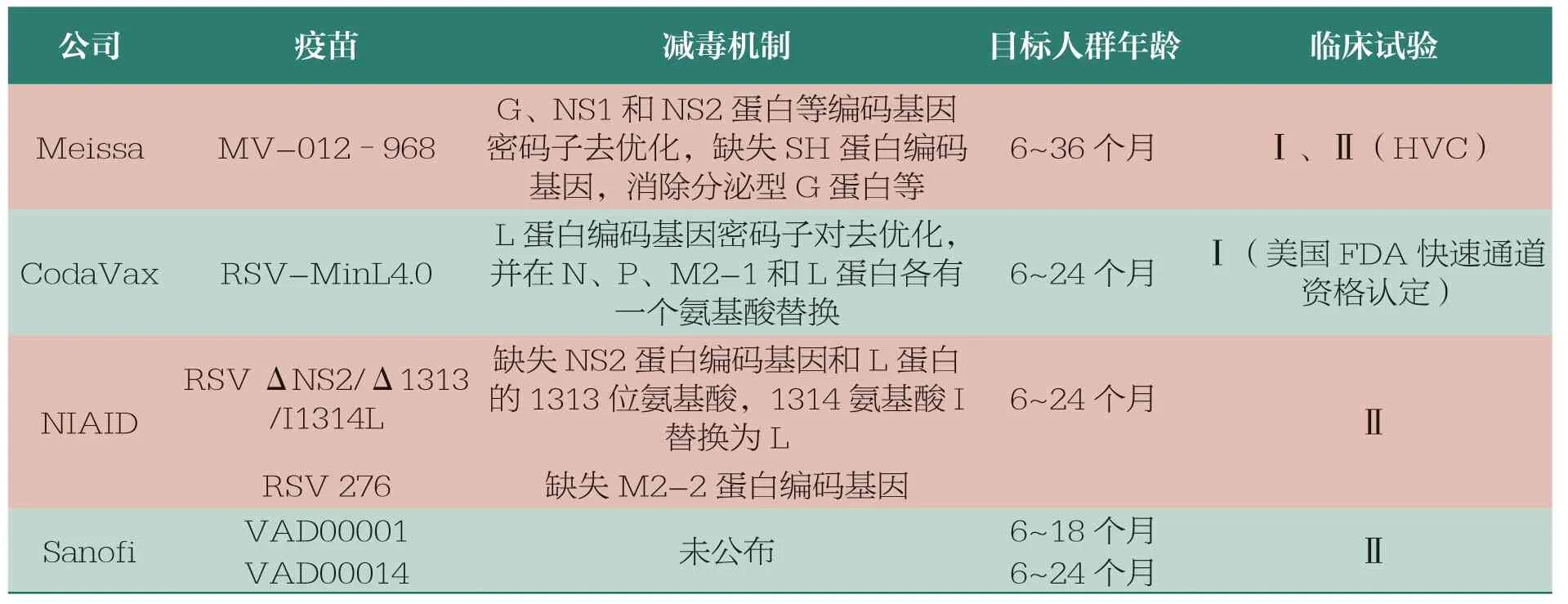
表2 有望进入Ⅲ期临床试验的第二代RSV LAV(截至2023年9月)
3.2 可用于婴幼儿及低龄儿童的RSV LAV 疫苗主要特点及进展
目前,以未感染过RSV 的婴幼儿为目标人群,已经和正在开展多个RSV LAV 的Ⅰ期临床试验,根据其中已经完成的7 个第二代RSV LAV 在安全性和免疫效力等方面的数据[47],经分析发现,作为婴幼儿疫苗的RSV LAV 具有以下特点及优势。
一是安全。在将RSV LAV经滴鼻途径直接接种6~24 个月的血清学阴性儿童时,与自然感染RSV 相同未发生ERD,即采用RSV LAV 接种母传抗体水平下降的、6 个月以上的儿童具有很好的安全性。目前,RSV LAV是唯一一种经大量临床试验验证可直接以血清学阴性儿童为目标人群的候选疫苗,所有其他形式的疫苗要在血清学阴性儿童中开展临床试验,必须依次完成成人、血清学阳性儿童的Ⅰ期临床试验。
二是高效。RSV LAV 可显著降低RSV 感染引起的需要就医的急性呼吸道疾病(medically attended acute respiratory illness,MAARI)和需要就医的急性下呼吸道疾病(medically attended acute lower respiratory illness,MAALRI)。由于RSV 在婴幼儿人群中有较高的感染率,若要开展评价RSV LAV 免疫效力的Ⅲ期临床试验,只需要入组相对较少人数的血清学阴性儿童就能满足取得有临床意义的试验终点(对MAARI 和MAALRI 的免疫效力分别达到55%和80%)时对样本数的要求。结合不同年份间及不同区域间RSV 自然感染率及致病率(临床试验中对照组受试人群因RSV感染导致的MAARI 和MAALRI发病率)的波动情况,据现有资料估算可知,最少仅需要招募540 名、最多需要招募1300 名RSV 血清学阴性儿童,就能完成Ⅲ期临床试验。当然,临床样本数大小还受婴幼儿感染RSV 等呼吸道疾病时就医意愿等多种因素的影响,确切的样本数还应结合临床试验开展当时、当地的情况进行综合测算和评估。
三是评价指标明确。采用空斑减少中和试验(plaque reduction neutralizing test,PRNT)分析中和抗体滴度发现,与接种前相比4 倍及以上增加的中和抗体就能同时、高效保护宿主上下呼吸道避免感染,且能持续1年以上。这种保护作用显然不能被完全或简单地归功于4 倍及以上增加的中和抗体,因为血清中和抗体难以有效渗透至鼻腔黏膜,这可能与RSV LAV 经黏膜免疫可同时诱导黏膜抗体和细胞免疫应答等有关。因此,当采用RSV LAV 经滴鼻途径接种婴幼儿时,用便于进行临床分析的“4倍及以上增加的中和抗体”作为体液、黏膜和细胞等记忆性免疫应答程度的指标似乎更加合理。
四是滴鼻免疫可行。RSV LAV 完全可以同自然感染一样,便于进行滴鼻接种。该途径具有依从性好、不需要专业人员接种,以及能够克服母传抗体干扰等优势,且经滴鼻免疫可同时诱导系统、黏膜局部和固有免疫等三重免疫应答,为上下呼吸道同时提供保护作用。而常用的肌内注射接种方式,存在依从性差和需要专业人员完成等局限性,且仅能诱导系统免疫应答,不能同时为上下呼吸道提供保护作用(这是因为渗出到黏膜表面的血清中和抗体会从下呼吸道到上呼吸道逐渐减少)。
因此,根据RSV LAV 现有临床试验数据及其独特优势,笔者认为该候选疫苗有望用于血清学阴性儿童预防RSV 感染。
4 思考
新中国成立以来,以顾方舟等为代表的疫苗研发、疾病防控和新药审评等领域科技工作者,努力推动我国疫苗研发、评价、生产及监管全链条取得跨越式发展,为我国传染病防控工作的开展奠定了坚实基础。在RSV 疫苗研发等方面,我国虽与欧美等发达国家和地区相比仍有一定差距,但是已经具备较好的研发基础和条件。疫苗研发是一项系统工程,为进一步推动我国RSV LAV 等RSV 疫苗加速进入临床,笔者有如下思考供参考。
一是尽快建立及共享全国RSV 感染等呼吸道常见传染病监控信息系统。除了新冠病毒感染等新发传染病外,常见呼吸道传染病持续对公众健康造成危害,疾病负担较为严重,可共享的全国性监测网络及数据有待建立完善。不同年龄人群感染及流行状况和疾病负担,以及低龄儿童血清流行病学等基础数据,对于疾病防控、预警和疫苗免疫效力评价及社会经济效益分析等都具有重要的科学和应用价值。因此,建立规范、动态、公开、稳定的常见呼吸道传染病监测信息系统势在必行。
二是加快制定和规范我国RSV 疫苗安全性和免疫效力评价标准。鉴于历史原因及RSV疫苗研发存在的巨大风险,我国在RSV 疫苗研发上的投入有待加大。面对突然形成的RSV 疫苗研发风口,国内多家疫苗企业纷纷布局RSV 疫苗领域,这对RSV 疫苗研发能力建设提出了迫切要求。例如,在RSV 疫苗临床前研究中,应解决好用于疫苗效力评价的棉鼠产能不足的问题,尽快建立和规范可实现RSV中和抗体滴度高通量分析的方法,及早探讨和确定符合我国国情的科学、合理的RSV 疫苗临床试验终点及其样本人群规模。对于进入Ⅱ期临床试验的RSV 疫苗,建议合理借鉴国外经验,如招募健康成人开展Ⅱa 期人体病毒攻击试验(HVC),以更好地确定疫苗安全性和免疫效力,且应及时对此做法的科学性、合理性和可行性进行论证及评估,并制定相应的监管措施。
目前,RSV 疫苗研发面临的主要挑战是需要尽快为6 个月以上的血清学阴性婴幼儿及低龄儿童提供安全、有效的疫苗。基于反向遗传学技术及具有雄厚研究基础的RSV LAV 在减毒活性和免疫原性的平衡方面已取得巨大进步。临床试验数据也显示,RSV LAV 是可用于血清学阴性婴幼儿及低龄儿童的最有竞争力的候选疫苗之一,有望成为继结构性疫苗后RSV 疫苗研发的新突破点。为更好发挥我国的制度优势,加快RSV LAV 的研发步伐,建议我国疫苗研发相关部门积极组织、引导和协调,充分调动企业、高校和科研单位的积极性和创造性,及早启动项目立项工作以加强科研攻关及交流合作,推动具有自主知识产权的RSV LAV 早日进入临床,进一步提高我国婴幼儿和低龄儿童的健康水平。
RSV疫苗研发在2023年取得的积极进展对国内外疫苗企业的产品布局产生了一定的影响。在我国,RSV 疫苗研发热度迅速升温,许多疫苗企业陆续进军该领域,其中mRNA 疫苗和亚单位疫苗是主要研发方向,推测与这两种疫苗认知度高、风险低、周期短、易获得投资方的关注及靶向老年人群有关,也不排除部分企业存在用一款疫苗试图覆盖所有人群的研发思路,但对于RSV疫苗研发而言,这种判断具有很大风险,相关企业应持谨慎态度。与此同时,帕斯适宜卫生科技组织(PATH)2023年9月发布的数据显示,许多国外企业纷纷撤除或停止已进入临床试验的RSV候选疫苗,只有少数几家公司仍致力于RSV 疫苗研发,如赛诺菲专注推进可用于婴幼儿的RSV LAV 研发,莫德纳正在研发可用于老年人群的mRNA 疫苗等[48]。建议我国相关企业合理借鉴国外企业做法,高度关注疫苗产品的市场格局、发展前景以及创新性。

Image by Freepik
5 小结
21 世纪以来,以科学和技术进步主导的RSV 疫苗研发取得了全面发展和丰硕成果。基于RSV F 蛋白融合前构象的preF 亚单位疫苗能诱导老年人和孕妇产生有效的保护性免疫应答,改写了以往RSV 疫苗研发受阻的被动局面。这一成果来源于结构性疫苗概念,也是迄今结构性疫苗最具标志性的成果。2023年5月获美国FDA 批准的两款preF 疫苗实现了RSV 疫苗零的突破,为进一步降低老年人群肺炎风险提供了新防护;2023年7月 和8月先后获批的“疫苗样”长效单抗贝弗图斯和用于孕妇的preF 疫苗,为降低新生儿和高风险儿童RSV 肺炎发病率提供了更加多样化的选择。自此,随着上述疫苗和抗体的应用,老年人和新生儿的健康水平有望进一步提高。由此可见,2023年必将成为RSV疫苗史上具有里程碑意义的一年,同时也将拉开新款RSV 疫苗上市的大幕,从而成为RSV 疫苗研发的新起点。除了亚单位疫苗,有多年研发基础的RSV LAV 正蓄势待发,新秀mRNA 疫苗正如日中天,可覆盖不同人群的RSV疫苗也势必不断涌现,尤其是适用于婴幼儿及低龄儿童的RSV LAV 及其黏膜应用有望为RSV疫苗研发带来新的突破。

