血清骨桥蛋白、胶质纤维酸性蛋白在脑胶质瘤诊断中的应用
张 娜, 尚金星, 龙 平, 王立平
(1. 河北省沧州中西医结合医院 检验科, 河北 沧州, 061000; 2. 河北省沧州市中心医院 神经外科, 河北 沧州, 061000)
胶质瘤属颅内常见的原发性肿瘤,起自神经胶质细胞,恶性程度较高[1]。脑胶质瘤通常预后较差,中位生存时间甚至不超过1年,且复发率高[2]。近年来,人们对于血液生物标志物的应用价值越来越关注,肿瘤患者的诊断、预后评估、治疗指导等都是血液生物标志物使用时的重要考虑因素。骨桥蛋白(OPN) 属于分泌性钙结合糖磷酸化蛋白,可结合受体整合素及CD44, 对细胞产生趋化、黏附、迁移、增殖等促进作用,与恶性肿瘤侵袭关系密切[3]。胶质纤维酸性蛋白(GFAP)对神经元具有支撑与营养作用,参与星形胶质细胞的细胞增殖、分裂以及血脑屏障生理功能维护、自噬、神经递质平衡维持等生物功能[4]。本研究分析脑胶质瘤患者血清OPN、GFAP水平变化,现报告如下。
1 资料与方法
1.1 一般资料
选取2019年3月—2021年5月83例脑胶质瘤患者为研究对象(脑胶质瘤组),其中男44例,女39例; 年龄37~75岁,平均(56.66±7.19)岁; 肿瘤部位为额叶46例,颞叶22例,顶叶8例,其他7例; 肿瘤≤3 cm者12例,>3~5 cm者39例,>5 cm者32例; 病理分级为Ⅰ级20例,Ⅱ级21例,Ⅲ级23例,Ⅳ级19例。纳入标准: ① 经手术及组织病理学检查证实为脑胶质瘤者; ② 预计生存期3个月以上者。排除标准: ① 合并脑外伤或有脑手术病史者; ②合并血管畸形、颅内占位者; ③ 合并严重颅内压增高或脑疝者; ④ 合并免疫或血液系统疾病者; ⑤ 入组前接受化疗、免疫治疗者。将2019年3月—2021年5月颅内良性肿瘤住院患者20例纳入颅内良性肿瘤组,男11例,女9例; 年龄36~76岁,平均(55.91±7.03)岁; 疾病种类为垂体瘤6例,脑膜瘤7例,神经鞘瘤5例,中枢神经细胞瘤1例,海绵状血管瘤1例。另外选择进行体检的健康人群20例为对照组,其中男11例,女性9例; 年龄37~74岁,平均(57.03±7.40)岁; 脑胶质瘤组、颅内良性肿瘤组、对照组性别及年龄资料比较,差异无统计学意义(P>0.05)。
1.2 方法
脑胶质瘤组患者均行显微镜下脑胶质瘤全切或次全切除术,近距离充分暴露瘤体,显微镜下切除非功能区瘤体,术后Ⅰ~Ⅱ级患者次全切除者术后给予放射治疗; Ⅲ~Ⅳ级者联合放化疗。术后2周行放射治疗,靶区行60Co射线照射, 1.5~2.0 Gy/次, 5次/周,放射治疗5周,靶区总剂量50 Gy。同时行化学治疗,替莫唑胺(Merck Sharp & Dohme Ltd, 批准文号H20120420)口服剂量为150 mg/m2, 第1周1次/d, 第2周开始根据患者不良反应程度逐步递增至200 mg/m2, 28 d为1个周期,共治疗6个周期。
所有研究对象均于疾病诊断后以及术后第14天、放射和化学治疗完成后晨起空腹取肘静脉血5 mL, 以3 000转/min离心15 min后取上清液, -80 ℃保存。血清OPN、GFAP的检测采用双抗体夹心酶标免疫分析法。每个酶标板孔加入稀释液100 μL, 空白孔加样品稀释液50 μL, 标准孔、待测样品孔分别加标准品、待测样品50 μL, 混匀,室温孵育2 h。吸除液体,甩干,缓冲液洗涤(4次),每孔分别加OPN、GFAP结合物2 000 μL, 酶标板贴覆膜,室温下孵育2 h, 吸除液体,甩干,缓冲液洗涤(4次)。依序每孔加底物2 000 μL, 室温下孵育30 min, 酶标板孔中溶液呈蓝色,注意避光。以底物液相同顺序加入终止溶液50 μL, 终止反应,酶标板孔中颜色由蓝变黄。采用酶联仪测量各孔光密度(OD)值。计算标准曲线直线回归方程式,横坐标为标准物水平,纵坐标为OD值,实际水平=OD值×稀释倍数。试剂盒购自美国R&D公司。
1.3 统计学方法
采用SPSS 20.0对数据进行分析,组间不同时间点计量资料比较采用重复测量方差分析,多组间同一时点比较采用F检验,组间两两比较采用独立样本t检验,计数资料组间比较采用χ2检验或Fisher确切概率分析,通过受试者工作特征(ROC)曲线评估血清OPN、GFAP检测对疾病的诊断和病理分级评估价值,P<0.05为差异有统计学意义。
2 结 果
2.1 2组血清OPN、GFAP水平比较
脑胶质瘤组血清OPN、GFAP表达水平高于颅内良性肿瘤组和对照组,差异有统计学意义(P<0.05), 见表1。
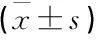
表1 2组血清OPN、GFAP水平比较
2.2 血清OPN、GFAP水平对脑胶质瘤的评估价值分析
血清OPN、GFAP联合检测评估发生脑胶质瘤的ROC曲线下面积为0.883, 高于OPN(0.793)、GFAP(0.789)单独检测(P<0.05), 见表2、图1。

表2 血清OPN、GFAP水平对脑胶质瘤的评估价值分析
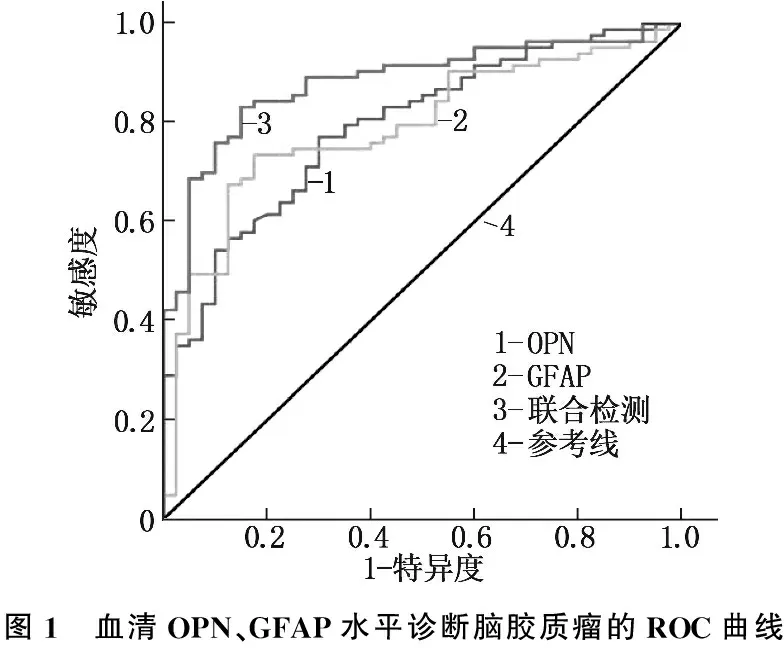
图1 血清OPN、GFAP水平诊断脑胶质瘤的ROC曲线
2.3 不同病理特征脑胶质瘤患者血清OPN、GFAP水平比较
不同性别、年龄、肿瘤位置、肿瘤直径、卡氏评分法(KPS)评分患者血清OPN、GFAP水平比较,差异无统计学意义(P>0.05); 世界卫生组织(WHO)分级为Ⅲ~Ⅳ级、肿瘤抑制基因P53基因型突变型、细胞增殖活性抗原Ki-67高表达脑胶质瘤患者血清OPN高于WHO分级为Ⅰ~Ⅱ级、P53基因型野生型、Ki-67低表达患者, GFAP水平低于WHO分级Ⅰ~Ⅱ级、P53基因型野生型、Ki-67低表达患者,差异有统计学意义(P<0.05), 见表3。
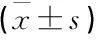
表3 不同病理特征脑胶质瘤患者血清OPN、GFAP水平比较
2.4 血清OPN、GFAP水平对脑胶质瘤WHO分级的评估分析
采用血清OPN、GFAP联合检测评估脑胶质瘤WHO分级。联合检测诊断Ⅲ~Ⅳ级脑胶质瘤ROC曲线下面积为0.792, 高于OPN(0.690)或GFAP(0.702)单独检测(P<0.05), 见图2、表4。

图2 血清OPN、GFAP水平对脑胶质瘤WHO分级评估的ROC曲线

表4 血清OPN、GFAP水平对脑胶质瘤WHO分级的评估分析
2.5 不同WHO分级脑胶质瘤患者治疗前后血清OPN、GFAP水平比较
WHO分级为Ⅰ~Ⅱ级和Ⅲ~Ⅳ级脑胶质瘤患者术后第14天血清OPN、GFAP水平均较治疗前降低,且放化疗后患者血清OPN、GFAP水平进一步降低,差异有统计学意义(P<0.05); WHO分级为Ⅲ~Ⅳ级脑胶质瘤患者治疗前、术后2周、术后6个月的血清OPN、GFAP水平均高于Ⅰ~Ⅱ级患者,差异有统计学意义(P<0.05), 见表5。
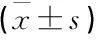
表5 不同WHO分级脑胶质瘤患者治疗前后血清OPN、GFAP水平比较
3 讨 论
胶质瘤属于较难治愈的中枢神经系统肿瘤,早期误诊率、漏诊率较高,且缺乏特异性诊断方法。胶质瘤侵袭性生长、易复发特征是导致临床治疗效果较差和患者不良预后的主要原因,即使采用手术治疗,其5年生存率也极低[5]。脑胶质瘤侵袭受多种基因、蛋白共同调控,这一过程可能涉及肿瘤细胞黏附、增殖、基质降解、迁移等环节[6]。
OPN可促进肿瘤侵袭,是一种新的肿瘤标志物[7]。YU A Z等[8]研究在同一条件下检测多种肿瘤OPN表达水平,结果显示食管癌、胃癌、肠癌、肺癌、子宫内膜癌、卵巢癌中均发现OPN 过度表达。本研究也显示,脑胶质瘤患者血清OPN呈现高表达,血清OPN评估发生脑胶质瘤的ROC曲线下面积为0.793, 可在一定程度上辅助临床脑胶质瘤的诊断。OPN通过非螯合物前体肽精-甘-天冬氨酸三肽序列(RGD)依赖方式与癌症干细胞标记物血细胞簇分化抗原44(CD44)结合,激活细胞内特异性信号传导系统,破坏细胞外基质,诱导新生血管形成,促使肿瘤向周围趋化、黏附、增殖、迁移,导致脑胶质瘤的发生和发展[9]。本研究显示, WHO分级Ⅲ~Ⅳ级、P53基因型突变型、Ki-67高表达脑胶质瘤患者血清OPN水平高于Ⅰ~Ⅱ级、P53基因型野生型、Ki-67低表达患者,血清OPN评估脑胶质瘤WHO分级ROC曲线下面积为0.690, 提示OPN高表达有脑胶质瘤不良生物学行为。可能原因为: ① OPN依靠信号异常传导并刺激正常细胞恶性生物行为转化; ② 降解细胞外基质,促使肿瘤细胞浸润迁移,刺激肿瘤生长,促进脑胶质瘤恶性发展[10]。
缺血损伤发生会刺激成熟星形细胞GFAP的合成[11]。PINA-MEDINA A G等[12]研究显示,胶质瘤患者血清GFAP浓度高于颅内非胶质瘤组织以及正常脑组织机体血清水平,其浓度值在胶质瘤诊断中具有重要价值,尤其是颇内肿瘤来源诊断存在困难时,其阳性表达对于肿瘤组织属于胶质细胞来源评估具有重要参考价值。本研究也显示,脑胶质瘤患者血清GFAP呈高表达,且血清OPN评估发生脑胶质瘤的ROC曲线下面积为0.789, GFAP异常不仅可引起细胞骨架结构转变,易于迁移、游动,还能导致骨架系统结构变化,干扰信号传导,从而改变肿瘤细胞生物学性状[13]。进一步分析结果显示, WHO分级为Ⅲ~Ⅳ级、P53基因型突变型、Ki-67高表达的患者GFAP表达水平相较于Ⅰ~Ⅱ级、P53基因型野生型、Ki-67低表达患者更低,说明脑胶质瘤患者血清GFAP水平随着肿瘤恶性程度的增高而降低,血清GFAP评估脑胶质瘤WHO分级的ROC曲线下面积为0.702, 提示下调GFAP表达可能导致肿瘤侵袭性增加,进一步增高恶性程度,这可能与GFAP基因表达调控及高甲基化有关,整合素表达随GFAP表达下调,导致细胞外基质、细胞骨架分离溶解,细胞黏附力下降,肿瘤易扩散。研究[14]显示,大部分恶性胶质瘤细胞系中, GFAP低表达与该基因呈高甲基化状态有关,高甲基化状态可导致GFAP转录失活。
本研究结果显示,恶性程度低的脑胶质瘤患者与恶性程度高的患者放化疗后血清OPN、GFAP水平低于治疗前,提示治疗过程中肿瘤细胞的增殖得到了一定抑制, OPN、GFAP合成及释放减少。恶性程度低的脑胶质瘤患者治疗前血清GFAP水平高于脑胶质瘤恶性程度高患者,但随着治疗时间的延长,患者血清GFAP水平大幅度降低,且术后2周、术后6个月后其水平均低于恶性程度高的患者。本研究不足之处在于未对不同疗效患者血清OPN、GFAP变化情况进行探讨,未分析其与患者预后的关系,后续研究过程中可进一步对比完全缓解、部分缓解、疾病稳定、疾病进展患者血清OPN、GFAP变化趋势,并对患者进行随访,比较不同血清OPN、GFAP表达水平患者生存时间的差异。
综上所述,脑胶质瘤患者血清OPN、GFAP呈高表达,其高度恶性患者血清OPN水平高于低度恶性患者, GFAP水平低于低度恶性患者,患者治疗后血清OPN、GFAP水平均较治疗前降低,两者在脑胶质瘤的发生和发展中发挥作用。因此,干扰OPN、GFAP表达或可成为脑胶质瘤治疗靶点之一。

