延胡索及金铃子散镇痛的药效学和网络药理学比对研究
王晨,刘傲蕾,吴和珍,杨艳芳,吴松涛
(1.湖北中医药大学药学院,武汉 430065;2.中药资源与中药化学湖北省重点实验室,武汉 430065;3.现代中药与民族药湖北省工程研究中心,武汉 430065)
延胡索(Corydalis Rhizoma)为罂粟科植物延胡索CorydalisyanhusuoW.T.Wang的干燥块茎,别名元胡、玄胡索、延胡;性温,味辛、苦;归肝、脾经;具有活血,行气,止痛之功效;常用于胸胁、脘腹疼痛,胸痹心痛,经闭痛经等[1]。川楝子(Toosendan Fructus)为楝科植物川楝MeliatoosendanSieb.et Zucc.的干燥成熟果实,别名楝实、金铃子、苦楝子等;性寒,味苦;归肝、小肠、膀胱经;具有疏肝泄热,行气止痛,杀虫之功效;常用于肝郁化火,胸胁、脘腹胀痛,疝气疼痛等[2]。金铃子散为延胡索与川楝子等比组成的中药复方,为理气剂,具有疏肝泄热,活血止痛的功效,临床上常用于抗炎、镇痛等[3-5]。
延胡索与金铃子散同为镇痛药,但两者只有一味药川楝子的差异。文献[6-7]对金铃子散及其单味药的抗炎镇痛作用和血清内源性代谢物进行了研究,发现金铃子散具有明显且相比单味药更优异的抗炎镇痛效果,金铃子散及延胡索给药后,能够降低神经元的兴奋性,从而达到抗炎镇痛的目的。焦苗苗等[8]对延胡索、乌药、金铃子散及小活络丹的神经病理性镇痛作用进行了研究,发现金铃子散的镇痛作用最强且见效快,其次为延胡索。以上学者均对金铃子散及延胡索的镇痛作用进行了研究,其研究结果意义重大,然而其仅探索了金铃子散及延胡索镇痛的药效作用,未对金铃子散及延胡索镇痛的作用机制差异进行研究,存在很大的局限性。为此,通过动物药理实验、网络药理学和分子对接技术对延胡索及金铃子散镇痛的药效作用和作用机制进行系统的比对研究,以期为经典名方金铃子散的现代化和临床上镇痛药的选择与推广提供进一步的理论依据。
1 材料与方法
1.1 受试动物
体质量为(20±2)g的SPF级BALB/c雄性小鼠40只,购自三峡大学,许可证号:SCXK(鄂)2017-0012。小鼠自由进食进水,于恒温恒湿的屏障环境下适应性饲养一周。
1.2 仪器
HH-4恒温水浴锅(常州国华电器有限公司),Milli-Q Advantage超纯水仪(美国Milipore公司),500 mL烧杯(四川蜀玻集团有限责任公司)。
1.3 药物与试剂
延胡索水煎醇沉液2 g/mL及金铃子散水煎醇沉液2 g/mL均由湖北中医药大学药理实验中心提供,0.6%醋酸溶液(现用现配,冰醋酸购于国药集团化学试剂有限公司,批号:10000218),0.9%生理盐水(四川科伦药业股份有限公司,批号:L121071404)。
1.4 延胡索及金铃子散的药效学实验
1.4.1 热板法
调节恒温水浴锅至水温恒定在(55±0.5)℃,将500 mL烧杯放入其中,烧杯底部接触水面。每次取1只小鼠,放入烧杯内,记录自放入烧杯至出现舔后足所需时间(单位:s),作为该鼠的痛阈值。30 s内不出现舔后足者,弃之不用。依次测量各小鼠的痛阈值,取预选合格的小鼠24只,随机分为纯水对照组、生理盐水组、延胡索液给药组及金铃子散液给药组,每组6只,称重后编号。各给药组小鼠分别以0.2 mL/10 g的剂量灌胃,分别在给药后15、30、60、90 min测定各小鼠的痛阈值,若小鼠在热板上60 s仍无舔后足现象,取出并按60 s计。
取不同时间测定的各小鼠痛阈平均值,计算用药后痛阈提高的百分率,计算公式为
(1)
1.4.2 扭体法
小鼠称重,标记后随机分组。40只小鼠分设纯水对照组、生理盐水组、延胡索液给药组及金铃子散液给药组。各组小鼠分别以0.2 mL/10 g的剂量灌胃,30 min后,各小鼠腹腔注射0.2 mL 0.6%醋酸溶液。观察小鼠并记录15 min内出现扭体反应的次数,计算用药后各组的镇痛百分率,计算公式为

(2)
1.5 网络药理学研究
为进一步研究延胡索与金铃子散间的差异,展开网络药理学和分子对接实验对两者的作用机制进行比较分析。
1.5.1 活性成分的检索和筛选
通过中药系统药理学数据库与分析平台(TCMSP, https://old.tcmsp-e.com/tcmsp.php)、中医药综合数据库(TCMID, http://119.3.41.228:8000/tcmid/)、中医药分子机制生物信息学分析工具(BATMAN-TCM, http://bionet.ncpsb.org.cn/batman-tcm/)等多个中药专项数据库平台对川楝子和延胡索的所有成分进行检索。通过设置阈值口服生物利用度(OB)≥30%和类药性(DL)≥0.18,筛选出潜在的活性成分[9]。通过PubChem数据库逐一验证这些活性成分的分子质量、化学结构和理化性质等,并下载其3D结构(.SDF格式)留以检索药物靶点以及进行分子对接实验[10]。
1.5.2 交集靶点的获取
将1.4.1节中获得的3D结构导入SwissTargetPrediction(http://www.swisstargetprediction.ch/)和PharmMapper(http://www.lilab-ecust.cn/pharmmapper/)数据库中,当Probability≥0时,被认为是潜在靶点, 综合两数据库获取药物作用靶点[11-12]。通过GeneCards(https://www.genecards.org/)和MalaCards(https://www.genecards.org/)数据库检索关键词“Analgesic”和“Pain”,获取疾病相关靶点[13]。用Venny在线绘图工具(https://bioinfogp.cnb.csic.es/tools/venny/index.html)表示疾病和药物的交集靶点,这些交集靶点即可视为延胡索及金铃子散镇痛的潜在靶点。
1.5.3 交集靶点的富集分析
DAVID(https://david.ncifcrf.gov/)在线平台能够对基因进行注释、可视化,并综合发现基因的生物学功能和参与调控的信号通路[14]。因此,将交集靶点导入DAVID数据库进行富集分析。结果以GO(gene ontology)和KEGG(Kyoto encyclopedia of Genes and Genomes pathway)形式呈现,其中GO功能由生物过程(biological process, BP)、细胞成分(cellular component, CC)、分子功能(molecular function, MF)组成。通过GO功能富集分析,可以判断被作用交集靶点的变化是否具有生物学意义,通过KEGG信号通路富集分析,可以预测这些交集靶点主要参与并调控的信号通路。
1.5.4 蛋白质-蛋白质相互作用网络
蛋白质相互作用(protein-protein interaction, PPI)及其衍生网络在大多数生物学功能中发挥着重要作用,并且大多数蛋白质能够通过相互作用来激活自身的功能[15]。对PPI网络的分析有助于从系统的角度研究疾病的分子机制,发现新的药物靶点。将交集靶点导入STRING(https://www.string-db.org/)数据库,构建PPI网络,并探索蛋白质相互作用之间的联系或潜在联系,从而遴选出相互作用最密切,或者最为可能的潜在靶点基因[16]。
1.5.5 “成分-靶点-通路”网络的构建
将潜在活性成分、交集靶点和高度相关的信号通路导入Cytoscape3.9.1软件,构建“成分-靶点-通路”(compound-target-pathway,C-T-P)以将所有数据可视化便于分析。通过对网络图进行分析,筛选出关键成分与核心靶点。
1.6 分子对接
综合PPI和C-T-P结果,选取核心靶点与关键成分进行虚拟分子对接。在RCSB PDB数据库(http://www1.rcsb.org/)中检索这些核心靶点,获取该靶点与疼痛病症密切相关的蛋白结构[17]。利用Discovery Studio 2019 Client软件对这些蛋白质结构进行前处理,包括去除小分子配体、氢离子和清理蛋白质等,然后将其与关键成分进行虚拟对接。一般认为,当LibDock Score≥90时,小分子配体与蛋白质受体间的亲和力更强,更易结合[18]。
1.7 统计学分析
数据采用SPSS 16.0统计软件进行分析,数据以均数±标准差(mean ± SD)表示。单因素方差分析P<0.05时,组间比较有统计学意义。
2 结果
2.1 药效学研究结果
2.1.1 热板法
通过小鼠热板法探索并比对延胡索及金铃子散的镇痛效果,结果如表1、图1所示。结果表明,延胡索组与金铃子散组给药后,各时长内痛阈值均有显著性提高(P<0.005)。其中,延胡索组在给药后60 min时能够最大限度提高痛阈值,在60 min后镇痛能力逐渐衰减。金铃子散组在给药后60 min时能够最大限度提高痛阈值,在60 min后镇痛能力趋于稳定。在给药60 min内,延胡索与金铃子散的镇痛作用相似;在给药60 min后,金铃子散的镇痛能力比延胡索更强(P<0.001)。

表1 给药后各时长内痛阈平均值和平均提高率
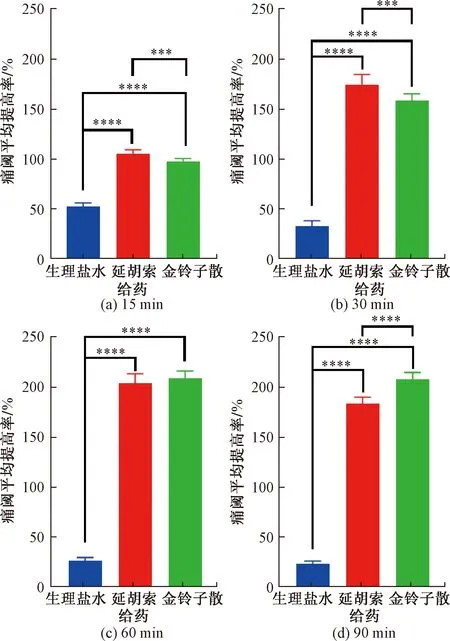
***表示P<0.005;****表示P < 0.001
2.1.2 扭体法
通过小鼠扭体法探索并比对延胡索及金铃子散的镇痛效果,结果如表2、图2所示。结果表明,延胡索组与金铃子散组给药30 min后,均能大幅降低小鼠扭体次数,有显著的镇痛率(P<0.001)。在给药30 min后,延胡索与金铃子散的镇痛作用差异并不明显。

表2 扭体平均次数和镇痛率

*P<0.05, ****P表示<0.001
2.2 网络药理学结果
2.2.1 活性成分的检索和筛选
通过筛选,共得到47个延胡索活性成分,55个金铃子散活性成分。通过已发表文献对川楝子的报道,虽然川楝素(Toosendanin)的OB值没有达到阈值,但它仍然是川楝子中活性很强的成分,因此纳入结果。筛选结果如表3所示。

表3 金铃子散中活性成分基本信息
2.2.2 交集靶点的获取
通过筛选,分别获取659个延胡索作用靶点、746个金铃子散作用靶点以及346个镇痛疾病靶点。利用Venny图对药物作用靶点和疾病靶点进行分析和比较,如图3所示。药物作用靶点和疾病靶点的交集靶点即为该药物镇痛的潜在作用靶点。其中,延胡索镇痛的潜在靶点有103个,金铃子散镇痛的潜在靶点有110个。

图3 Venny图
2.2.3 KEGG通路与GO功能富集分析
分别将延胡索和金铃子散镇痛的潜在靶点导入DAVID数据库中,对其进行KEGG信号通路与GO功能富集注释分析,结果如图4、图5所示。KEGG信号通路富集分析结果显示,延胡索103个潜在作用靶点中有99个靶点基因被富集(96.12%),涉及56条信号通路,其中47条信号通路与靶点基因显著相关(P≤0.05)。以下通路涉及靶点基因参与程度最高:神经活性配体-受体相互作用(neuroactive ligand-receptor interaction, 42个靶点, 40.78%)、钙离子信号通路(calcium signaling pathway, 26个靶点, 25.24%)、5-羟色胺能突触(serotonergic synapse, 17个靶点, 16.50%)。金铃子散110个潜在作用靶点中有106个靶点基因被富集(96.36%),涉及64条信号通路,其中47条信号通路与靶点基因显著相关(P≤0.05)。以下通路涉及的靶点基因参与程度最高:neuroactive ligand-receptor interaction(46个靶点, 41.82%)、calcium signaling pathway(27个靶点, 25.55%)和serotonergic synapse(17个靶点, 15.45%)。

P越小,说明结果与镇痛越相关,结果更可靠;代表信号通路的点越大,说明该通路富集的交集靶点数量越多

antioxidant activity为抗氧化活性;behavior为行为;binding为结合;biological adhesion为生物黏附;biological regulation为生物调节;catalytic activity为催化活性;cell为细胞;cell aggregation为细胞聚集;cell junction为细胞连接;cell killing为细胞杀伤;cellpart为细胞部分;cell proliferation为细胞增殖;cellular component organization or biogenesis为细胞成分组织或生物成因;cellular process为细胞过程;detoxification为解毒;developmental process为发展过程;extracellular region为细胞外区域;extracellular region part为细胞外区域部分;growth为生长;hijacked molecular function为劫持分子功能;immune system process为免疫系统过程;localization为局部化;locomotion为运动;membrane为膜;membrane part为膜部分;membrane-enclosed lumen为膜封闭腔;metabolic process为代谢过程;molecular function regulator为分子功能调节剂;molecular transducer activity为分子换能器活性;multicellular organismal process为多细胞生物过程;multi-organism process为多生物体过程;negative regulation of biological process为生物过程负调节;nucleoid为拟核;organelle为细胞器;organelle part为细胞器部分;pigmentation为着色;positive regulation of biological process为生物过程正调节;protein-containing complex为含蛋白质的复合物;regulation of biological process为生物过程的调节;reproduction为繁殖;reproductive process为繁殖过程;response to stimulus为对刺激的反应;rhythmic process为节奏过程;signaling为信号;structural molecule activity为结构分子活性;supramolecular complex为超分子复合物;synapse为突触;synapse part为突触部分;transcription regulator activity为转录调节活性;transporter activity为转录体活性;红色为BP;绿色为CC;蓝色为MF;柱形图越高,表明该项目富集的交集靶点数量越多
GO功能富集分析结果显示,延胡索103个潜在作用靶点全部被富集(100%)。其中BP富集主要涉及cellular process(103个靶点, 100%)、biological regulation(101个靶点, 98.06%)和response to stimulus(98个靶点, 95.15%)。CC富集主要涉及membrane(94个靶点, 91.26%)、organelle(83个靶点, 80.58%)和synapse(51个靶点, 49.51%)。MF富集主要涉及binding(100个靶点, 97.09%)、molecular transducer activity(55个靶点, 53.40%)和catalytic activity(46个靶点, 44.66%)。金铃子散110个潜在作用靶点全部被富集(100%)。其中BP富集主要涉及cellular process(110个靶点, 100%)、biological regulation(108个靶点, 98.18%)和response to stimulus(104个靶点, 94.55%)。CC富集主要涉及membrane(101个靶点, 91.82%)、organelle(88个靶点, 80.00%)和synapse(54个靶点, 49.09%)。MF富集主要涉及binding(107个靶点, 97.27%)、molecular transducer activity(59个靶点, 53.64%)和catalytic activity(48个靶点, 43.64%)。
由KEGG信号通路和GO功能富集分析结果即可预测延胡索及金铃子散镇痛的可能机制。
2.2.4 蛋白质-蛋白质相互作用网络
分别将延胡索和金铃子散镇痛的潜在靶点导入到STRING数据库,构建PPI网络,并使用Cytoscape3.9.1软件对该网络进行分析,结果如表4、图6所示。显然,SLC6A4、COMT、CNR1、PTGS2和TH等在延胡索和金铃子散的PPI网络中都占据着重要地位。

当两蛋白质间有相互作用时,以连线表示,连线越多,表明该蛋白质相互作用能力越强,Degree数值越高
2.2.5 “C-T-P”网络的构建
分别将获取的延胡索和金铃子散的所有数据导入Cytoscape3.9.1软件中,构建“C-T-P”网络,结果如表4和图7所示。在图7(a)中,共有166个节点,其中1个黄色节点代表延胡索,47个蓝色节点代表活性成分,103个红色节点代表交集靶点,15个绿色节点代表信号通路,且有1 409条边。在图7(b)中,共有182个节点,其中2个黄色节点代表川楝子和延胡索,55个蓝色节点代表活性成分,110个红色节点代表交集靶点,15个绿色节点代表信号通路,且有1 452条边。

节点越大,包围的边越密集,表明其Degree数值越高;绿色为信号通路;红色为靶点;蓝色为成分;黄色为药物

表4 PPI和“C-T-P”网络中排名较高的靶点基因与成分的数值
网络显示了节点与节点之间的联系,并以连线表示,即边。节点的相关度越高,节点的边收敛越集中,节点的Degree数值越大。同时,同一节点与不同节点间均有联系,体现了中药多成分,多基因相互作用的特点。根据表2中节点的Degree数值选出排名靠前的关键基因:Drd2、Drd4、Drd1、Adra1d和Adra2c,以及排名靠前的关键成分:四氢小檗碱(Canadine)、唐松草坡芬碱(Thaliporphine)、延胡索甲素(Corydaline)、延胡索碱(Capaurine)和延胡索乙素(Rotundine)。根据对网络的分析,延胡索和金铃子散中的多成分能够通过多靶点,作用于多途径,从而达到镇痛的目的。
2.3 分子对接
图8中,左侧为小分子配体与蛋白质PTGS2受体结合的3D效果图,右侧为配体与受体具体结合位点的2D效果图。
一般认为,小分子配体与蛋白质受体间亲和力越强,结合程度越高,LibDockScore越大,成分的潜在活性越强。根据PPI和“C-T-P”网络的分析结果,选择Degree数值较高的9个靶点:SLC6A4、COMT、CNR1、PTGS2、TH、DRD2、DRD4、DRD1和ADRA2C,以及5个活性成分:四氢小檗碱、唐松草坡芬碱、延胡索甲素、延胡索碱和延胡索乙素。对接结果以LibDock Score(对接分数)作为筛选标准进行分析,结果如表5和图8所示。结果表明,所选择的核心靶点与关键成分的对接分数均大于阈值90,显示出良好的结合活性,表明这5个关键成分在镇痛的过程中起着重要作用,这9个核心靶点为延胡索及金铃子散镇痛的潜在作用靶点。

表5 分子对接结果
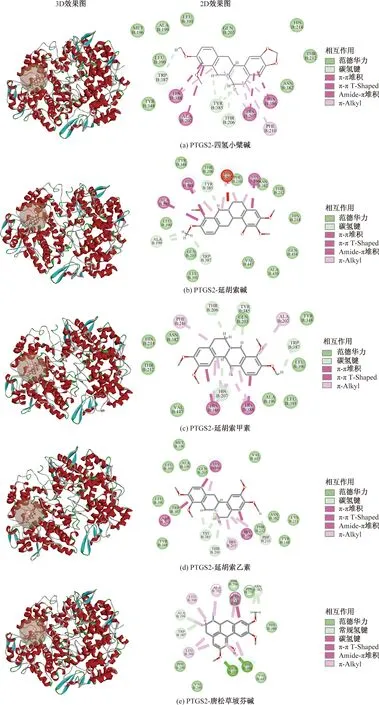
图8 部分分子对接结果
3 讨论
热板法和扭体法是筛选镇痛药的经典方法[19]。小鼠的足部受热板刺激而产生疼痛时,会发生舔舐后足(后足为身体重量支撑点)的特殊反应,以接触热板到舔舐后足所需的时间作为痛阈值,以此作为观测指标,比对药物的镇痛药效作用。当小鼠腹腔受化学药物刺激而产生疼痛时,表现为扭体反应(腹部收缩内凹,伸展后肢,臀部抬高,蠕行),以此作为指标,比对药物的镇痛药效作用。药效学结果显示,延胡索与金铃子散均能在一定时间内提高小鼠的痛阈值和减轻外部刺激给小鼠带来的痛感,表明两者均具有良好的镇痛效果。但相比延胡索,金铃子散的镇痛作用更持久。延胡索本身便为镇痛药,在与川楝子配伍组成金铃子散后,镇痛作用更好更持久,这与中医方剂配伍理论中协同增效相吻合。
活性成分和靶点基因一直是中医药现代化的重点问题。现有方法主要关注药物指标性成分及其潜在药理作用,而网络药理学研究由于与中药的多成分、多靶点、多途径的特点相契合,成为一种能够更有效识别中药活性化合物和靶点基因的方法[20-22]。以系统生物学理论为基础,通过对药物和疾病进行多平台、多软件、多途径的分析和探索,共获得47个延胡索活性成分和55个金铃子散活性成分以及103个延胡索潜在作用靶点和110个金铃子散潜在作用靶点,这些可能是延胡索和金铃子散镇痛过程中的可能信息。GO功能和KEGG信号通路富集分析结果显示,延胡索和金铃子散的交集靶点共同涉及细胞膜、细胞器、突触等,在分子水平上,交集靶点涉及结合,分子换能器活性,催化活性等,与神经活性配体受体相互作用、钙离子信号通路、5-羟色胺能突触等相关通路有关。通过对构建的“成分-靶点-通路”拓扑网络进行分析,关键活性成分四氢小檗碱、唐松草坡芬碱、延胡索甲素、延胡索碱和延胡索乙素,以及核心靶点SLC6A4、COMT、CNR1、PTGS2、TH、DRD2、DRD4、DRD1和ADRA2C在网络中占据着核心位置,推测为延胡索和金铃子散镇痛的关键成分和核心靶点。分子对接结果表明,5个关键成分与9个核心靶点间均存在非常强的对接能力,提示这5个关键成分可能为延胡索和金铃子散镇痛的药效物质,而这9个蛋白可能为延胡索和金铃子散的作用靶点。
通过网络药理学分析,推测延胡索和金铃子散中的四氢小檗碱、唐松草坡芬碱、延胡索甲素、延胡索碱和延胡索乙素可能通过与细胞膜及细胞器结合,调控SLC6A4、COMT、CNR1、PTGS2、TH、DRD2、DRD4、DRD1和ADRA2C的表达,作用于神经活性配体受体相互作用、钙离子信号通路、5-羟色胺能突触等相关通路,影响Ca2+释放,从而影响神经递质的合成与释放,达到镇痛的目的,并且这5个关键成分均归属于延胡索,而被大量报道的具有较强镇痛活性的川楝素[23-24]并没有被筛选出,说明网络药理学仍旧有较大的局限性,需要进一步完善。对延胡索和金铃子散的作用机制进行比对,发现药效物质,作用靶点及信号通路均没有明显差异,而药效物质均为臣药延胡索成分,作为君药的川楝子却没有关联度较高的成分,推测金铃子散中臣药延胡索的药效作用优于君药川楝子。
4 结论
延胡索与金铃子散均具有良好的镇痛作用,金铃子散的镇痛效果相比延胡索要更加持久;网络药理学结果表明,延胡索与金铃子散均能够通过多成分、多靶点、多通路达到镇痛的目的,且作用机制没有明显差异。但同时,由于网络药理学方法本身的局限性,作用机制预测结果与临床前实际研究结果可能存在一定的差异性,因此有待体内外实验进一步研究。

