山楂叶质量评价研究
段丽颖,任欠欠,杜义龙,李艳荣,赵胜男,潘海峰
(承德医学院,河北省中药研究与开发重点实验室,河北 承德 067000)
山楂叶为蔷薇科山楂属植物山里红Crataegus pinnatifidaBge.var.majorN.E.Br 或山楂Crataegus pinnatifidaBge.的干燥叶,具有活血化瘀、理气通脉、化浊降脂的功效,收录于2020 年版《中国药典》[1]中,常用于治疗冠心病、心绞痛等心脑血管疾病[2]。现代研究表明,山楂叶富含黄酮类、萜类、有机酸等化合物[3],其中总黄酮是其发挥抗动脉粥样硬化、降压降脂、增加冠脉血流量等作用的主要活性成分[4-5],并且在改善糖脂代谢紊乱、降低血糖血脂方面也发挥着重要作用[6-7],但对其降低血糖方面的研究尚不完善。
中药所含化学成分较为复杂,指纹图谱可反映其整体性[8],同时借助聚类热图能以更直观的方式展现数据疏密、样品地区差异的变化,并且通过化学计量学方法可进行全面质量评价[9]。因此,本实验以体外抑制α-淀粉酶、α-葡萄糖苷酶活性试验考察山楂叶降糖作用,同时建立不同产地样品UPLC 指纹图谱,并采用双变量相关分析、热图、聚类分析、主成分分析对该药材进行质量评价,以期为其产地区分及质量研究提供参考依据。
1 材料
1.1 仪器 Waters Acquity 超高效液相色谱仪(美国Waters 公司);Multiskan FC 酶标仪(美国Thermo Fisher Scientific 公司);JA5003 上皿天平(千分之一,天津天马衡基仪器有限公司);AG245电子分析天平(瑞士梅特勒-托利多公司);DHG-9070A 电热鼓风干燥箱(上海一恒科学仪器有限公司);HH-2 数显恒温水浴锅(常州荣华仪器制造有限公司);WIGGENS TM-1 涡旋振荡器(北京桑翌实验仪器研究所);HC-2062 高速离心机(科大创新股份有限公司中佳分公司);KQ-700 超声波清洗器(昆山市超声仪器有限公司);TCP-010-096洁特细胞培养板(广州洁特生物过滤股份有限公司);实验室PH 计[瑞士梅特勒-托利多仪器(上海)有限公司];FW100 高速万能粉碎机(天津市泰斯特仪器有限公司);MH-2 微型振荡器(海门市其林贝尔仪器制造有限公司)。
1.2 试剂与药物 α-淀粉酶(猪胰腺)(批号RM19Y304)、α-葡萄糖苷酶(批号RM20Y1225)、对硝基苯-β-D-吡喃半乳糖苷(PNPG,批号RM20Y807)(上海阿拉丁生化科技股份有限公司);阿卡波糖(批号113HO31,北京索莱宝科技有限公司);淀粉(批号RM1248-50KU,天津市光复精细化工研究所)。
绿原酸(批号18071907)、牡荆素葡萄糖苷(批号 20042305)、牡荆素鼠李糖苷(批号18060103)、牡荆素(批号16070601)、芦丁(批号18122901)、金丝桃苷(批号19103001)、异槲皮素(批号18062702)对照品均购自成都普菲得生物技术有限公司。甲醇、乙腈、四氢呋喃为色谱纯,均购自美国Thermo Fisher Scientific 公司;甲酸为分析纯;水为纯净水(批号JYSPYL2027,杭州娃哈哈集团有限公司)。
山楂叶共15 批,于2020 年11 月采自全国各地,经全国老中医药专家(传统鉴定)学术经验继承人孙宝惠主任药师鉴定为蔷薇科山楂属植物山里红Crataegus pinnatifidaBge.var.majorN.E.Br的干燥叶,均符合2020 年版《中国药典》 一部项下要求,具体见表1。

表1 样品信息Tab.1 Information of samples
2 方法与结果
2.1 UPLC 指纹图谱建立
2.1.1 溶液制备
2.1.1.1 供试品溶液 山楂叶经粉碎机粉碎后过80 目筛,取约1.0 g,精密称定,置于具塞三角瓶中,加入50 mL 60%甲醇,称定质量,密封,超声处理30 min 后静置15 min,60%甲醇补足减失的质量,12 000 r/min 离心10 min,取上层清液,0.22 μm 微孔滤膜过滤,取续滤液,即得(质量浓度约为20 mg/mL)。
2.1.1.2 对照品溶液 精密称取绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、牡荆素、芦丁、金丝桃苷、异槲皮素对照品适量,50%甲醇溶解,制成质量浓度分别为38.13、10.28、14.02、5.73、8.52、5.95、8.52 μg/mL 的溶液,即得。
2.1.2 色谱条件 ACQUITY UPLC HSS T3 C18色谱柱(2.1 mm×100 mm,1.8 μm);流动相水(含0.1%甲酸)(A)-(乙腈-四氢呋喃-甲酸)(120∶10∶0.1)(B),梯度洗脱(0~6 min,92%~89%A;6~10 min,89%~83% A;10~15 min,83%~83.5%A;15~18 min,83.5%~80%A;18~20 min,80%~66%A;20~22 min,66%~0A;22~24 min,0A);体积流量0.2 mL/min;柱温30 ℃;检测波长340 nm;进样量2 μL;样品室温度25 ℃。
2.1.3 方法学考察
2.1.3.1 精密度试验 取同一份供试品溶液(S2),在“2.1.2” 项色谱条件下进样测定6 次,测得各共有峰相对峰面积RSD 均小于3%,相对保留时间RSD 均小于1%,表明仪器精密度良好。
2.1.3.2 稳定性试验 取同一份供试品溶液(S2),于0、2、4、8、12、24 h 在“2.1.2” 项色谱条件下进样测定,测得各共有峰相对峰面积RSD 均小于3%,相对保留时间RSD 均小于1%,表明溶液在24 h 内稳定性良好。
2.1.3.3 重复性试验 取同一批药材(S2),按“2.1.1.1” 项下方法平行制备6 份供试品溶液,在“2.1.2” 项色谱条件下进样测定,测得各共有峰相对峰面积RSD 均小于3%,相对保留时间RSD均小于1%,表明该方法重复性良好。
2.1.4 图谱生成 取对照品、供试品溶液适量,在“2.1.2” 项色谱条件下进样测定,以S1 图谱为参照,设置时间窗宽度为0.2 min,多点校正后采用中位数法生成指纹图谱(图1),以稳定性较好的23 个色谱峰为共有峰。再采用“中药色谱指纹图谱相似度评价系统”(2004A 版)对15 批样品进行相似度评价,结果见表2。然后,通过对照品色谱图(图2)对共有峰进行指认,确定5、16、18、19、21、22、23 号色谱峰分别为绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、牡荆素、芦丁、金丝桃苷、异槲皮素。

图1 15 批样品UPLC 指纹图谱Fig.1 UPLC fingerprints for fifteen batches of samples
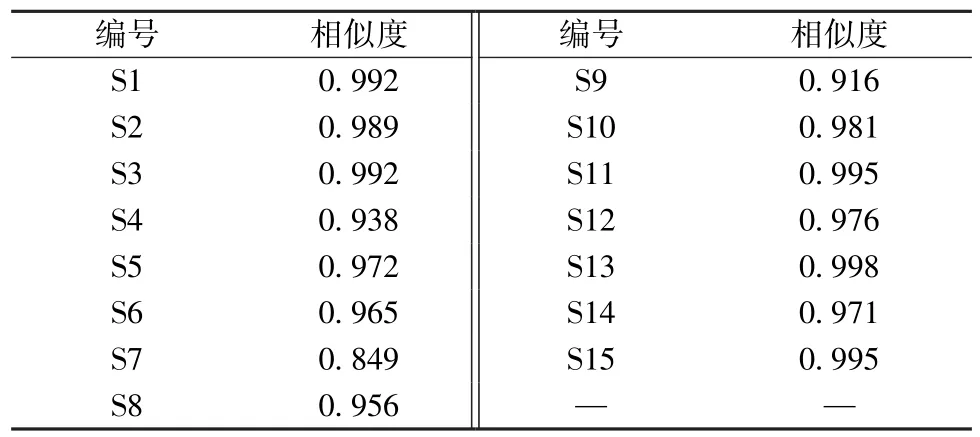
表2 15 批样品相似度Tab.2 Similarities of fifteen batches of samples

图2 对照品UPLC 色谱图Fig.2 UPLC chromatogram of reference substances
2.2 降糖活性研究 参考文献[10]报道,并对实验条件稍加调整。
2.2.1 溶液制备
2.2.1.1 样品溶液 取“2.1.1.1” 项下供试品溶液续滤液1 mL 至蒸发皿中,水浴蒸干后以等体积PBS 缓冲液(pH 6.8)复溶,即得(质量浓度约为20 mg/mL)。
2.2.1.2 阿卡波糖溶液 称取阿卡波糖(阳性药)适量,PBS 缓冲液溶解,得1 mg/mL 母液,PBS 缓冲液稀释成系列质量浓度,即得。
2.2.2 α-淀粉酶活性抑制实验 取20 μL 不同质量浓度样品溶液至1 mL 离心管中,再加入20 μL 0.35 U/mL α-淀粉酶溶液,涡旋5 s 并瞬时离心后在37 ℃下孵育15 min,加入20 μL 0.15%淀粉溶液,涡旋离心,在37 ℃下孵育15 min,加入80 μL DNS 溶液终止反应,煮沸5 min 后冰水浴冷却至室温,将离心管内的溶液转移至96 孔板中,酶标仪上于540 nm 波长处检测吸光度值,每个质量浓度平行3 份,作为样品组;以等体积PBS 缓冲液代替α-淀粉酶溶液,其他操作同上,作为样品对照组;以等体积PBS 缓冲液代替样品溶液,其他操作同上,作为对照组;以等体积PBS 缓冲液代替样品、α-淀粉酶溶液,其他操作同上,作为空白组;以等体积不同质量浓度阿卡波糖溶液代替样品溶液,其他操作同上,作为阳性对照组,计算抑制率,公式为抑制率(%)={[(对照组吸光度-空白组吸光度)-(样品组吸光度- 样品对照组吸光度)]/(对照组吸光度- 空白组吸光度)} × 100%,再将数据导入SPSS 21.0 软件计算IC50值,结果见表3。

表3 α-淀粉酶双变量相关分析、色谱峰筛选、IC50值、主成分评分Tab.3 Bivariate correlation analysis,chromatographic peak screening,IC50 values and principal component scores for αpancreatic amylase
2.2.3 α-葡萄糖苷酶活性抑制试验 在96 孔板中加入60 μL PBS 溶液,再加入20 μL 不同质量浓度样品溶液、20 μL 0.5 U/mL α-葡萄糖苷酶,振荡混匀,37 ℃孵育15 min;加入20 μL 2.5 mmol/L PNPG 继续孵育15 min,加入80 μL 0.2 mol/L 碳酸钠终止反应,酶标仪上于405 nm 波长处测定吸光度值,每个质量浓度平行3 份,作为样品组;以等体积PBS 缓冲液代替α-葡萄糖苷酶溶液,作为样品对照组;以等体积PBS 缓冲液代替样品、α-葡萄糖苷酶溶液,作为空白组;其余同“2.2.2”项分组,按“2.2.2” 项下公式计算抑制率及IC50值,结果见表4。

表4 α-葡萄糖苷酶双变量相关分析、色谱峰筛选、IC50值、主成分评分Tab.4 Bivariate correlation analysis,chromatographic peak screening,IC50 values and principal component scores for α-glucosidase
2.2.4 结果分析 由表3~4 可知,样品对α-淀粉酶有一定抑制作用,但弱于阿卡波糖,而在抑制α-葡萄糖苷酶活性方面与阿卡波糖相当,甚至更优;对2 种酶活性的抑制效果与产地呈现一定相关性,其中河北、辽宁产样品优于山东、山西产样品。
2.3 统计分析
2.3.1 双变量相关分析 以23 个共有峰峰面积及α-淀粉酶、α-葡萄糖苷酶的IC50值为原始数据,导入SPSS 21.0 软件中进行双变量相关分析,分别筛选出与抑制α-淀粉酶活性显著相关(P<0.05),并符合KMO 检验(KMO>0.5)、Bartlett 球形检验(P<0.05)的13 个色谱峰,作为α-淀粉酶组;与抑制α-葡萄糖苷酶活性显著相关,并符合相关检验标准的14 个色谱峰,作为α-葡萄糖苷酶组,结果见表3~4。
2.3.2 热图绘制 将色谱峰峰面积导入MetaboAnalyst 5.0 平台(https:/ /www.metaboanalyst.ca/),选择“Statistical Analysis” 模块,对数据进行筛选、归一化等操作,输出热图,结果见图3。由此可知,2 个热图结果具有相似性,并呈现一定聚类特征,整体上可分为3 类,河北、辽宁产样品在成分含量上相似性较高,可聚为一类;山西、山东产样品与河北、辽宁产样品在成分含量上具有较大差异,分别聚为一类。
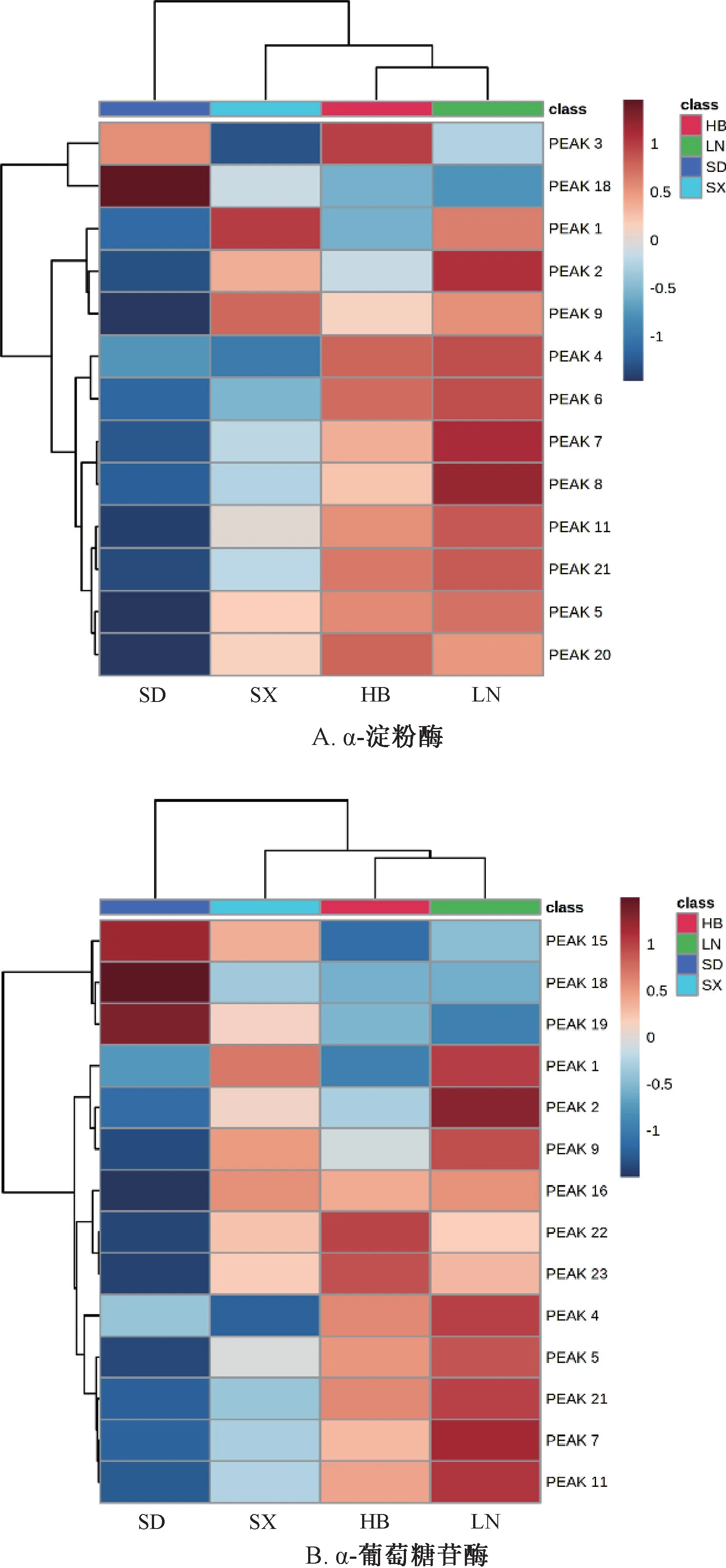
图3 样品热图Fig.3 Heat maps of samples
2.3.3 主成分分析 采用SPSS 21.0 软件对色谱峰进行KMO 检验、Bartlett 球形检验,其中α-淀粉酶、α-葡萄糖苷酶KMO 度量值分别为0.789、0.642,Bartlett 球形检验P值均小于0.001,提示各变量间存在显著相关性,可进行主成分分析。按照对应特征值>1 的原则提取主成分,α-淀粉酶提取1 个主成分,累积方差贡献率达85.886%;α-葡萄糖苷酶提取2 个主成分,第一主成分特征值为10.549,贡献率为75.353%,而第二主成分特征值为1.657,贡献率为11.834%,累积方差贡献率达87.187%。结合初始因子载荷矩阵(表5)及公式Fi=A×ZX(A为特征向量矩阵,ZX 为标准化数据矩阵)计算主成分得分,再结合各成分贡献率建立评分模型,分别为Fα-淀粉酶组=0.859 ×F1、Fα-葡萄糖苷酶组=0.753×F1+0.118×F2,并进行排序,结果见表3~4。由此可知,2 种酶主成分评分排序一致,均以河北、辽宁产样品较高,排名靠前;山东、山西产样品较低,排名靠后。

表5 初始因子载荷矩阵Tab.5 Loading matrices for initial factors
3 讨论
本实验对流动相组成进行考察,主要关注有机相乙腈,因其分离度不好,故加入不同比例的四氢呋喃以使分离度得到改善,同时峰形不理想,故又加入一定比例的甲酸得以改善。最终确定,最优流动相为水(含0.1%甲酸)-[乙腈-四氢呋喃-甲酸(120∶10∶0.1)],此时各成分分离效果最好,并且可改善前期由于流动相混合不充分导致的色谱峰前延问题。
由表3~4 可知,山楂叶对α-葡萄糖苷酶活性的抑制作用显著优于α-淀粉酶,峰1、2、4、5(绿原酸)、7、9、11、18(牡荆素鼠李糖苷)、21(芦丁)与抑制α-淀粉酶、α-葡萄糖苷酶活性均具有显著相关性,并且α-葡萄糖苷酶相关性系数普遍高于α-淀粉酶。另外,5 号峰(绿原酸)、16 号峰(牡荆素葡萄糖苷)、18 号峰(牡荆素鼠李糖苷)、19 号峰(牡荆素)、21 号峰(芦丁)、22 号峰(金丝桃苷)、23 号峰(异槲皮素)与抑制α-葡萄糖苷酶活性均显著相关,并且大多存在单糖、寡糖结构,具有α-葡萄糖苷酶抑制剂化学结构特征[11-12],可能是山楂叶抑制α-葡萄糖苷酶活性优于α-淀粉酶的原因。
河北、辽宁产山楂叶对α-淀粉酶、α-葡萄糖苷酶活性的抑制效果略高于山东、山西产,其原因可能与经纬度有关。本实验中15 批样品采收于河北承德、辽宁葫芦岛、山东临沂、山西运城,其中河北承德样品采自北纬40°29′57″、东经117°26′38″;辽宁葫芦岛样品与其接近,为北纬40°37′10″、东经119°40′22″;山东临沂、山西运城样品经纬度相近,分别为北纬35°27′2″、东经117°59′10″及北纬35°20′58″、东经111°10′38″。体外降糖实验结果显示,山楂叶分组趋势与纬度信息有较高的相关性,并且其产地的海拔、日照时间、气温、降水量等因素可能会影响黄酮含量,进而影响体外降糖试验结果。
4 结论
本实验根据山楂叶对α-淀粉酶、α-葡萄糖苷酶活性的抑制作用及其UPLC 指纹图谱的共有峰数据进行双变量相关分析,采用主成分分析进行综合评分,发现所得结果与体外降糖实验结果相互印证,表明该方法科学可靠,可用于山楂叶产地区分、体外降糖效果评价,也能为今后全面评价该药材质量提供数据支持及方法参考。

