灭瘢膏减少瘢痕形成的作用及其机制研究
王浩南,吴雨蒙,张 喆,梁梦梦,刘 谦,,张永清*
(1.山东中医药大学药学院,山东 济南 250355; 2.山东沃华医药科技股份有限公司博士后流动站,山东潍坊 261000)
丹参属于大宗常用中药材,为唇形科植物丹参Salvia miltiorrhizaBge.的干燥根与根茎[1],首载于《神农本草经》。现代研究发现,丹参含有丹参酮类、丹酚酸类等活性成分,具有抑菌[2]、抗炎[3]、抑制新生血管[4-5]、抗血栓、抗心肌缺血再灌注损伤、抗癌等药理作用[6-9]。皮肤创伤在临床上极为常见,后期愈合过程中极易形成瘢痕,影响美观,导致患者产生“挥之不去的阴影,难以言表的忧伤”,关节处瘢痕组织甚至会丧失部分功能,严重影响生活质量。皮肤创伤愈合分为止血、炎症、愈合、重塑4 个时期[10-11]。研究显示,丹参及其制剂具有加快创面愈合、降低感染率、减轻水肿、减少瘢痕形成等作用[12-13]。课题组发掘了一个以丹参为主要原料用于消除皮肤创伤瘢痕的民间验方,并在工艺研究的基础上研制成灭瘢膏。本研究对灭瘢膏的活性成分进行了检测,并通过动物与细胞实验对其减少瘢痕残留的作用及机制进行研究,旨在为新产品研制和丹参资源充分利用提供参考。
1 材料
1.1 仪器 Waters e2695 高效液相色谱(美国Waters 公司);Spectra Max M2 酶标仪[美谷分子仪器(上海)有限公司];Scientz-24 高通量组织研磨器(宁波新芝生物科技股份有限公司);IX71 生物倒置荧光显微镜(日本Olympus公司)。
1.2 试剂与药物 丹参饮片原植物由山东中医药大学药用植物园种植,2019 年11 月采收后去除泥土,切片,晒干,经山东中医药大学张永清教授鉴定为唇形科植物丹参Salvia miltiorrhizaBge.。蒸馏水、超纯水(实验室自制);0.9%生理盐水(辰欣药业股份有限公司);甲醇、乙醇(天津富宇精细化工有限公司)。羊脂(泰安明睿建设工程有限公司);白凡士林(南昌白云药业有限公司);二甲基亚砜(DMSO,国药集团化学试剂有限公司);丹参素、二氢丹参酮、隐丹参酮、丹参酮ⅡA对照品(上海源叶生物科技有限公司);甘油醛-3-磷酸脱氢酶(GAPDH)抗体、I 型胶原蛋白(Col1)、转化生长因子β1(TGF-β1)抗体(英国 Abcam 公司);TGF-β3抗体(美国ImmunoWay 公司);总蛋白(BCA 法)测定试剂盒、VEGF-A、EGF ELISA 试剂盒(南京建成生物工程研究所);人源VEGF、EGF ELISA 试剂盒(杭州联科生物技术股份有限公司)。
2 方法
2.1 药物制备
2.1.1 羊脂 取纯净羊脂置于锅中,2 000 W 加热23 min,放凉后4 ℃保存备用。
2.1.2 灭瘢膏 取羊脂400 g 置于锅中,2 000 W 加热20 min,丹参饮片160 g 用蒸馏水湿润搅拌均匀后加入进行煎炸(1 600 W,3 min),炸至丹参饮片外圈发黑、体积缩小,中心发黄后停止加热,过滤,去渣,羊脂部分放冷4 ℃保存备用。
2.1.3 丹参酮软膏 按照110 mg 隐丹参酮、105 mg 丹参酮ⅡA与50 g 白凡士林60 ℃混匀,冷却,4 ℃冷藏备用。
2.2 灭瘢膏活性成分提取与含量测定 取1 g 灭瘢膏分别用20 倍量蒸馏水、80% 乙醇,40 ℃超声提取2 h,放冷,溶剂与油层分离后收集溶剂层,通风橱放置挥干,加20 mL甲醇溶解,0.22 μm 微孔滤膜过滤,-20 ℃冷藏备用供HPLC 分析。
色谱条件为ZORBAX Eclipse XDB-C18色谱柱(4.6 nm×250 nm,5 μm);流动相0.01% 磷酸水溶液(A)-乙腈(B),梯度洗脱;柱温30 ℃;进样量10 μL;丹酚酸类检测波长286 nm,丹参酮类检测波长270 nm。
2.3 动物实验
2.3.1 实验动物 SPF 级SD 雄性大鼠,4 周龄,体质量(180±20)g,购自北京维通利华实验动物技术有限公司,实验动物生产许可证号SCXK(京)2019-0008,SPF 环境单只单笼饲养,适应性饲养7 d 后开始实验。
2.3.2 分组、造模及给药 60 只大鼠随机分为对照组、丹参酮软膏组、灭瘢膏组、羊脂组,每组15 只,用乙醚麻醉,剃净背部毛发,手术剪裁去背部脊椎两侧对称的2 个1.0 cm×1.0 cm 面积皮肤,深入皮下,消毒,即造模完成,造模与取材位置见图1 缺口部分。对照组只用绷带包扎;羊脂组、灭瘢膏组、丹参酮软膏组涂抹相应药物后绷带包扎,造模第1 天开始给药,每天1 次,每次1 g。

图1 大鼠造模及取材位置示意图
2.3.3 创伤愈合率测定 采用透明膜描记称重法测定伤口面积,给药第0、3、7、11、15 天,用透明膜描记创面大小,以此为模板,将质地均匀的硬纸片剪成同样大小,称定硬纸片质量,硬纸片质量表示创面面积大小,计算创伤愈合率,公式为创伤愈合率=(第0 天创伤面积-第N 天创伤面积)/第0 天创伤面积×100%。
2.3.4 样品处理与总蛋白、生长因子测定 给药7 d 后选取7 只大鼠,处死取左右两侧愈伤组织(均为大鼠背部两侧造模位置的愈伤组织)标记为A 组,经液氮速冻后于-80 ℃保存;给药15 后处死剩余8 只大鼠,取左右两侧愈伤组织标记为B 组,经液氮速冻后于-80 ℃保存。B 组左侧愈伤组织进行Masson、天狼猩红染色,使用Image J 软件(IHC Tool Box 插件)计算胶原纤维染色面积比例;取A、B 两组右侧愈伤组织(0.1±0.01)g,加生理盐水制成10%组织匀浆液,4 ℃、6 000 r/min 离心10 min,取上清液用蛋白定量测定试剂盒、VEGF-A 及EGF ELISA 试剂盒测定总蛋白及EGF、VEGF-A 水平,其中各生长因子水平=各生长因子含量/各样品总蛋白水平。
2.4 细胞实验
2.4.1 细胞来源及培养 人皮肤成纤维细胞(HFF-1)、人脐静脉内皮细胞(EA.hy926)购自中国科学院细胞库;人永生化角质形成细胞(HaCaT)购自北京北纳创联生物技术研究院。EA.hy926、HaCaT 细胞使用含10% 胎牛血清、100 U/mL 双抗的DMEM 培养基;HFF-1 细胞使用HFF-1 完全培养液,于5% CO2、37 ℃、相对饱和湿度95%条件下松盖培养,每天换液1 次,细胞长至80%时消化传代,取第3~8 代后对数期细胞用于实验。
2.4.2 MTT 法检测细胞增殖活性 EA.hy926、HaCaT、HFF-1 细胞调整密度至4×104/mL,接种于96 孔板,每孔100 μL,孵育过夜。细胞分为对照组(0 μmol/L)和给药组(1、2、4、8、16、32 μmol/L,1 μmol/L 药物为1 μmol隐丹参酮+1 μmol 丹参酮ⅡA混合溶于1 L 的DMSO),另设空白组(无细胞),给药培养48 h 后,每孔加入10 μL 5 mg/mL MTT,继续孵育5 h,于酶标仪595 nm 波长处测定吸光度值,计算细胞增殖抑制率。
2.4.3 划痕实验 HaCaT 细胞以无血清培养基培养,给药浓度为0 μmol/L(0%抑制浓度,丹参酮ⅡA+隐丹参酮混合物)、1 μmol/L(20% 抑制浓度)、3 μmol/L(50% 抑制浓度),12 h后用10 μL 枪头在细胞板上划痕,0、16、32、48 h于倒置显微镜下观察各给药浓度HaCaT 细胞迁移率。
2.4.4 细胞生长因子检测 取HFF-1、HaCaT、EA.hy926细胞混悬液,用0%、20%、50%抑制率浓度给药处理48 h,收集细胞,按照EGF、VEGF-A ELISA 试剂盒说明书检测EGF、VEGF 水平。
2.4.5 Western blot 法检测愈伤组织和细胞TGF-β1、TGFβ3、Col1 蛋白表达 分别取愈伤组织样本和细胞样本,加150 μL 裂解液超声1 min 后于0 ℃裂解45、30 min,4 ℃、12 000 r/mim 离心15 min 后吸取上清液,用BCA 试剂盒测定蛋白浓度,在10% SDS-PAGE 凝胶电泳中分离蛋白质,转到PVDF 膜上,室温封闭1 h,加一抗TGF-β1(1∶500)、TGF-β3(1∶500)、Col1(1∶500)、GAPDH(1∶5 000)4 ℃孵育过夜,洗膜3 次后加过氧化物酶标记山羊抗鼠IgG 二抗,室温孵育40 min,洗膜3 次后加免疫增强化学发光剂(ECL),显影,曝光,保存条带图进行分析,GAPDH 为内参蛋白。
2.5 统计学分析 通过SPSS 23.0 软件进行处理,计量资料以(±s)表示,多组间比较采用单因素方差分析,两两比较采用t检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 灭瘢膏中活性成分 灭瘢膏水、醇提取物经HPLC 分析,结果见图2~3,灭瘢膏水提取物只含丹参素,含量为0.565 9 mg/g;乙醇提取物中主要含有隐丹参酮、丹参酮ⅡA、二氢丹参酮,含量分别为2.196、2.111、0.346 mg/g,隐丹参酮、丹参酮ⅡA是灭瘢膏中的主要成分。

图2 灭瘢膏水提取物HPLC 色谱图
3.2 灭瘢膏对大鼠愈伤组织切片Masson、天狼猩红染色的影响 如图4、表1 所示,与对照组、羊脂组比较,灭瘢膏组和丹参酮软膏组大鼠愈伤组织肌红纤维水平增加,胶原纤维水平降低(P<0.01),说明灭瘢膏组和丹参酮软膏组均具有降低瘢痕形成的作用,灭瘢膏中有效成分为丹参酮类成分。如图5、表1 所示,灭瘢膏和丹参酮软膏能增加I 型胶原水平(P<0.01),说明隐丹参酮、丹参酮ⅡA具有分解胶原纤维或抑制I 型胶原合成胶原纤维的作用。
表1 各组Masson、天狼猩红染色结果比较(%,±s,n=8)

表1 各组Masson、天狼猩红染色结果比较(%,±s,n=8)
注:与对照组比较,**P<0.01;与羊脂组比较,## P<0.01。

图3 各成分HPLC 色谱图

图4 各组Masson 染色(×400)

图5 各组天狼猩红染色(×400)
3.3 灭瘢膏对大鼠伤口愈合率的影响 第3、7 天时,与对照组比较,灭瘢膏组和丹参酮软膏组创面愈合率均增加(P<0.01);第15 天时,所有大鼠伤口均愈合,接近闭合,说明丹参酮类成分在减少疤痕形成的基础上不会延缓创面愈合速率,同时在第3、7 天,丹参酮具有促进创面愈合的作用,见表2。
表2 各组大鼠创面愈合率比较(%,±s, n=8)

表2 各组大鼠创面愈合率比较(%,±s, n=8)
注:与对照组比较,*P<0.05,**P<0.01;与羊脂组比较,##P<0.01。
3.4 灭瘢膏对大鼠愈伤组织VEGF-A、EGF 水平的影响表3 显示,第7 天,与对照组比较,灭瘢膏组和丹参酮软膏组大鼠愈伤组织VEGF-A 水平降低(P<0.05),EGF 水平无明显变化(P>0.05);第15 天,与对照组比较,灭瘢膏组和丹参酮软膏组大鼠愈伤组织VEGF-A、EGF 水平均升高(P<0.05),前期抑制血管生成与促进表皮细胞的增殖,说明丹参酮能够促进愈伤组织正常的增殖发育,同时抑制毛细血管的过度增殖,减少瘢痕相关蛋白的沉积。
表3 各组大鼠愈伤组织VEGF-A、EGF 水平比较(±s, n=7)

表3 各组大鼠愈伤组织VEGF-A、EGF 水平比较(±s, n=7)
注:与对照组比较,*P<0.05;与羊脂组比较,#P<0.05。
3.5 隐丹参酮、丹参酮ⅡA混合物对HFF-1、HaCaT、EA.hy926 细胞增殖活性的影响 隐丹参酮、丹参酮ⅡA混合物对HFF-1、HaCaT、EA.hy926 细胞活性均具有抑制作用(P<0.01),可避免愈伤组织的过度增殖导致顽固性瘢痕形成,见图6。隐丹参酮、丹参酮ⅡA混合物48 h 的IC50为HFF-1 细胞29.705 μmol/L,HaCaT 细胞2.904 μmol/L,EA.hy926 细胞11.171 μmol/L。

图6 各组HFF-1、HaCaT、EA.hy926 细胞增殖抑制率(±s, n=3)
3.6 隐丹参酮、丹参酮ⅡA混合物对HaCaT 细胞迁移率的影响 与0 μmol/L 组比较,隐丹参酮、丹参酮ⅡA混合物1、3 μmol/L 组16、32 h 空白面积增大(P<0.01),即细胞迁移率降低;48 h 各组细胞均填充满原先划痕位置,划痕面积为0,见图7、表4。说明隐丹参酮、丹参酮ⅡA混合物处理后再上皮化速率的降低,HaCaT 细胞上皮-间充质化(EMT)水平下调,避免角质层过早形成、增厚、堆叠,减少角蛋白、胶原纤维过度积累,在不影响创面愈合的前提,抑制肥厚性瘢痕组织的形成。
表4 各组HaCaT 细胞划痕实验空白面积比较(±s, n=3)

表4 各组HaCaT 细胞划痕实验空白面积比较(±s, n=3)
注:与0 μmol/L 组比较,*P<0.05。

图7 细胞划痕实验结果
3.7 隐丹参酮、丹参酮ⅡA混合物对3 种细胞生长因子分泌的影响 3 种细胞经0、20%、50%抑制浓度的隐丹参酮、丹参酮ⅡA 化合物处理后。隐丹参酮、丹参酮ⅡA混合物各浓度组剂量依赖性地升高HFF-1 细胞中VEGF-A、EGF水平(P<0.05,P<0.01),HaCaT 细胞中VEGF-A 水平(P<0.01),及EA.hy926 细胞VEGF-A 水平(P<0.01),并降低EA.hy926 细胞EGF 水平(P<0.01),见图8。
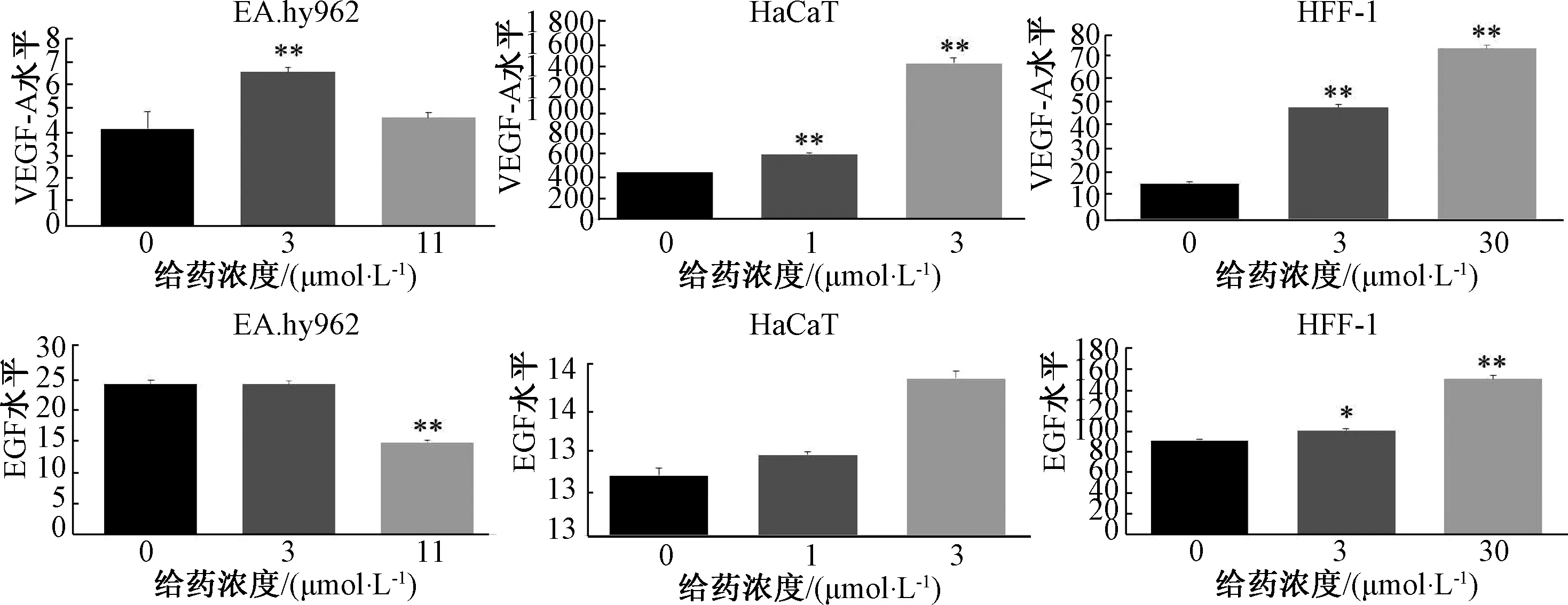
图8 3 种细胞VEGF-A、EGF 水平(±s, n=3)
3.8 各组愈伤组织、细胞中TGF-β1、TGF-β3、Col1 蛋白表达比较 如图9A~9B 所示,与对照组比较,羊脂组、丹参酮软膏组、灭瘢膏组TGF-β1、TGF-β3蛋白表达均降低(P<0.01),说明以羊脂为基质能够促进隐丹参酮、丹参酮ⅡA混合物的释放吸收,促进混合物对TGF-β1、TGF-β3表达的抑制作用。如图9C~9D 所示,与0 μmol/L 组比较,隐丹参酮、丹参酮ⅡA混合物各浓度组HFF-1 细胞Col1 蛋白表达均降低(P<0.01),说明其具有抑制人皮肤成纤维细胞Col1 的活性。

图9 各组愈伤组织、细胞中TGF-β1、TGF-β3、Col1 蛋白表达(±s, n=3)
4 讨论
灭瘢膏是一种效果显著且使用历史悠久的民间验方,HPLC 分析发现其中含有的主要活性成分为隐丹参酮、丹参酮ⅡA。前期实验结果证明,丹参酮ⅡA与隐丹参酮对HFF-1 细胞活性具有抑制作用,且以丹参酮ⅡA的IC50最低,但两者IC50均高于丹参酮混合物,故使用隐丹参酮与丹参酮ⅡA设计药理实验,结果证明隐丹参酮与丹参酮ⅡA混合物为灭瘢膏中发挥药理作用的主要活性成分。
瘢痕组织形成是愈伤组织过度增殖、胶原纤维和细胞外基质(ECM)过度积累导致的。胶原纤维由胶原蛋白及甘氨酸、脯氨酸、羟脯氨酸等构成。胶原蛋白肽链中关键前肽缺失、Col1 无法重新螺旋生成胶原都会影响胶原纤维合成[14-15]。通过病理染色和蛋白印迹实验发现,丹参酮混合物可抑制Col1、胶原纤维的合成,并分解胶原纤维生成胶原蛋白以减少胶原纤维在愈伤组织中的沉积。
系统性皮肤硬化病、瘢痕组织增生过程中αvβ3、5 激活TGF-βmRNA 使TGF-β 表达增加[16],TGF-β1mRNA 及其蛋白表达异常增高是正常皮肤向瘢痕组织转化的标志[17];丹参酮混合物可抑制愈伤组织中TGF-β 的分泌,进而降低TGF-β/Smad 通路中p-Smad2、p-Smad3 水平[18],从而降低TGF-β1对成纤维细胞的增殖促进作用。
药物载体将创面密封降低氧量,愈伤组织受缺氧诱导因子(HIF-1α)的分泌提升促进VEGF-A 编码基因的表达从而促进创面中VEGF-A 水平的提升[19-20]。灭瘢膏、丹参酮软膏处理后生长因子VEGF-A 水平在前期显著降低并在给药后期显著提升,可能在前7 d 时,丹参酮通过影响HIF-1α 亚基与其辅助活化因子CBP/p300 的活化,HIF-1α、HIF-1β 的异源二聚后与缺氧反应原(HRE)、VEGF-AR2受体结合水平降低有关[21],前期较低的VEGF-A 水平能够抑制愈伤组织中毛细血管的生成,从而避免愈伤组织的过度增殖而形成瘢痕组织。
本实验明确了灭瘢膏的主要活性成分为隐丹参酮、丹参酮ⅡA,通过动物和细胞实验证实了隐丹参酮、丹参酮ⅡA减少瘢痕组织形成的药理作用,初步阐明了灭瘢膏在伤口愈合时期抑制愈伤组织过度增殖,减少因胶原纤维过度沉积引起的瘢痕形成的机制,为新产品研制和丹参植物资源的开发利用提供了参考。

