茯苓酸对结肠癌细胞增殖凋亡、迁移侵袭及PERK/ATF4信号通路蛋白表达的影响
刘婉,晋颖,冯晓洁,汪湃
北京市和平里医院消化肿瘤科,北京 100013
结肠癌是常见的消化道恶性肿瘤之一,是全球癌症死亡相关的主要原因之一。结肠癌的发生与饮食、遗传等因素有关,但其具体发病机制并未明确[1]。目前临床常用的手术切除术、化学疗法和免疫疗法等治疗方法对转移性结肠癌的疗效不理想[2]。因此,研究结肠癌的发病机制及有效治疗方法仍然是目前的研究热点。蛋白激酶RNA样内质网(ER)激酶(Protein kinase RNA-like ER kinase,PERK)是启动内质网未折叠蛋白反应(Unfolded protein reaction,UPR)的主要因子之一[3],PERK的激活使真核起始因子 2α(Eukaryotic initiation factor 2α,eIF2α)的磷酸化水平升高,导致转录激活因子4(Activating transcription factor-4,ATF4)入核活化[4]。促进PERK/ATF4通路蛋白表达,能抑制结肠癌细胞的增殖、促进细胞凋亡[5]。茯苓酸(Poria acid,PA)是从真菌茯苓中分离出来的一种三萜类化合物,具有抗炎、抗菌、抗病毒以及镇静等多种药理作用[6]。PA能够激活ER应激,促进细胞凋亡来抑制胰腺癌的发展[7-8]。但PA对结肠癌细胞的作用及其机制相关研究报道较少。2022年5—10月,我们观察了PA对结肠癌细胞增殖凋亡、迁移侵袭及PERK/ATF4信号通路表达的影响,现报告如下。
1 材料与方法
1.1 细胞、试剂及仪器 人结肠癌细胞系SW480、SW480细胞完全培养基(SNL-074、SNLM-074,中国尚恩生物);SW480用完全培养基置于37 ℃、5% CO2培养箱中培养,接下来每3~4天按照1∶3传代,传至第4代。PA(PCS0393,成都植标化纯);PERK激活剂 CCT020312、PERK 抑 制 剂 GSK2656157(HY-119240、HY-13820,Med Chem Express公司);MTT细胞增殖检测试剂盒(E606334,生工生物工程);Annexin V-FITC/PI荧光双染细胞凋亡检测试剂盒(PCA-201,武汉普诺赛);PERK、p-PERK、ATF4、内质网应激相关蛋白C/EBP同源蛋白(CHOP)、E-钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)一抗(ab229912、ab192591、ab184909、ab11419、ab231303、ab92547,英国Abcam);羊抗兔IgG H&L、羊抗小鼠IgG H&L(ab6795、ab6808,英 国 Abcam);流 式 细 胞 仪(BD LSR Ⅱ,美国BD);倒置显微镜(XSP-17C,上海光密仪器);iBright凝胶成像仪(CL750,赛默飞世尔科技)。
1.2 PA的受试剂量筛选 采用MTT法。将第4代SW480细胞以5×103/孔接种至96孔板中,分为7组,每组5个复孔。待细胞汇合度到80%时,分别加入0、1、2、4、8、16、32 μmol/L的PA培养24 h,每孔加入MTT继续培养4 h。弃上清液,每孔加入100 μL的DMSO。用酶标仪测算每孔在490 nm处的光密度OD值,并计算细胞的存活率及半数抑制浓度(IC50)。细胞存活率(%)=(实验组光密度OD值/对照组光密度值)×100%。加入 0、1、2、4、8、16、32 μmol/L PA的SW480细胞存活率分别为100.00% ± 0.45%、98.16% ± 1.80%、75.64% ±2.34%、64.98% ± 2.11%、50.97% ± 1.24%、35.17% ± 0.92%、23.06% ± 1.04%。加入PA培养24 h时SW480细胞的IC50为8.393 μmol/L 因此,后续研究选择8 μmol/L为PA的受试剂量。
1.3 SW480细胞分组及PA给予方法 将SW480细胞分为四组,每组6个复孔。PA组加入8 μmol/L的PA[9],PA + PERK 抑制剂组加入 8 μmol/L 的 PA +2 μmol/L 的 GSK2656157[10], PERK 激活剂组加入8 μmol/L的 CCT020312[11],对照组用正常培养基培养。1.4 各组细胞增殖情况观察 ①培养24 h时采用MTT法测算各组细胞存活率,方法同“1.2”,重复测算3次,取平均值。②取各组细胞,用含有10% FBS的培养基培养15 d。吸除培养液,4%聚甲醛固定细胞10 min,结晶紫染色20 min,PBS洗涤细胞并干燥。显微镜下对细胞克隆数进行计数。重复计算3次,取平均值。
1.5 各组细胞凋亡情况观察 采用流式细胞仪术。培养24 h时取各组细胞,重悬后300 g离心5 min,PBS洗涤细胞后,加入 500 μL稀释的1×Annexin V Binding Buffer工作液重悬细胞,加入5 μL的Annexin V-FITC和5 μL的PI染色液混匀,室温避光孵育20 min。用FACS-LSR Ⅱ流式细胞仪测算各组细胞凋亡率。重复测算3次,取平均值。
1.6 各组细胞侵袭、迁移能力观察 采用Transwell小室。取各组细胞接种至Transwell上室,加入无血清培养基,培养24 h。将迁移至上室膜外侧的细胞用甲醇固定30 min,然后结晶紫染色15 min。倒置显微镜下每组随机选择6个视野观察。侵袭实验将基质胶(Matrigel)按1∶8用无血清培养基稀释,并加入到上室中,其余步骤与迁移实验相同。使用ImageJ软件计算各组迁移、侵袭细胞数。均重复测算3次,取平均值。
1.7 各组细胞PERK/ATF4通路相关蛋白、内质网应激相关蛋白、EMT相关蛋白检测 采用WESTERN Blotting法检测各组细胞通路相关蛋白(PERK、p-PERK、ATF4)、内质网应激相关蛋白CHOP、EMT相关蛋白(E-cadherin、Vimentin)。培养24 h时取各组细胞,提取总蛋白,通过SDS-PAGE凝胶电泳分离目的蛋白,并转至PVDF膜上。接着将PVDF膜用5%的脱脂牛奶室温振荡孵育2 h,TBST洗膜,加入一抗稀释液(PERK、p-PERK、ATF4、CHOP、E-cadherin、Vimentin抗体稀释倍数1:1 000),4 ℃孵育过夜,再加入羊抗兔或羊抗鼠二抗稀释液(稀释倍数1:1 000),室温振荡孵育2 h,最后加入ECL试剂避光显色,通过凝胶成像仪观察蛋白条带。以β-actin为内参蛋白,采用Gel-Pro analyzer4软件测算目的蛋白的相对表达量。重复测算3次取平均值。
1.8 统计学方法 利用GraphPad Prism 6.0统计软件进行数据处理。P-P图检验数据的正态性,正态分布的计量资料以-表示,SNK-q检验比较两两之间的差异,单因素方差分析比较多组间差异。P<0.05为差异具有统计学意义。
2 结果
2.1 各组细胞存活率及细胞克隆数比较 培养24 h时PA + GSK组、PA组、CCT组及对照组细胞存活率分别为 87.16% ± 1.80%、45.37% ± 2.11%、42.64% ± 1.63%、100.00% ± 1.54%,细胞克隆数分别为(139.47 ± 2.39)、(70.68 ± 2.08)、(116.74 ±2.26)、(67.84 ± 1.89)、(158.36 ± 2.48)个。与对照组比较,PA组和CCT组细胞存活率、克隆形成数低(P均<0.05);与PA组比较,PA + GSK组细胞存活率和克隆形成数高(P均<0.05)。
2.2 各组细胞凋亡率比较 培养24 h时PA + GSK组、PA组、CCT组及对照组细胞凋亡率分别为20.76% ± 1.31%、53.17% ± 1.46%、54.96% ±2.07%、15.67% ± 1.24%。与对照组比较,培养24 h时PA组和CCT组细胞凋亡率高(P均<0.05);与PA组比较,培养24 h时PA + GSK组细胞凋亡率低(P<0.05)。
2.3 各组迁移细胞数、侵袭细胞数比较 PA +GSK组、PA组、CCT组及对照组细胞迁移细胞数分别为(196.73 ± 3.26)、(140.31 ± 2.18)、(136.47 ±2.21)、(210.76 ± 3.57)个,侵袭细胞数分别为(177.26 ± 2.69)、(101.46 ± 1.54)、((98.38 ±1.65)、(189.43 ± 2.72)个。与对照组比较,PA组和CCT组迁移细胞数、侵袭细胞数少(P均<0.05);与PA组比较,PA + GSK组迁移细胞数、侵袭细胞数多(P均<0.05)。
2.4 各组细胞p-PERK/PERK、ATF4、CHOP、E-cadherin、Vimentin蛋白相对表达量比较 培养24 h时各组细胞p-PERK/PERK、ATF4、CHOP、E-cadherin、Vimentin蛋白相对表达量比较见表1。
表1 培养24 h时各组细胞p-PERK/PERK、ATF4、CHOP、E-cadherin、Vimentin蛋白相对表达量比较()
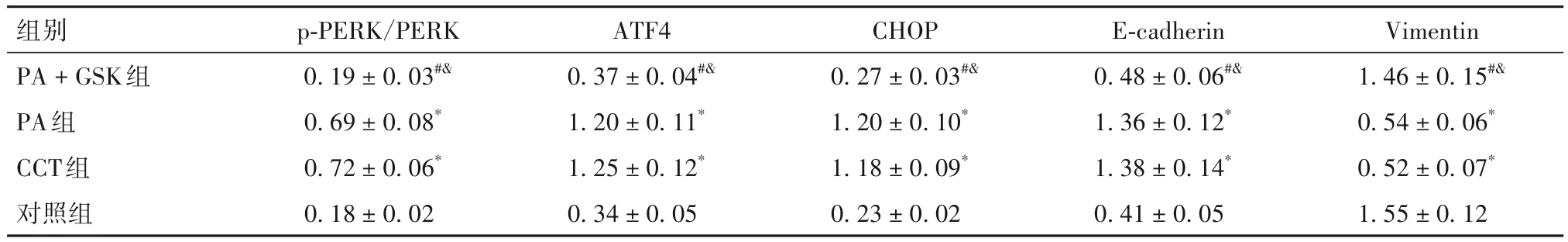
表1 培养24 h时各组细胞p-PERK/PERK、ATF4、CHOP、E-cadherin、Vimentin蛋白相对表达量比较()
注:与对照组比较,*P<0.05;与CCT组比较,#P<0.05;与PA组比较,&P<0.05。
组别PA + GSK组PA组CCT组对照组Vimentin 1.46 ± 0.15#&0.54 ± 0.06*0.52 ± 0.07*1.55 ± 0.12 p-PERK/PERK 0.19 ± 0.03#&0.69 ± 0.08*0.72 ± 0.06*0.18 ± 0.02 ATF4 0.37 ± 0.04#&1.20 ± 0.11*1.25 ± 0.12*0.34 ± 0.05 CHOP 0.27 ± 0.03#&1.20 ± 0.10*1.18 ± 0.09*0.23 ± 0.02 E-cadherin 0.48 ± 0.06#&1.36 ± 0.12*1.38 ± 0.14*0.41 ± 0.05
3 讨论
结肠癌是导致全球死亡率增加的癌症之一。PA作为中药药用真菌茯苓的提取物,不仅具有抗氧化、降血糖、抗炎、镇静及催眠等作用,对肿瘤也有一定的抑制作用[12]。比如,PA能够通过诱导癌细胞凋亡来抑制卵巢癌的发展,且抑制胃癌的转移和侵袭[8]。本研究结果发现,CCT组和PA剂量组的结肠癌细胞SW480存活率和克隆形成数量均低于对照组,细胞凋亡率高于对照组,揭示了PA能够抑制结肠癌细胞的增殖、迁移和侵袭,促进癌细胞凋亡,从而抑制结肠癌的发展,但其作用机制还未深入研究。
EMT是导致癌症转移的关键机制之一。EMT最初是一种发育程序,已被肿瘤细胞用来促进它们在远处的迁移、侵袭和最终定植,从而导致癌症患者预后不良,其导致的细胞间相互粘附作用的丧失是引起肿瘤细胞的迁移和侵袭的主要原因[13]。在EMT过程中,相关分子不仅可以作为肿瘤侵袭性的生物标志物,还可以作为癌症治疗的新潜在靶点,临床发现,上皮标志物E-cadherin和间充质标志物N-cadherin等异常表达可以调节肿瘤的生长和转移扩散[14]。本研究结果显示,与对照组相比,CCT组和PA组结肠癌细胞SW480中EMT相关蛋白E-cadherin表达升高,Vimentin表达降低。PA可以加强SW480细胞间的相互黏附作用,抑制细胞从上皮向间充质的转化,抑制结肠癌细胞的转移和侵袭。
ER应激也在肿瘤的转移和侵袭中起关键作用,比如PERK/ATF4信号通路被激活能够抑制细胞增殖、迁移、侵袭以及EMT过程。PERK是内质网的一种跨膜蛋白激酶,介导ER反应。ER应激是由于各种因素的刺激,导致ER腔内积累了大量未折叠或者错误折叠的蛋白质。在ER应激条件下,PERK、需肌醇酶1(IRE-1)和转录激活因子6(ATF6)这三种ER膜蛋白被激活,从而激活相应的下游调节相关靶基因表达的途径,减少ER腔的负荷,维持细胞内的环境稳定[15]。当PERK通过自磷酸化二聚化并被激活后,促进其下游eIF2α磷酸化,导致大多数mRNA翻译受到抑制。然而,过度和持续的内质网应激可直接导致ER应激相关的细胞凋亡,在该过程中,ER应激可以跳过eIF2α磷酸化并激活ATF4,使其mRNA的翻译增加,并易位到细胞核来调节细胞凋亡、脂质代谢等基因的表达[16]。例如,ATF4作为与蛋白质折叠相关的转录激活因子,可以诱导CHOP、p53等基因的表达,从而促进肿瘤细胞死亡,其在癌症治疗中有巨大潜力。CHOP是一种关键的促凋亡分子,可通过阻止细胞周期和诱导细胞死亡来导致身体损伤[17]。
PA能够通过激活ER应激通路,诱导细胞凋亡且抑制细胞增殖来对肺癌、宫颈癌等产生抗癌活性。本研究结果显示,CCT组和PA剂量组结肠癌细胞SW480中通路相关蛋白p-PERK/PERK、ATF4、CHOP的表达显著高于对照组。表明在PA刺激后,ER应激被激活,PERK被活化,从而激活下游核转录因子ATF4的表达,该途径的启动会增加CHOP基因表达,触发ER应激特异性级联进而达到促进细胞凋亡的目的。进一步加入PERK抑制剂GSK发现,GSK消除了PA对结肠癌的抑制作用,同时ATF4和CHOP的表达降低,揭示了PA可能是通过激活PERK/ATF4信号通路抑制结肠癌细胞的转移、侵袭和增殖,促进细胞凋亡。
综上所述,PA可能通过促进PERK/ATF4通路蛋白、CHOP、E-cadherin蛋白表达,抑制Vimentin蛋白表达,抑制结肠癌细胞的增殖、迁移和侵袭,促进细胞凋亡。但本研究只采用体外细胞实验,PA在体内对结肠癌细胞的影响还需进一步动物实验研究与验证。

