基于转录组分析油菜素内酯对高温胁迫下酿酒葡萄花色苷合成及果实品质的调控机制
汪月宁,代红军,贺琰,魏强,郭学良,刘妍,殷梦婷,王振平
基于转录组分析油菜素内酯对高温胁迫下酿酒葡萄花色苷合成及果实品质的调控机制
汪月宁,代红军,贺琰,魏强,郭学良,刘妍,殷梦婷,王振平
宁夏大学农学院,银川 750021
【目的】分析高温胁迫下参与油菜素内酯调控葡萄花色苷及果实品质合成的相关基因,探讨油菜素内酯调控果实花色苷及品质合成的机制。【方法】以酿酒葡萄‘赤霞珠’为试材,转色前一周利用红外辐射器模拟高温环境,并全树喷施0.6 mg∙L-1的2,4-表油菜素内酯(2,4-Epibrassinolide,EBR),测定花色苷、总糖及相关品质指标,选择转色中期(花后70 d)的果实进行转录组测序,从分子水平阐述EBR对高温胁迫下花色苷合成的影响。【结果】从转色开始,各处理花色苷含量逐渐升高;成熟时,高温组(HT)花色苷总量显著低于对照组(CK),高温油菜素内酯组(HTE)花色苷含量高于HT组。总糖、还原糖、蔗糖变化规律与花色苷相似,HT组含量均在成熟期时低于CK组,成熟期各种糖含量为CK组>HTE组>HT组。分析3种处理下‘赤霞珠’果实基因水平的差异,通过GO和KEGG富集发现了14个与蔗糖和淀粉代谢途经相关的差异基因,其中HT和HTE处理显著上调了10个基因,显著下调了4个基因;苯丙氨酸代谢途径有11个差异基因,其中有7个参与花色苷合成的基因在HT处理中上调,有4个参与木质素合成的基因在HT处理下表达量显著上调,说明高温可能促进了木质素合成,从而降低了花色苷的积累量;内源激素信号转导途径的差异表达基因11个,其中ABA信号转导受体基因及激酶的表达量在高温胁迫下显著提高,其可能与EBR共同参与调控高温胁迫下葡萄花色苷的合成。对部分差异基因的表达模式进行实时荧光定量(qRT-PCR)验证,证实了转录组数据的准确性。【结论】EBR通过改变糖代谢、花色苷合成及内源激素信号转导过程中相关基因的表达模式,缓解了高温胁迫对葡萄花色苷积累的抑制作用,提高了果实品质。
酿酒葡萄‘赤霞珠’;2,4-表油菜素内酯;高温;花色苷;转录组
0 引言
【研究意义】‘赤霞珠’(L.)是典型的欧亚种晚熟酿酒葡萄品种,果籽多且果皮厚,充足的酚类物质,赋予了它酿造顶级葡萄酒的潜力。近年来,宁夏贺兰山东麓葡萄酒产区发展迅速,‘赤霞珠’葡萄的栽培面积逐年增加,但随着大气CO2浓度的增加,极端高温天气频繁出现,抑制了葡萄生长和发育,影响了果实着色及葡萄酒品质[1]。外源油菜素内酯(2,4-Epibrassinolide,EBR)能够有效缓解高温对植物造成的伤害[2],提高果实花色苷的含量,但对其分子机制尚不清楚。因此,探究高温胁迫下,EBR促进葡萄果实花色苷合成的机制,对提高酿酒葡萄品质具有重要意义。【前人研究进展】花色苷是葡萄酒中最重要的类黄酮化合物,是赋予葡萄与葡萄酒颜色的主要物质,并对其风味[3]、口感和营养价值等有重要影响[4]。葡萄中花色苷合成主要是苯丙氨酸代谢途径,是多个酶促反应联合体,极易受到温度的影响[5]。研究发现,高温导致有效次生代谢物积累不足,抑制花色苷的合成,阻碍葡萄的着色[6-7];黄敬寒等[8]研究发现,高温降低内源ABA水平,从而调控花色苷生物合成的转录过程。油菜素内酯(brassinosterids,BR)作为植物体特有的甾醇类激素,广谱高效,在植物生长发育及响应生物和非生物胁迫中发挥着重要的作用[9-10]。DING等[11]和AGHDAM等[12]研究发现,EBR通过提高抗氧化防御系统的活性,保持细胞膜的稳定性,从而增强植物在高温、低温中的耐受性;杨艺琳等[13]研究结果表明,EBR改善了植物渗透调节、维持了细胞内外离子的平衡,抗逆性提高。近年来,EBR与其他激素互作共同提高植物抗逆性的研究越来越广泛,Kagale等[14]发现,EBR可通过上调脱落酸合成基因的表达量从而提高植株对干旱和低温的忍耐力。在分子水平上,NIE等[15]发现,促裂原蛋白激酶MAP1/2介导EBR提高植物对高温的耐受性;ZHOU等[16]研究发现,EBR协同ABA上调的表达、诱导H2O2的积累以及提高NADPH氧化酶的活性,增强番茄的高温抗性;此外,YIN等[17]研究表明,BZR1通过FER(FERINIA)介导的ROS信号正调控番茄的高温抗性。随着对EBR研究的深入,YUAN等[18]发现EBR能够促进拟南芥幼苗中花青素的合成,此后,对于EBR提高植物类黄酮化合物的研究日益增多:冯晓雪[19]研究结果表明,对‘红地球’葡萄喷施EBR能够显著增加总酚和类黄酮含量;王爱玲等[20]在葡萄不同发育时期喷施EBR,果实着色情况明显得到提高,且总酚及花色苷含量显著高于对照组;张睿佳等[21]研究发现,喷施EBR有效缓解了高温对葡萄花色苷积累的抑制作用,改善了果实品质。【本研究切入点】虽然已有研究表明外源喷施EBR能够促进高温胁迫下‘赤霞珠’葡萄果实含糖量、糖酸比、花色苷的含量,改善果实品质,但花色苷合成是涉及大量基因的复杂过程,其相关的分子机制尚不明确。传统分子生物学方法研究该过程效率低且难度大,高通量转录组测序(RNA-Seq)作为一种高效、快捷的转录组研究方法,能够反映生物体在特定环境下的基因表达情况,通过差异基因的表达分析和功能富集分析,揭示EBR调控高温胁迫下花色苷合成相关基因的网络变化。【拟解决的关键问题】本研究以‘赤霞珠’葡萄为试材,转色前进行高温处理并喷施EBR,选取关键时期进行转录组测序。深入研究与花色苷和果实品质合成相关基因的表达模式,并且分析激素信号转导过程中基因的表达量,揭示EBR调控高温胁迫下葡萄果实花色苷积累及品质形成的机理,为生产上使用EBR改善葡萄果实品质及葡萄抗逆分子育种提供理论依据。
1 材料与方法
1.1 材料与处理
试验于2021年5—10月进行,试验地位于宁夏贺兰山东麓产区,中温带干旱气候,风沙土,土层深为40—100 cm,土壤pH小于8.5,昼夜温差大,光照充足,年活动积温3 400—3 800℃,年降水量180—200 mm,平均无霜期160—180 d。供试材料为宁夏玉泉营兰山骄子酒庄10年生‘赤霞珠’(Cabernet Sauvigon),“厂”字形整形,东西行向定植,株行距为0.5 m×3 m,灌溉方式为滴灌。
试验前选取长势一致的植株进行挂牌标记,于转色期前一周(约花后49 d)对挂牌标记的整株葡萄喷施0.6 mg∙L-1的2,4-表油菜素内酯,并使用MRM-2420型红外辐射器(Kalglo electronics Inc, Pennsylvania, USA)对试验区进行增温,设定增加(5±0.5)℃,以自然环境温度为对照组(CK),增温为高温组(HT),喷施油菜素内酯并增温为高温油菜素内酯组(HTE)。每个处理设3次重复,每个重复4株葡萄。采样时期为花后49、70、90和110 d。于8:00—10:00,随机选取不同植株不同着生方向的果穗,在果穗上、中、下部位采集果粒共300粒,采后立即液氮速冻,整果放入-80℃冰箱备用。
1.2 果实总花色苷、可溶性糖的测定
采用pH示差法测定花色苷含量[22],蒽酮硫酸法测定葡萄果实可溶性总糖含量,间苯二酚闭塞法测定蔗糖含量[23],3,5-二硝基水杨酸法测定还原糖含量[24]。
1.3 果实总RNA提取、文库构建及转录组测序
取8月10日(约花后70 d)样品进行转录组测序,果实总RNA的提取及转录组测序委托上海欧易生物医学科技有限公司完成,根据mirVanaTMmiRNA ISOlation Kit, Ambion-1561试剂盒说明书提取果实总RNA,质检合格后,在Illumina平台进行测序,获得原始数据(raw datas);用Trimmomatic进行校正,去除低质量的读数,获得高质量的序列数据(clean reads)。
1.4 葡萄参考基因组比对及基因功能注释
利用HISAT2将clean reads与葡萄参考基因组(http://ftp.ensemblgenomes.org/pub/plants/release51/fasta/vitis_vinifera/dna/Vitis_vinifera.12X.dna.toplevel.fa.gz)、(http://ftp.ensemblgenomes.org/pub/plants/release- 51/gff3/vitis_vinifera/Vitis_vinifera.12X.51.gff3.gz)进行序列比对,获取在参考基因组上的位置信息以及测序样本特有的序列特征信息。计算每千个碱基的转录每百万映射读取的fragments(FPKM值),用RSEM工具检测基因和转录表达水平,使用Nbinom Test函数计算-value和fold change值,以-value≤0.05,|log2fold change|>1为筛选标准,获得不同处理下差异表达基因DEG。差异基因基于ensemblgPlants数据库(http://ftp.ensemblgenomes.org/pub/plants/release-51/)、GO Database数据库(http://geneontology.org/)、KEGG Database数据库(http://www.genome.jp/kegg/)进行基因功能注释。
1.5 差异基因功能富集及聚类分析
采用Goatools软件对DEG进行GO富集分析,使用Fisher精确检验;使用KOSAS对DEG进行KEGG富集分析,计算原理同GO功能分析。为控制假阳性率,采用Bonferroni方法进行多重检验,以-value值≤0.05为阈值,满足此条件的GO和KEGG通路定义为在差异基因中显著富集的通路。
1.6 qRT-PCR验证
根据富集结果筛选出不同处理下参与淀粉-蔗糖转化、苯丙氨酸代谢途径以及激素信号转导途径的差异表达基因,并从中选取9个基因进行qRT-PCR验证,以为内参基因,Primer 5.0设计引物(表1),根据诺唯赞(南京)反转录试剂盒说明书进行cDNA第一条链的合成,采用全式金荧光定量PCR试剂盒进行qRT-PCR试验,2-ΔΔCT法计算差异基因的表达量。

表1 实时荧光定量PCR引物设计序列
1.7 转录因子(TF)分析
将差异基因与转录因子数据库(http://planttfdb.cbi. pku.edu.cn/index.php?sp=Vvi)进行比对,获得差异表达的转录因子并进行归类。
1.8 数据分析与统计
显著性分析采用SPSS 25.0软件进行,绘图软件为Origin 2019。
2 结果
2.1 高温胁迫期间田间温度变化
图1为2021年转色期间田间温度记录,每天8:00—20:00进行高温胁迫,并使用EL-USB-2+温度记录仪对高温胁迫样方进行温度监测。数据显示,增温组整体温度高于对照组的温度。对照组的瞬时最低温度为19.0℃,最高温度达52.5℃;增温组最低温度为24.2℃,最高温度达到57.3℃。CK组日平均温度达到40℃以上日数为1 d,35—40℃日数为14 d,低于35℃日数为9 d。增温处理日平均温度达到40℃以上日数为15 d,35—40℃日数为5 d,低于35℃日数为4 d,且处理期间,增温组的温度整体高于对照组温度,达到预期设定的高温胁迫温度。

图1 转色期温度变化
2.2 EBR对高温胁迫下果实总花色苷、可溶性糖含量的影响
如表2,从转色期到成熟期,花色苷、总糖、还原糖以及蔗糖的含量均升高。刚开始转色时,HT组花色苷含量高于CK组,随着转色程度的增加,HT组花色苷含量开始低于CK组,HTE组花色苷含量略高于HT组,但低于CK组;成熟后,CK组花色苷总量显著高于HT组,HTE组花色苷含量相较于HT组有明显的上升;总糖含量在成熟时依次为CK>HTE>HT,且CK和HTE处理组与HE组存在显著差异;高温处理下,还原糖含量先快速积累,随后变得缓慢,成熟时还原糖含量顺序为CK>HTE>HT;转色过程中,不同处理对蔗糖含量影响不大,成熟后HTE组蔗糖含量最高。
2.3 转录组数测序统计及序列比对
经Illumina平台对8月10日(花后70 d)CK组、HT组和HTE组9个样品进行转录组测序,获得转录组测序数据(表3)。不同处理下原始序列均高于47.30 M,质控处理后序列长度均大于6.80 G,Q30大于91.50%,GC含量在47.39%—47.94%,样品clean reads与参考基因组比对率(total mapped)在89.02%— 92.46%;多个定位测序序列(multiple mapped)在3%左右,单一序列比对(uniquely mapped)在85%以上。表明转录组测序数据可信度高,能够满足后续分析。
2.4 不同处理之间差异表达基因的数目
对转录组差异基因表达情况进行统计(图2),HT与CK组检测到上调基因1 229个,下调基因492个;HTE与CK组上调基因690个,下调基因287个;HT与HTE组上调基因4个,下调基因80个;3组共同差异基因28个。
2.5 差异基因GO富集分析
GO注释结果表明,DEG主要存在于生物过程、细胞组分和分子功能3大类,图3展示了GO富集丰度前20的条目,不同处理条件下,差异基因富集的条目相同,但是DEG数目不同。代谢过程、刺激反应、细胞膜、细胞器、绑定、催化活性等代谢通路上差异基因数目相差较大。

表2 不同处理下‘赤霞珠’葡萄花色苷、可溶性糖含量的变化
CK:对照组;HT:高温组;HTE:高温油菜素内酯组。不同小写字母表示处理间差异显著(<0.05)。下同
CK: Control group; HT: The high temperature group; HTE: High temperature and brassinosteroid group. Different lowercase letters indicate significant difference (<0.05). The same as below
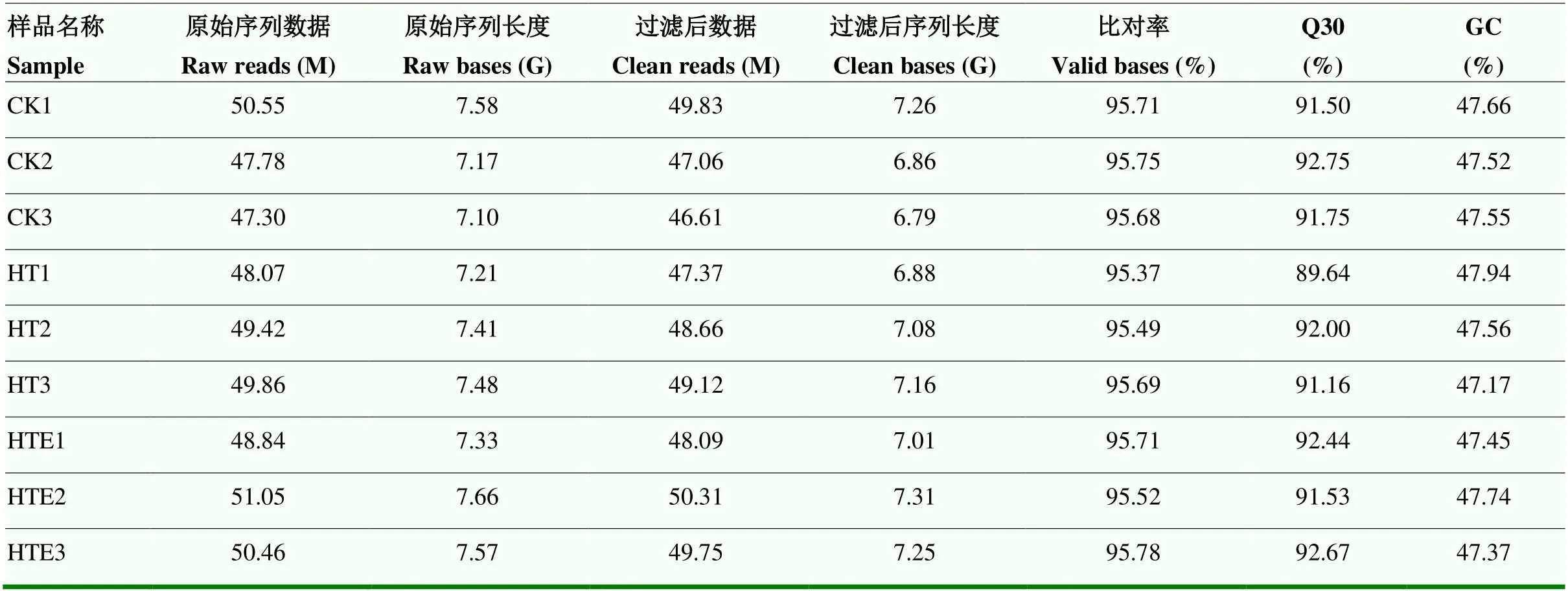
表3 转录组测序数据信息

A:不同处理中上调和下调的DEG数量;B:差异表达基因Venn图
2.6 差异基因KEGG富集分析
KEGG富集展示了差异基因的代谢通路以及生物信息学功能(图4)。本研究中,HT vs CK两组处理,共有4 622个差异基因富集到289个通路;HTE vs CK两组处理中,共有4 622个差异基因富集到149个代谢通路中;HT vs HTE处理中,差异基因富集到19个代谢通路中。将不同处理之间KEGG富集前20的条目进行展示,在HT vs CK组中,上调差异基因主要富集在光合作用-天线蛋白、光合作用、黄酮和类酮醇生物合成、类固醇生物合成、莨菪碱、哌啶和吡啶生物碱的生物合成以及类胡萝卜素生物合成通路中,下调基因富集在二苯乙烯类、二芳基庚烷和姜酚的生物合成、色氨酸合成等通路中(图4-A);HTE vs CK对比,上调基因显著富集在类黄酮和黄酮醇生物合成、光合作用-天线蛋白、类固醇生物合成以及戊糖和葡萄糖苷酸相互转化等代谢通路中,下调差异基因主要富集在半乳糖代谢、植物病原体互作等代谢过程中,与高温处理不同的是,HTE vs CK对比,植物激素信号转导通路中存在差异下调基因(图4-B);HT vs HTE对比中,差异基因富集的通路均为下调基因,但富集的结果并不显著(图4-C)。

图3 差异基因GO分析
2.7 淀粉和蔗糖代谢相关基因的表达分析
糖是花色苷合成的重要物质,对葡萄果实品质有极其重要的作用。在本研究中,共筛选出14个蔗糖-淀粉代谢途径的差异表达基因(图5)。与CK组相比,HT组-淀粉酶(alpha-amylase,AMY)表达量最低,HTE组表达量略微升高但低于对照组;蔗糖转运酶(sucrose synthase,SS)、呋喃果糖苷酶(fructofuranosidase,FF)、葡糖磷酸腺苷酰基转移酶(glucose phosphate adenylytransferase,GP)及-葡萄糖苷酶(-glucosidase,BG)表达量在高温胁迫下最高,对照组最低;海藻糖-6磷酸磷酸酶(trehalose- 6-phosphate,TPP)在高温胁迫下表达量较低,喷施EBR后略有上升,但始终低于CK组。
2.8 苯丙氨酸代谢途径相关基因的表达
苯丙氨酸是植物体内最重要的次生代谢途径之一,花色苷等物质的合成均属于该途径的分支。为了了解高温胁迫下外源喷施油菜素内酯对果实花色苷的影响,根据差异基因KEGG Pathway数据库中注释分析,得到苯丙氨酸生物合成途径(KEGG ID:vvi00941)的差异基因(图6)。注释后发现,差异基因分别为木质素合成途径中的羟基肉桂酰CoA:莽草酸羟基肉桂酰转移酶(hydroxyl-crnnamoyl CoA: shikimate hydroxy cinnamoyl transferase,)、香豆酸-3-羟化酶(coumarte-3-hydroxylase,)、肉桂酰CoA奎宁酸羟基肉桂酰转移酶(hydroxycinnamoyl CoA: quinate hydroxyl-cinnamoy,)和咖啡酰CoA(cafeoyl-CoA-3-O-methyl transferase,);花色苷合成过程中差异基因主要为黄烷酮羟化酶类(flavanone hydroxylase,F3H,)、无色花色素还原酶(leucoanthocyanin reductase,)和无色花色素双加氧酶(leucoanthocyanin dioxygenase,)。本研究发现,HT组木质素合成相关基因的表达量均高于CK组,HTE组木质素合成的相关基因有所下降,但也高于CK组;花色苷合成过程中,高温显著提高了的表达量,喷施EBR增加了该基因的表达量;和的表达量受高温处理的影响,喷施EBR后的表达量低于高温处理。


图5 淀粉和蔗糖代谢相关基因热图
2.9 植物激素相关基因的表达
为了进一步了解EBR对‘赤霞珠’果实内源激素信号转导的影响,对差异基因在KEGG Pathway数据库中注释分析,获得植物激素信号转导途径(KEGG ID:vvi04075)的差异基因,发现差异基因主要集中在生长素(auxin)、脱落酸(abscisic acid,ABA)、油菜素内酯(brassinosteroid,BR)和水杨酸(salicylic acid,SA)信号转导过程,其中生长素信号转导过程中注释到编码生长素受体蛋白的基因1个和(auxin-responsive protein SAUR50-like)家族的基因3个;脱落酸信号转导过程注释到2C型蛋白磷酸酶家族中蛋白磷酸酶基因(probable protein phosphatase,)1个和激酶家族中丝氨酸/苏氨酸激酶基因(serine/threonine-protein kinase,)1个;油菜素内酯信号转导过程中注释到1个关键转录因子和木聚糖基转移酶/水解酶编码基因(xyloglucan endotransglucosylase/hydrolase 2,)2个;水杨酸信号转导过程中,注释到一个。

红色表示上调基因;绿色表示参与代谢的基因;虚线表示多步反应;实线表示一步反应。热图表示不同处理间差异基因的FPKM值,颜色越红,数值越高;从左到右样本依次为CK、HT和HTE。下同
对植物激素信号转导途径中的差异基因进行表达模式分析(图7),与CK相比,HT和HTE处理均提高了、、、(吲哚-3-乙酸诱导蛋白,indole-3-acetic acid-induced protein,)和(吲哚-3-乙酸酰胺合成酶,putative indole-3-acetic acid-amido synthetase)的表达量;HT处理降低了生长素信号转导过程中蛋白磷酸酶5的表达量,与HT相比,HTE处理下,该基因的表达量略高;SnKR2激酶家族中丝氨酸/苏氨酸激酶相关基因的表达量在HT处理下最高,CK处理时最低;BR信号转导过程中,关键转录因子的表达量受高温诱导增加,HTE处理降低了其表达量;的表达情况根据其家族成员的不同而改变;水杨酸信号转导过程中,的表达量在HT和HTE处理下显著提高。
2.10 转录因子的筛选及分类
基于转录组测序数据中的转录因子,参考植物转录因子数据库Plant TFDB(http://planttfdb.cbi.pku.edu. cn/)中的葡萄转录因子家族信息,初步筛选出59个家族的1 690个转录因子(表4),HT vs CK组差异转录因子95个,其中74个上调及21个下调,差异转录因子主要属于AP2、bHLH、bZIP、C2H2、Dof、ERF、HD-ZIP、LBD、MIKC-MADS、MYB、NAC、WRKY转录因子家族;HTE vs CK组上调转录因子44个,下调转录因子13个,差异转录因子主要属于bHLH、bZIP、Dof、ERF、HD-ZIP、LBD、MYB、NAC、WRKY等转录因子家族;HT vs HTE组中下调转录因子6个,且都属于MYB家族。

图7 生长素、脱落酸、油菜素内酯、水杨酸信号转导途径
2.11 qRT-PCR验证
对果实苯丙氨酸代谢、淀粉和蔗糖代谢及激素信号转导相关的9个差异基因(、、、、、、、2及)进行qRT-PCR验证(图8),qRT-PCR基因相对表达量变化趋势与转录组测序结果一致,说明转录组结果准确可靠。
3 讨论
3.1 高温胁迫下EBR影响果实花色苷及蔗糖
花色苷是葡萄果实品质的重要指标之一,内在遗传因素和外界环境因素都会影响其合成。高温作为一种常见的非生物胁迫,会严重抑制花色苷的积累[25]。本研究发现,从葡萄转色开始,高温对花色苷的影响呈现先促进后抑制的规律,EBR缓解了成熟期高温对花色苷积累的抑制作用,此结果与张睿佳等[21]和马立娜[26]的研究结果一致。糖作为花色苷合成的重要物质,与花色苷的积累密切相关[27];本研究中,果实内蔗糖及还原糖含量逐渐上升,HT组含量低于HTE组,表明EBR能够提高葡萄果实中糖的含量,从而提高花色苷的合成。淀粉-蔗糖的转化对于花色苷的积累有重要作用,蔗糖代谢相关酶能够调节蔗糖含量,影响淀粉的合成[28-29]。前人研究表明编码的蛋白酶是催化淀粉降解为可溶性糖的关键酶,蔗糖转化为单糖则依赖于编码的酶[30]。本研究中,HT组以及表达量最低,喷施EBR后的以及表达量上升,推测高温胁迫抑制了淀粉转化为蔗糖相关基因的表达,从而降低了蔗糖含量,影响花色苷的合成。此外,海藻糖作为一种应激代谢产物,当植物处于逆境时,会在细胞表面形成独特的保护膜从而降低恶劣环境带来的危害[31]。本研究中,EBR提高了高温胁迫下的表达量,推测EBR能够促进高温环境下葡萄海藻糖的合成,从而提高葡萄对高温的耐受性。

图8 差异基因qRT-PCR验证
3.2 EBR对高温胁迫下苯丙氨酸代谢途径相关基因的影响
花色苷的生物合成主要是通过类黄酮代谢途径,在此过程中由结构基因调节下游结构酶形成多酶复合物,进而催化花色苷的形成[32]。Luan等[33]在葡萄转色期喷施EBR,发现花色苷代谢的结构基因、、以及表达量显著上升;Xi等[34]研究发现,用EBR喷施葡萄果皮,PAL和DFR具有更高的酶活性。本研究发现,在高温胁迫下喷施EBR,花色苷结构基因以及表达量提高,与前人研究结果一致,说明EBR通过提高花色苷合成基因的表达量,从而提高花色苷的含量。此外,本研究还发现,花色苷合成过程中表达量在高温胁迫下显著提高,其作用底物是各种原花色素,最终合成各种儿茶素,从而降低了花色苷的含量。木质素是苯丙氨酸生物合成的一个分支,与花色苷竞争同一个底物香豆酰CoA,最终在各种酶的催化下合成,从而影响花色苷的合成[35]。本研究中,高温胁迫提高了、、以及等木质素合成相关基因的表达量,推测高温胁迫促进了葡萄果皮木质素的合成,从而提高葡萄的高温抗性,而EBR则通过阻止葡萄未成熟时果皮木质素生成,保证花色苷的生物合成。
3.3 EBR对高温胁迫下葡萄内源激素信号转导相关基因表达模式的影响
植物自身能够形成一套复杂的防御机制来增加对逆境的耐受性,植物激素作为信号分子,其信号转导机制能够参与到高温胁迫响应过程中[36]。近年来,研究发现BR与植物激素相互作用,通过激活植物体内抗氧化酶活性、调控植物渗透物质的平衡、清除自由基等途径参与植物逆境应答过程[37]。本研究发现,高温胁迫下,‘赤霞珠’葡萄果实体内生长素、ABA、BR以及SA等多种激素转导途径基因表达量下降,喷施EBR则能够提高相关基因的表达量。前人研究表明BR与ABA相互作用,提高ABA合成基因的表达从而提高植株对逆境的耐受性[38],ABA可促进葡萄果皮总花色苷和花色苷单体的含量[39]。本研究发现,喷施EBR后,ABA信号受体及表达量上升,推测EBR通过调节内源ABA信号转导,间接影响花色苷单体的合成,从而缓解高温对葡萄花色苷积累的抑制。此外,BR信号转导过程中,是BR信号通路的正调节剂,介导BR的生理效应和生物合成反馈调节[40]。本研究中,喷施EBR,其信号转导关键基因表达量升高,推测该基因表达量的变化,与EBR介导的内源ABA含量增加具有密切关系,关于在BR信号转导过程发挥的作用,还需通过进一步试验验证,BR介导高温胁迫下花色苷积累的机制有待通过过表达技术和基因沉默技术的验证。
4 结论
2,4-表油菜素内酯能够缓解高温对葡萄花色苷积累的抑制作用。通过转录组测序发现,该过程涉及淀粉、蔗糖转化相关基因14个、花色苷合成结构基因7个、木质素合成相关基因4个;此外,高温胁迫下,ABA信号转导的受体及激酶表达量上升,这些基因表达量的改变可能与BR信号转导关键基因表达量变化相关。
[1] Stocker T F, Qin D, Plattner G K, Tignor M M B, Allen S K, Boschung J, Nauels A, Xia Y, Bex V, M. M. P. Climate Change 2013: The physical science basis. contribution of working group I to the fifth assessment report of IPCC the intergovernmental panel on climate change. 2014.
[2] 吴久赟, 廉苇佳, 曾晓燕, 刘志刚, 毛亮, 刘勇翔, 姜建福. 不同品种葡萄对高温的生理响应及耐热性评价. 西北植物学报, 2019, 39(6): 1075-1084.
WU J Y, LIAN W J, ZENG X Y, LIU Z G, MAO L, LIU Y X, JIANG J F. Physiological response to high temperature and heat tolerance evaluation of different grape cultivars. Acta Botanica Boreali- Occidentalia Sinica, 2019, 39(6): 1075-1084. (in Chinese)
[3] CORTELL J M, HALBLEIB M, GALLAGHER A V, RIGHETTI T L, KENNEDY J A. Influence of vine vigor on grape (L. cv. Pinot Noir) anthocyanins. 2. Anthocyanins and pigmented polymers in wine. Journal of Agricultural and Food Chemistry, 2007, 55(16): 6585-6595.
[4] Wang H, Cao G H, Prior R L. Oxygen radical absorbing capacity of anthocyanins. Journal of Agricultural and Food Chemistry, 1997, 45(2): 304-309.
[5] ZHANG J L, NIU J P, DUAN Y, ZHANG M X, LIU J Y, LI P M, MA F W. Photoprotection mechanism in the ‘Fuji’ apple peel at different levels of photooxidative sunburn. Physiologia Plantarum, 2015, 154(1): 54-65.
[6] 钟海霞. 葡萄果实糖分积累机制及关键基因挖掘[D]. 乌鲁木齐: 新疆农业大学, 2021.
ZHONG H X. Sugar accumulation mechanism and key gene mining in grape fruit [D]. Urumqi: Xinjiang Agricultural University, 2021. (in Chinese)
[7] CARBONELL-BEJERANO P, SANTA MARÍA E, TORRES-PÉREZ R, ROYO C, LIJAVETZKY D, BRAVO G, AGUIRREOLEA J, SÁNCHEZ-DÍAZ M, ANTOLÍN M C, MARTÍNEZ-ZAPATER J M. Thermotolerance responses in ripening berries ofL. cv Muscat hamburg. Plant and Cell Physiology, 2013, 54(7): 1200-1216.
[8] 黄敬寒, 温可睿, 潘秋红, 段长青, 王军. 环境条件和栽培技术对葡萄花色苷生物合成的影响(上): 环境条件对葡萄花色苷生物合成的影响. 中外葡萄与葡萄酒, 2011(9): 71-76.
HUANG J H, WEN K R, PAN Q H, DUAN C Q, WANG J. Effects of environmental conditions and cultivation techniques on anthocyanin biosynthesis in grape (Ⅰ)-Effects of environmental conditions on anthocyanin biosynthesis in grape. Sino-Overseas Grapevine and Wine, 2011(9): 71-76. (in Chinese)
[9] BAJGUZ A, HAYAT S. Effects of brassinosteroids on the plant responses to environmental stresses. Plant Physiology and Biochemistry: PPB, 2009, 47(1): 1-8.
[10] JIN S H, LI X Q, WANG G G, ZHU X T. Brassinosteroids alleviate high-temperature injury inseedlings via maintaining higher antioxidant defence and glyoxalase systems. AoB Plants, 2015, 7: plv009.
[11] Ding H D, Zhu X H, Zhu Z W, Yang S J, Zha D S, Wu X X. Amelioration of salt-induced oxidative stress in eggplant by application of 24-epibrassinolide. Biologia Plantarum, 2012, 56(4): 767-770.
[12] Aghdam M S, Mohammadkhani N. Enhancement of chilling stress tolerance of tomato fruit by postharvest brassinolide treatment. Food and Bioprocess Technology, 2014, 7(3): 909-914.
[13] 杨艺琳, 张正敏, 李美琳, 赵立艳, 金鹏, 郑永华. 2, 4-表油菜素内酯对葡萄果实采后灰霉病的抑制作用机理. 食品科学, 2019, 40(15): 231-238.
YANG Y L, ZHANG Z M, LI M L, ZHAO L Y, JIN P, ZHENG Y H. Modes of action of 2, 4-epibrassionolide against postharvest gray mold decay of grapes. Food Science, 2019, 40(15): 231-238. (in Chinese)
[14] KAGALE S, DIVI U K, KROCHKO J E, KELLER W A, KRISHNA P. Brassinosteroid confers tolerance inandto a range of abiotic stresses. Planta, 2007, 225(2): 353-364.
[15] NIE W F, WANG M M, XIA X J, ZHOU Y H, SHI K, CHEN Z X, YU J Q. Silencing of tomato RBOH1 and MPK2 abolishes brassinosteroid-induced H2O2generation and stress tolerance. Plant, Cell & Environment, 2013, 36(4): 789-803.
[16] ZHOU J, WANG J, LI X, XIA X J, ZHOU Y H, SHI K, CHEN Z X, YU J Q. H2O2mediates the crosstalk of brassinosteroid and abscisic acid in tomato responses to heat and oxidative stresses. Journal of Experimental Botany, 2014, 65(15): 4371-4383.
[17] YIN Y L, QIN K Z, SONG X W, ZHANG Q H, ZHOU Y H, XIA X J, YU J Q. BZR1 transcription factor regulates heat stress tolerance throughreceptor-like kinase-mediated reactive oxygen species signaling in tomato. Plant and Cell Physiology, 2018, 59(11): 2239-2254.
[18] Yuan L b, Peng Z h, Zhi T t, Zho Z, Liu Y, Zhu Q, Xiong X y, Ren C m. Brassinosteroid enhances cytokinin-induced anthocyanin biosynthesis inseedlings. Biologia Plantarum, 2015, 59(1): 99-105.
[19] 冯晓雪. 油菜素内酯对红地球葡萄生理生化特性和品质的影响[D]. 兰州: 甘肃农业大学, 2014.
FENG X X. Effects of brassinolide on physiological and biochemical characteristics and quality of Red Globe grape [D]. Lanzhou: Gansu Agricultural University, 2014. (in Chinese)
[20] 王爱玲, 白世践, 赵荣华, 蔡军社. 油菜素内酯对火焰无核葡萄着色的影响. 天津农业科学, 2019, 25(1): 34-35, 42.
WANG A L, BAI S J, ZHAO R H, CAI J S. Effects of brassinolide on colour of flame seedless grape. Tianjin Agricultural Sciences, 2019, 25(1): 34-35, 42. (in Chinese)
[21] 张睿佳, 李瑛, 虞秀明, 娄玉穗, 许文平, 张才喜, 赵丽萍, 王世平. 高温胁迫与外源油菜素内酯对‘巨峰’葡萄叶片光合生理和果实品质的影响. 果树学报, 2015, 32(4): 590-596.
ZHANG R J, LI Y, YU X M, LOU Y S, XU W P, ZHANG C X, ZHAO L P, WANG S P. Effects of heat stress and exogenous brassinolide on photosynthesis of leaves and berry quality of ‘Kyoho’ grapevine. Journal of Fruit Science, 2015, 32(4): 590-596. (in Chinese)
[22] 栾丽英, 张振文, 惠竹梅, 房玉林, 霍珊珊. 脱落酸处理对赤霞珠和烟73葡萄果皮花色苷组分的影响. 食品科学, 2014, 35(18): 110-114.
LUAN L Y, ZHANG Z W, XI Z M, FANG Y L, HUO S S. Effect of abscisic acid on anthocyanin composition of grape skins from73 and cabernet sauvignon. Food Science, 2014, 35(18): 110-114. (in Chinese)
[23] 李璐, 徐玉娟, 吴继军, 余元善, 邹波, 彭健. 华中地区不同品种树莓果实成熟过程中特征活性物质的变化. 现代食品科技, 2021, 37(10): 145-152.
LI L, XU Y J, WU J J, YU Y S, ZOU B, PENG J. Ripening-induced changes in characteristic active compounds of different raspberry () cultivars sourced from central China. Modern Food Science & Technology, 2021, 37(10): 145-152. (in Chinese)
[24] 李利梅, 王秀芹, 杨培培, 黄卫东, 战吉宬. 赤霞珠葡萄果实糖积累与糖代谢相关酶的关系. 中外葡萄与葡萄酒, 2011(7): 24-27.
LI L M, WANG X Q, YANG P P, HUANG W D, ZHAN J C. Relationship between sugar accumulation and sugar metabolism related enzymes during Cabernet Sauvignon berries development. Sino-Overseas Grapevine & Wine, 2011(7): 24-27. (in Chinese)
[25] COHEN S D, TARARA J M, KENNEDY J A. Assessing the impact of temperature on grape phenolic metabolism. Analytica Chimica Acta, 2008, 621(1): 57-67.
[26] 马立娜. 油菜素内酯和脱落酸调控葡萄果实成熟与花色苷合成的研究[D]. 杨凌: 西北农林科技大学, 2012.
MA L N. Study on brassinolide and abscisic acid regulating grape fruit ripening and anthocyanin synthesis [D]. Yangling: Northwest A & F University, 2012. (in Chinese)
[27] GAMBETTA G A, MATTHEWS M A, SHAGHASI T H, MCELRONE A J, CASTELLARIN S D. Sugar and abscisic acid signaling orthologs are activated at the onset of ripening in grape. Planta, 2010, 232(1): 219-234.
[28] ZHANG K, WU Z D, TANG D B, LUO K, LU H X, LIU Y Y, DONG J, WANG X, LV C W, WANG J C, LU K. Comparative transcriptome analysis reveals critical function of sucrose metabolism related-enzymes in starch accumulation in the storage root of sweet potato. Frontiers in Plant Science, 2017, 8: 914.
[29] Winter H, Huber S C. Regulation of sucrose metabolism in higher plants: Localization and regulation of activity of key enzymes. Critical Reviews in Plant Sciences, 2000, 19(1): 31-67.
[30] 林雪茜, 彭淼, 吴少平, 易干军, 董涛, 钟晓红, 高慧君. ‘中蕉9号’与‘巴西蕉’果实后熟过程中可溶性糖积累差异的原因分析. 果树学报, 2019, 36(11): 1524-1539.
LIN X Q, PENG M, WU S P, YI G J, DONG T, ZHONG X H, GAO H J. A comparative analysis of the differences in starch degradation and soluble sugar accumulation between ‘Zhongjiao No.9’ and ‘Baxijiao’ during fruit ripening. Journal of Fruit Science, 2019, 36(11): 1524-1539. (in Chinese)
[31] 靳文斌, 李克文, 胥九兵, 张友亮, 肖兆玲, 张倩, 刘开昌, 龚魁杰. 海藻糖的特性、功能及应用. 精细与专用化学品, 2015, 23(1): 30-33.
JIN W B, LI K W, XU J B, ZHANG Y L, XIAO Z L, ZHANG Q, LIU K C, GONG K J. The character and function of trehalose and its application. Fine and Specialty Chemicals, 2015, 23(1): 30-33. (in Chinese)
[32] SPARVOLI F, MARTIN C, SCIENZA A, GAVAZZI G, TONELLI C. Cloning and molecular analysis of structural genes involved in flavonoid and stilbene biosynthesis in grape (L.). Plant Molecular Biology, 1994, 24(5): 743-755.
[33] Luan L Y, Zhang Z W, Xi Z M, Huo S S, Ma L N. Brassinosteroids regulate anthocyanin biosynthesis in the ripening of grape berries. South African Journal of Enology and Viticulture, 2013, 34(2): 196-203.
[34] XI Z M, ZHANG Z W, HUO S S, LUAN L Y, GAO X, MA L N, FANG Y L. Regulating the secondary metabolism in grape berry using exogenous 24-epibrassinolide for enhanced phenolics content and antioxidant capacity. Food Chemistry, 2013, 141(3): 3056-3065.
[35] 陈素丽, 彭瑜, 周华, 于波, 董彦君, 滕胜. 植物海藻糖代谢及海藻糖-6-磷酸信号研究进展. 植物生理学报, 2014, 50(3): 233-242.
CHEN S L, PENG Y, ZHOU H, YU B, DONG Y J, TENG S. Research advances in trehalose metabolism and trehalose-6-phosphate signaling in plants. Plant Physiology Journal, 2014, 50(3): 233-242. (in Chinese)
[36] 陈乃钰, 张国香, 张力爽, 安逸民, 杜家欢, 王丹, 郭长虹. ABF转录因子在植物响应非生物胁迫中的作用. 植物遗传资源学报, 2021, 22(4): 930-938.
CHEN N Y, ZHANG G X, ZHANG L S, AN Y M, DU J H, WANG D, GUO C H. The role of ABF transcription factors in response to abiotic stress in plant. Journal of Plant Genetic Resources, 2021, 22(4): 930-938. (in Chinese)
[37] HU Y X, BAO F, LI J Y. Promotive effect of brassinosteroids on cell division involves a distinct CycD3-induction pathway in. The Plant Journal: for Cell and Molecular Biology, 2000, 24(5): 693-701.
[38] 林树钦. 脱落酸和表油菜素内酯对月季切花叶片气孔开放和水孔蛋白基因表达的影响[D]. 广州: 仲恺农业工程学院, 2019.
LIN S Q. Effects of abscisic acid and epibrassinolide on stomatal opening and aquaporin gene expression in cut rose leaves [D]. Guangzhou: Zhongkai University of Agriculture and Engineering, 2019. (in Chinese)
[39] CRUPI P, ALBA V, MASI G, CAPUTO A R, TARRICONE L. Effect of two exogenous plant growth regulators on the color and quality parameters of seedless table grape berries. Food Research International, 2019, 126: 108667.
[40] Babalık Z, Demirci T, Aşcı Ö A, Baydar N G. Brassinosteroids modify yield, quality, and antioxidant components in grapes (cv. Alphonse Lavallée). Journal of Plant Growth Regulation, 2020, 39(1): 147-156.
Regulation Mechanism of Brassinolide on Anthocyanins Synthesis and Fruit Quality in Wine Grapes Under High Temperature Stress Based on Transcriptome Analysis
WANG YueNing, DAI HongJun, HE Yan, WEI Qiang, GUO XueLiang, LIU Yan, YIN MengTing, WANG ZhenPing
College of Agriculture, Ningxia University, Yinchuan 750021
【Objective】 The aims of the study were to analyze the genes involved in the regulation of grape anthocyanin accumulation and fruit quality by 2,4-Epibrassinolide (EBR) under high-temperature stress, and to explore the molecular mechanism of EBR regulation anthocyanin accumulation in grapes under high-temperature stress. 【Method】 Cabernet Sauvignon grapes were treated with high-temperature stress using infrared emitter, and sprayed 0.6 mg∙L-1of EBR before the veraison. The content of total anthocyanins, total sugar, reducing sugar and sucrose were quantified using the ultraviolet visible spectrophotometer. The mechanism of EBR-mediated accumulation of anthocyanin under high-temperature stress was analyzed by transcriptome sequencing. 【Result】 Starting from veraison, the anthocyanin content increased gradually under various treatments. At maturity, the total anthocyanin content in the high temperature group (HT) was significantly lower than that in the control group (CK), and the anthocyanin content in the high temperature and EBR group (HTE) was higher than that in the HT group, but lower than CK group. Under HT treatment, the accumulation pattern of total sugar, reducing sugar and sucrose was similar to that of anthocyanins and lower than those of CK group at maturity stage. Compared with HT group, the contents of various sugars in HTE group were increased. The differences in transcriptome levels of Cabernet Sauvignon fruits under the three treatments were analyzed. Through GO and KEGG enrichment, 14 differential genes related to sucrose and starch metabolic pathways, among which 10 genes were significantly up-regulated and 4 genes were significantly down-regulated under HT and HTE treatments. The expressions of 11 genes were different in the phenylpropane metabolic pathway. Seven genes involved in anthocyanin synthesis were up-regulated under the HT treatment, and 4 genes involved in lignin synthesis were significantly up-regulated under the HT treatment, indicating that high temperature might promote lignin synthesis and reduce the accumulation of anthocyanins. In the endogenous hormone signaling pathway, the expression of the ABA signaling receptor genesandwas significantly increased under high-temperature stress, and might be involved in regulating the synthesis of grape anthocyanin under high-temperature stress together with EBR. The expression patterns of some differential genes were verified by qRT-PCR, which confirmed the accuracy of transcriptome data. 【Conclusion】 EBR alleviated the inhibitory effect of high temperature stress on grapevine anthocyanin accumulation, probably due to the fact that EBR reduced the expression of lignin-related genes and changed the expression pattern of grape endogenous hormone signal transduction genes.
L. cv Cabernet Sauvignon; 2,4-Epibrassinolide; high-temperature; anthocyanin; RNA-seq

10.3864/j.issn.0578-1752.2023.06.010
2022-05-09;
2022-08-08
宁夏自然科学基金(2022AAC03009)、国家级大学生创新创业训练计划(G2021107490019)
汪月宁,E-mail:yuening2419@163.com。通信作者代红军,E-mail:dai_hj@nxu.edu.cn
(责任编辑 赵伶俐)

