质粒DNA实验室规模化制备工艺
贲培玲 陈容前 孙 淼 施向阳
滁州城市职业学院医学系,安徽 滁州 239000
细菌质粒DNA(plasmid DNA,pDNA)通常是小的(平均80 kb)环状染色体外DNA元件,以游离形式持续稳定地存在于染色体外,能够通过招募宿主细胞机制进行半自主复制,可携带有助于宿主适应新环境的基因或编码特异性功能的基因。质粒作为载体应用于基因治疗领域具有两大优势:(1)基因转移过程中,质粒载体具有低毒性、低免疫原性,可耐受核酸酶且转移效率与遗传物质大小无关[1];(2)在基因编辑时,质粒可作为编辑工具CRISPR/Cas9系统表达载体和基因修复序列的供体[2]。
pDNA规模化制备,主要目标是最大限度地提高超卷曲pDNA比例和特定产量。通过适当的质粒设计、宿主菌株选择、生长条件优化以及适当的生长和纯化策略,可以提高质粒产量和质量。本研究以质粒pEGFP-N1为例,探索规模化生产质粒DNA的方法。pEGFP-N1自身携带有能表达绿色荧光蛋白的EGFP报告基因,是真核表达载体,该质粒具有很强的复制能力,具有多克隆位点,便于目的基因的插入[3]。大肠杆菌Stbl3是混合大肠杆菌K12和大肠杆菌B亲本的杂交菌株,可以在培养期间稳定维持pDNA[4]。质粒的生产分为两个阶段:上游发酵生产pDNA,下游加工分离纯化pDNA[5]。本研究关注发酵培养基组成及培养条件,进一步进行质粒纯化,成功获得高质量的质粒。
1 材料与方法
1.1 材料
1.1.1 质粒和菌株 质粒pEGFP-N1(4 733 bp ds-DNA)和克隆菌E.coliStbl3由通用生物(安徽)股份有限公司惠赠。
1.1.2 试剂及仪器设备 质粒DNA提取试剂盒(美国Axygen公司),国产酵母提取物和蛋白胨,消泡剂 Antifoam 204(德国Sigma公司),磷酸二氢钾、磷酸氢二钠、氯化钠、氯化铵、氢氧化铵等购自国药试剂。硫酸卡那霉素,琼脂糖、限制性内切酶(美国Promega公司);DNA marker、蛋白检测试剂盒(中国碧云天生物);细菌内毒素检测试剂盒(中国湛江市康博医用设备有限公司);质粒 DNA 残留检测试剂盒(中国湖州生物科技有限公司)。
细菌LB培养基:5 g/L酵母提取物,10 g/L蛋白胨,10 g/L NaCl。发酵培养基:酵母提取物,蛋白胨,NaCl 0.5 g/L,磷酸二氢钾3 g/L,磷酸氢二钾6.78 g/L,氯化铵 1 g/L。微量元素:FeSO4·7H2O(40 mg/L),CaCl2·2H2O(40 mg/L),MnSO4·7H2O(10 mg/L),AlCl3·6H2O(10 mg/L),CoCl2·6H2O(4 mg/L),ZnSO4·7H2O(2 mg/L),NaMoO4·2H2O(2 mg/L),CuSO4·5H2O(1 mg/L),H3BO3(0.5 mg/L)和硫酸卡那霉素(30 mg/L)培养基[6]。
电泳装置、凝胶成像仪;荧光定量PCR仪;10 L实验室台式发酵罐;切向流膜包系统;AKTAExplorer100液相色谱仪、Sepharose6FF凝胶、PlasmidSelectXtra和SOURCE30Q购自美国通用电气公司。
1.2 方法
1.2.1 细菌发酵 摇瓶培养:将来自冷冻工作细胞库(储存于-70 ℃)的0.4 mL细菌培养物无菌转移至4 mL 含有30 mg/L的卡那霉素培养基中。接种物在培养箱摇床中于37 ℃,160 r/min生长至吸光度(optical density,OD) 600 nm 3 ~ 5,过夜,然后转移至500 mL锥形瓶中,该瓶中含有10 ~ 50 mL培养基,并于37 ℃,250 r/min孵育16 h。
实验室发酵:以与摇瓶培养相同的方式制备用于实验室发酵的接种物。将接种物转移到发酵培养基中。6.5 L的发酵液在10 L发酵罐中,于37 ℃,搅拌转速600 r/min和30%溶解氧的空气饱和度发酵16 h。
1.2.2 小剂量质粒提取 参照说明书,取新鲜发酵样品(OD 600为0.5 ~ 4)于1.5 mL离心管中离心弃去上清,立即提取质粒或冷冻保存再提取。确保每个微制备的质粒总量是10 ~ 20 μg,溶于Eluent(pH 8.0,含20 μg/mL RNaseA)或去离子水,储于-20 ℃冰箱中。
1.2.3 质粒纯化 称取菌体,加入细胞重悬液(50 mmol/L葡萄糖,25 mmol/L Tris-HCl,10 mmol/L EDTA,pH 7.5),充 分 重 悬 后 ,与 碱 裂 解 液(200 mmol/L NaOH,1% SDS)混合。裂解后,悬浮液变粘稠,通过加入与悬浮缓冲液等体积的中和液(3 mol/L乙酸钾,5 mol/L冰乙酸)反应,沉淀细胞碎片和SDS复合物。裂解液离心后取上清液,泵入滤芯式滤器(滤芯过滤孔径为0.45 μm)中过滤,最终获得澄清的裂解液。
用2倍柱体积的去离子水洗涤Sepharose 6FF,然后用2倍柱体积的平衡缓冲液[2.1 mol/L (NH4)2SO4,10 mmol/L EDTA, 100 mmol/L Tris-HCl, pH 7.5]洗涤柱。质粒粗提液过柱Sepharose 6 Fast Flow。样品上样量0.3个柱体积,使用泵以0.1 ~ 1 CV/min的速度加载到柱上。然后用平衡缓冲液[2.0 M(NH4)2SO4,10 mmol/L EDTA, 100 mmol/L Tris-HCl, pH 7.5]2 倍CV清洗柱,收集pDNA,弃去RNA[6]。
用溶液[0.3 mol/L NaCl,1.7 mol/L (NH4)2SO4,10 mmol/L EDTA, 100 mmol/L Tris-HCl, pH 7.5]作为缓冲液平衡HiTrap PlasmidSelect Xtra,收集的质粒DNA进行过柱,出现第1个吸收峰即线性质粒DNA峰,待吸收曲线趋于平稳后,用溶液(0.4 mol/L NaCl, 10 mmol/L EDTA, 100 mmol/L Tris-HCl, pH 7.5)作为洗脱液,出现第2峰即超螺旋质粒DNA峰,收集超螺旋质粒(sc pDNA)[7-8]。
pDNA 的精提:用溶液(0.4 mol/L NaCl, 10 mmol/L EDTA, 100 mmol/L Tris-HCl, pH 7.5)洗脱去除内毒素,再以溶液(1.0 mol/L NaCl, 10 mmol/L EDTA, 100 mmol/L Tris-HCl, pH 7.5)洗脱收集超螺旋质粒DNA[9]。
1.2.4 质粒质量分析 (1)动力学定量染色Qubit4.0测定质粒浓度:测定核酸溶液的浓度用TE缓冲液稀释,在260 nm处分光光度测量,测定水溶液中核酸的浓度。(2)1%琼脂糖凝胶分析1 μg未消化质粒和1 μg酶切的质粒。(3)高效液相色谱(high performance liquid chromatography,HPLC)系统检测质粒亚型。(4)蛋白质残留检测:参照说明书,按50体积BCA试剂A加1体积BCA试剂B(50∶1)配制适量BCA工作液,样品与工作液混合后37 ℃孵育30 min,然后在562 nm下比色测定。根据标准品稀释梯度绘制标准曲线,计算质粒DNA蛋白质残留。(5)内毒素含量检测:参照说明书,用终点显色法细菌内毒素检测试剂盒检测质粒DNA内毒素含量。(6)细菌基因组DNA残留的qPCR检测:参考使用说明书,95 ℃预变性10 min;95 ℃ 15 s,60 ℃ 1 min,循环40次;反应体积30 μL。
1.3 数据处理
运用Design Expert 10.0.1软件处理实验数据,Plackett-Burman设计进行多元回归分析和单因素方差分析以拟合数学模型[9]。将蛋白胨、酵母提取物、抗生素、甘油、pH、温度、接种浓度和培养液/摇瓶体积比等进行多因素分析,采用F检验和多元相关拟合优度R对模型进行检验。在本研究中,进行了12个实验,并选择了最优的变量进行进一步的评估。通过对这些变量的回归分析,认为P< 0.05对质粒的产量有显著影响。确定了3个最重要的变量之后,通过适当改变所选变量的范围,执行最陡爬坡试验(plackett-burman, PB),以将响应的实验区域向最优方向移动。当达到最大值时,可将该点作为优化试验设计的中心点。用于构建和探索响应即质粒容积产率的假定函数关系[10]。应用SPSS统计软件,计量资料以均数 ±标准差表示。
2 结 果
2.1 PB实验筛选对质粒产量具有显著影响的因素
质粒的产量与质粒和工程菌的兼容性及各自特性有关,为提高工业化生产条件下质粒的产量,根据文献报道,本研究挑选了影响质粒生产的7大潜在因素作为PB设计的待考察对象,7大因素及水平设置见表1。

表1 PB设计中涉及的影响质粒生产的7大因子及其水平
根据PB设计矩阵设置好的相应生长条件,测量各反应条件下的E.coliStbl3 OD 600(可以表示菌种浓度,反映菌种的生长情况)值及质粒产量。将质粒容积产率作为响应值代入PB设计矩阵(表2),以便后续细菌生长及质粒生产的主要影响因素分析。
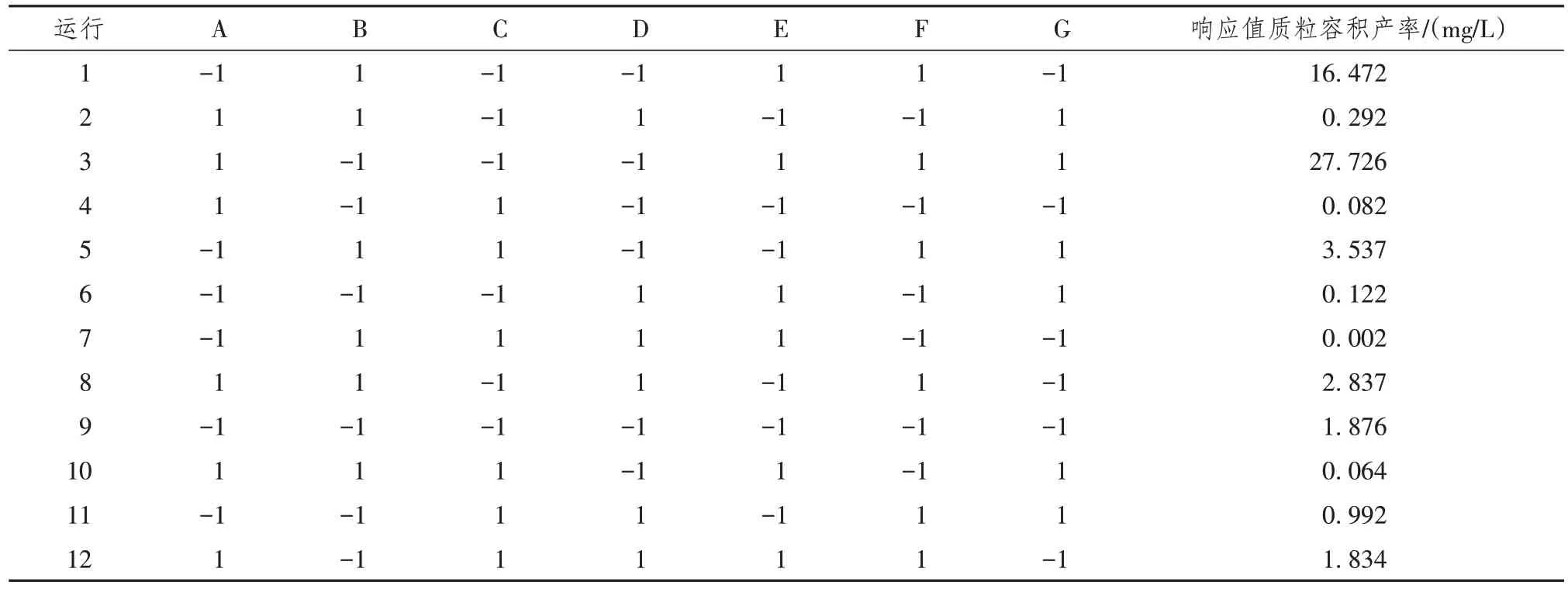
表2 PB设计矩阵及响应值
选取了贡献度 > 1的因子作为自变量纳入回归模型拟合,如酵母提取物(B)、抗生素(C)、甘油(D)、接种浓度(E)、温度(F)、蛋白胨-抗生素交互作用(AC)。以质粒容积产率为因变量(Y),以各模型项或因子为自变量(X)拟合质粒生产模型,其F值为14.0,表明该模型显著。纳入该模型的变量中,质粒生产的显著影响因素(P< 0.05)包括:抗生素、甘油、接种浓度、温度、蛋白胨-抗生素交互作用(表3)。因此,质粒生产最终模型为:Y = - 43.57 × B - 71.36× C - 100.65 × D + 88.86 × E + 57.08 × F - 83.55× AC + 93.06。此模型预测R² = 0.618,校正R² =0.877,两者不一致,表明模型拟合中可能存在一些问题;但该模型精密度= 13.098 4(> 4),表明该模型信息量充足,仍可用于后续实验。

表3 拟合质粒生产的PB因子模型并进行方差与回归分析
2.2 响应面法优化质粒发酵
2.2.1 质粒发酵响应面试验因素水平和结果 利用接种浓度、甘油和酵母提取物作为质粒生产的最显著影响因素进行后续优化分析。响应面试验因素水平和响应值见表4和表5。

表4 响应面试验因素水平和编码
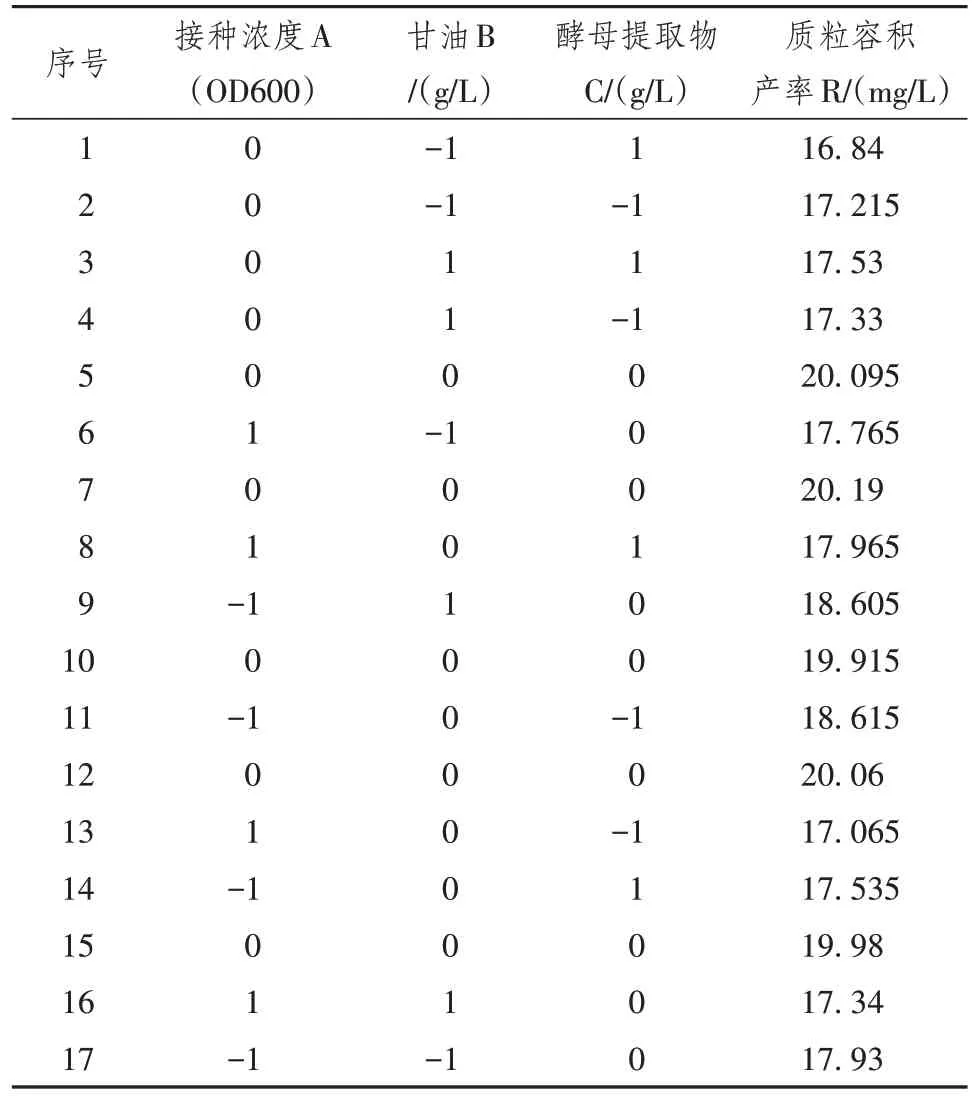
表5 响应面试验设计与结果
2.2.2 响应面试验结果及方差分析 利用Design-Expert软件进行统计分析,得到二次多项式回归方程:质粒容积产量 = 19.978 - 0.318 75 × A + 0.216 25 × B - 0.035 × C - 0.275 × AB + 0.495 × AC +0.125 × BC - 0.666 5 × A2- 1.401 5 × B2-1.5165 × C2。回归方程进行方差分析如表6所示。其中,F值可用来检验各变量对响应值影响的显著性的高低。F越大,则相应变量的显著程度越高。当模型显著性检验P< 0.05,说明该模型具有统计学意义。表7分析结果显示,发酵条件对质粒容积产率影响大小顺序为:A > B > C,即接种浓度 > 甘油 > 酵母提取物。模型的决定系数R2为0.971 3,说明模型具有较高的显著性,而校正R2= 0.934 3,能够解释实验93.43%的响应值变异,实验模型与真实数据拟合程度良好。

表6 响应面拟合回归方程的方差分析结果

表7 响应面拟合回归方程的方差分析结果
2.2.3 响应曲面分析 如图1所示,发酵接种浓度A和甘油B的交互作用对质粒产量的影响呈抛物面分布,当接种浓度A一定时,随着甘油B的增加,质粒容积产率先上升后下降。当甘油B不变时,随着接种浓度A的提高,质粒容积产率先增加后减小。相较而言,在接种浓度方向曲面波动幅度更大,表明接种浓度较甘油对结果影响显著。仅考虑二者因素作用下的最优工艺组合为:接种浓度A为0.012 5 ~ 0.015,甘油B为6 ~ 7 g/L水平组合附近。如图2所示的交互作用中,酵母提取物和接种浓度的交互作用等高线呈显著椭圆形,表明二者交互作用对质粒产量影响显著。质粒容积产率随酵母提取物和接种浓度的增加呈现先增后减变化。当接种浓度 A OD600为0.012 5 ~ 0.015、酵母提取物C取19 ~ 21 g/L水平区间值时,质粒容积产率最高。如图3所示,甘油-酵母提取物交互作用等高线呈现显著圆形,表明二者交互作用对质粒产量影响不显著。当甘油B为6 ~ 7 g/L水平区间、酵母提取物C取19 ~ 21 g/L时,质粒容积产率较高。
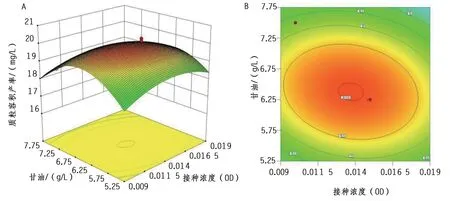
图1 接种浓度和甘油的交互作用对质粒容积产率的影响

图2 接种浓度和酵母提取物的交互作用对质粒容积产率的影响

图3 甘油和酵母提取物的交互作用对质粒容积产率的影响
以质粒容积产率最大为优化目标,根据Design-Expert软件运行结果,质粒产量在接种浓度A、甘油B、酵母提取物C的共同影响下的最优工艺为:接种浓度A OD 600为0.014、甘油B为6.378 g/L、酵母提取物C为19.787 g/L,在此条件下模型预测的最大质粒容积产率为20.035 mg/L。
2.3 工艺条件试验验证
根据软件预测结果,结合实际工艺设置的可行性,取接种浓度A OD 600为0.014 、甘油B为6 g/L、酵母提取物C为20 g/L,进行3次平行重复试验,得平均质粒容积产率为22.3 mg/L,与模型预测结果接近,表明基于该响应面模型分析优化质粒产量工艺的方法有效可行。
2.4 质粒发酵验证
采用10 L发酵罐中加入6.5 L培养基发酵生产,其中甘油6 g/L,酵母提取物20 g/L,E.coliStbl3接种初始浓度OD 600为0.014,发酵16 h,3次重复实验结果表明,细菌的生物量OD 600为(28.07 ± 2.01)。
2.5 质粒纯化
采用低机械应力碱性裂解程序,切向流过滤浓缩质粒粗提液。采用Sepharose 6 Fast Flow层析柱分离DNA与RNA,避免动物源RNA酶的污染。然后采用Plasmidselect Xtra层析柱去除开环或线性质粒DNA,获得超螺旋质粒DNA。进一步采用PlasmidSelect Xtra去除样品内毒素,获得高纯度的质粒DNA。通过HPLC分析获得的pDNA的超螺旋亚型用百分比表示的均匀性为95.55%,质粒体积产量为(21.34 ± 1.31) mg/L,共获得质粒150 mg。
2.6 质粒质量评价
图4A显示,经过层析的质粒,凝胶电泳DNA条带清晰,开环形态得到明显去除,RNA检测不出,Qubit4.0测定RNA残留0.3%。图4B显示质粒经酶切鉴定结果正确。A260/A280为1.91 ± 0.02。用BCA的方法没有检测到蛋白质的污染物。内毒素分析显示,制剂中的内毒素水平低于0.005 EU/g PDNA,完全符合基因治疗用低于0.1 EU/g PDNA的规范。细菌染色体DNA经qPCR检测不到。

图4 质粒pEGFP-N1琼脂糖凝胶电泳图
3 讨 论
质粒DNA生产过程中,细菌营养物质发酵条件的优化对提高发酵效率至关重要,直接影响到下游的纯化和最终的质量和收率[11]。肉汤TB培养基发酵时,工程菌生长速度过快,容易发生质粒丢失。综合前期实验结果和成本费用等因素,使用甘油和国产的蛋白胨、酵母提取物分别作为碳源和氮源。通过建模及方差回归分析,筛选出质粒产量的3个主要影响因子分别为接种浓度、甘油和酵母提取物,进一步发酵验证。
通常在摇瓶培养中,细菌培养基的光密度(OD 600)值约为3 ~ 6。在实验室规模的生物反应器发酵,通过控制营养补料速率来限制细胞的特定生长速度,以保留高比例的超螺旋质粒[12]。发酵采用葡萄糖和线性氨基酸的批量补料策略,获得高质量(高超卷曲质粒水平)质粒[13]。本研究中采用葡萄糖作为补料,但葡萄糖浓度过高或者溶氧过低,大肠杆菌会产生大量乙酸,影响细菌的生长和质粒的高效表达,降低超卷曲质粒百分比。在生物反应器中监测温度、溶解氧和pH值,pH降低时及时补充氯化铵,最终获得高密度菌,OD 600达到30.2。3次发酵菌体湿重总量达到990 g,获得的菌体生物量是摇瓶的2倍多。
采用碱性裂解和色谱纯化方法相结合制备质粒DNA。在菌体裂解后,进一步沉淀、超滤和浓缩质粒DNA溶液[14]。质粒DNA粗制备溶液产物中常混有RNA、蛋白等杂质,影响其应用[15]。本研究中主要采用Sepharose 6FF柱、PlasmidSelect Xtra柱、SOURCE 30Q柱3步层析,除去细菌宿主细胞脂多糖、细菌基因组DNA、RNA、蛋白质等,结果表明获得的质粒DNA超螺旋比例大于90%,含有极低数量的基因组DNA、RNA、蛋白质和内毒素,质粒DNA质量评价符合《质粒抽提和抽提规则》。
综上所述,选择合适的菌株,采用响应面法选择和优化发酵条件,在生物反应器中可以监测和调整不同的操作变量,如pH、溶解氧、间接测定特定的细胞生长率等,完善质粒pDNA实验室规模化制备工艺,并进行质粒质量评价。本研究适用于实验室规模化制备pDNA,并可扩展地制造pDNA作为原料或药物物质,最大限度地提高质粒产量满足医药研究。
利益冲突所有作者均声明不存在利益冲突

