基于核酸适配体的荧光传感器检测赭曲霉毒素A
吕泽平,卫 敏
河南工业大学 粮油食品学院,河南 郑州 450001
赭曲霉毒素A(ochratoxin A,OTA)是一种常见的真菌毒素,其毒性强、分布范围广,主要污染玉米、小麦、高粱、花生等粮食作物及其制品[1-2]。毒理学研究表明,OTA会对人类和动物的健康造成危害,具有很强的肝毒性、肾毒性、神经毒性、致畸性等[3-4]。因此,我国对OTA在食品中的含量制定了严格的限量标准。根据GB 2761—2017的规定,谷物、豆类及其制品中的OTA最大允许限量不得超过5.0 μg/kg,葡萄酒中最大允许限量不得超过2.0 μg/kg。
目前检测OTA的主要方法有高效液相色谱法(HPLC)[5-6]、液相色谱-串联质谱法(LC-MS/MS)[7-8]、电化学法[9-10]、免疫分析方法[11-12]等。HPLC和LC-MS/MS方法具有较高的灵敏度和特异性,但往往需要昂贵的仪器和专业的操作人员,复杂、耗时,不利于实际应用。电化学法因涉及电极表面频繁修饰和纳米材料对传感效率的干扰问题,稳定性和重复性较差。免疫分析方法虽然能满足便捷性的需求,但抗体制备烦琐且成本相对较高,还存在假阳性的风险。近年来,荧光方法因其响应时间快、选择性好、灵敏度高、操作简单等特点而备受关注。因此,开发一种简单、方便、高效的荧光方法用于检测食品中的OTA是非常有价值的。
核酸适配体是可以特异性识别靶标[13]的单链寡核苷酸,可以通过指数富集的配体系统进化技术体外筛选得到。与基于蛋白质的抗体相比,核酸适配体不仅能特异性识别和结合靶标分子,而且具有易于标记、合成方便、成本低、性质稳定等优点[14-15]。近年来,核酸适配体已成为食品、生物、医药等领域的热门工具。Cruz-Aguado等[16]最早研究发现了可以特异性识别OTA分子的单链核苷酸。OTA核酸适配体的发现为构建适配体传感器检测OTA提供了可能。
作者采用荧光方法,使用羧基荧光素(FAM)标记的核酸适配体(Apt-FAM)特异性识别OTA,依据NUPACK软件模拟结果,通过对不同互补DNA核酸序列的筛选,构建了快速、简单的荧光传感器,实现对食品中OTA的检测。
1 材料与方法
1.1 试验材料
核酸序列:生工生物工程(上海)有限公司,标记FAM的OTA核酸适配体与其互补链的DNA序列(cDNA)见表1。OTA、AFB1、DON:Sigma-Aldrich公司;FB1:Acros公司;T-2毒素:生工生物工程(上海)股份有限公司;ZEN:国家粮食和物资储备局科学研究院提供。葡萄酒:市售。

表1 试验使用的DNA序列Table 1 DNA sequences used in this experiment
氯化钠(NaCl)和盐酸(HCl):天津市科密欧化学试剂有限公司;三羟甲基氨基甲烷(Tirs):上海麦克林生化科技有限公司;乙二胺四乙酸(EDTA):洛阳化学试剂厂。以上试剂均为分析纯。
1.2 仪器与设备
Agilent Cary Eclipse EL06953220荧光光谱仪:美国瓦里安公司;MX-S涡旋振荡器:北京大龙兴创实验仪器有限公司;HC-2066高速离心机:安徽中科中佳科学仪器有限公司;ULUP-II-10T超纯水机:西安优普仪器设备有限公司。
1.3 试验方法
1.3.1 荧光传感器的制备及OTA的检测
将10 μL 1 μmol/L Apt-FAM 探针与10 μL 1 μg/mL 的OTA溶液加入200 μL的离心管中,涡旋振荡混合均匀,在37 ℃条件下,置于水浴恒温振荡器内孵育30 min,之后加入10 μL 1 μmol/L cDNA-BHQ1,继续孵育30 min。孵育完成后,使用Tris-HCl缓冲液(pH 7.4)将溶液体积补充至200 μL,使用荧光分光光度计记录混合溶液在490 nm激发波长下的荧光强度。
1.3.2 实际样品处理
将玉米样品研磨成粉后取出0.5 g,分别加入0.5 mL不同浓度的OTA标准液,室温干燥后,加入5 mL的萃取溶剂(甲醇与水体积比7∶3),振荡30 min后,以12 000 r/min离心10 min,用0.45 μm有机滤膜过滤获得上清液。使用Tris-HCl缓冲液(pH 7.4)将滤液稀释100倍。根据上述方法,分别制备出含有0、0.5、5、50 ng/mL的加标玉米粉样品。
取0.5 mL葡萄酒样品,分别加入0.5 mL不同浓度的OTA标准液,混合均匀,用0.45 μm水系滤膜过滤获得上清液。使用Tris-HCl缓冲液(pH 7.4)将滤液稀释100倍。根据上述方法,分别制备出含有0、0.5、5、50 ng/mL的加标葡萄酒样品。
1.4 数据处理
使用Originpro 2021软件处理试验数据,使用Adobe Illustrator 2022软件绘制原理图。
2 结果与分析
2.1 试验原理
基于标记有荧光探针FAM的OTA适配体,与标记有猝灭基团BHQ1的cDNA互补链,设计了荧光适配体均相传感器用于OTA的检测研究,检测原理如图1所示。当OTA不存在时,Apt-FAM与cDNA-BHQ1通过碱基互补配对相结合,形成DNA双链结构,荧光基团FAM靠近猝灭基团BHQ1,在荧光共振能量转移作用下,Apt-FAM链上标记的荧光基团被cDNA-BHQ1上标记的猝灭基团BHQ1猝灭[17-18],得到较弱的荧光信号。当OTA存在时,Apt-FAM适配体链会与OTA特异性结合,形成G-四链体单链结构,不会通过碱基互补配对与cDNA-BHQ1形成双链,FAM的荧光不会被BHQ1猝灭,荧光信号恢复,与Liu等[19]的研究结果一致。
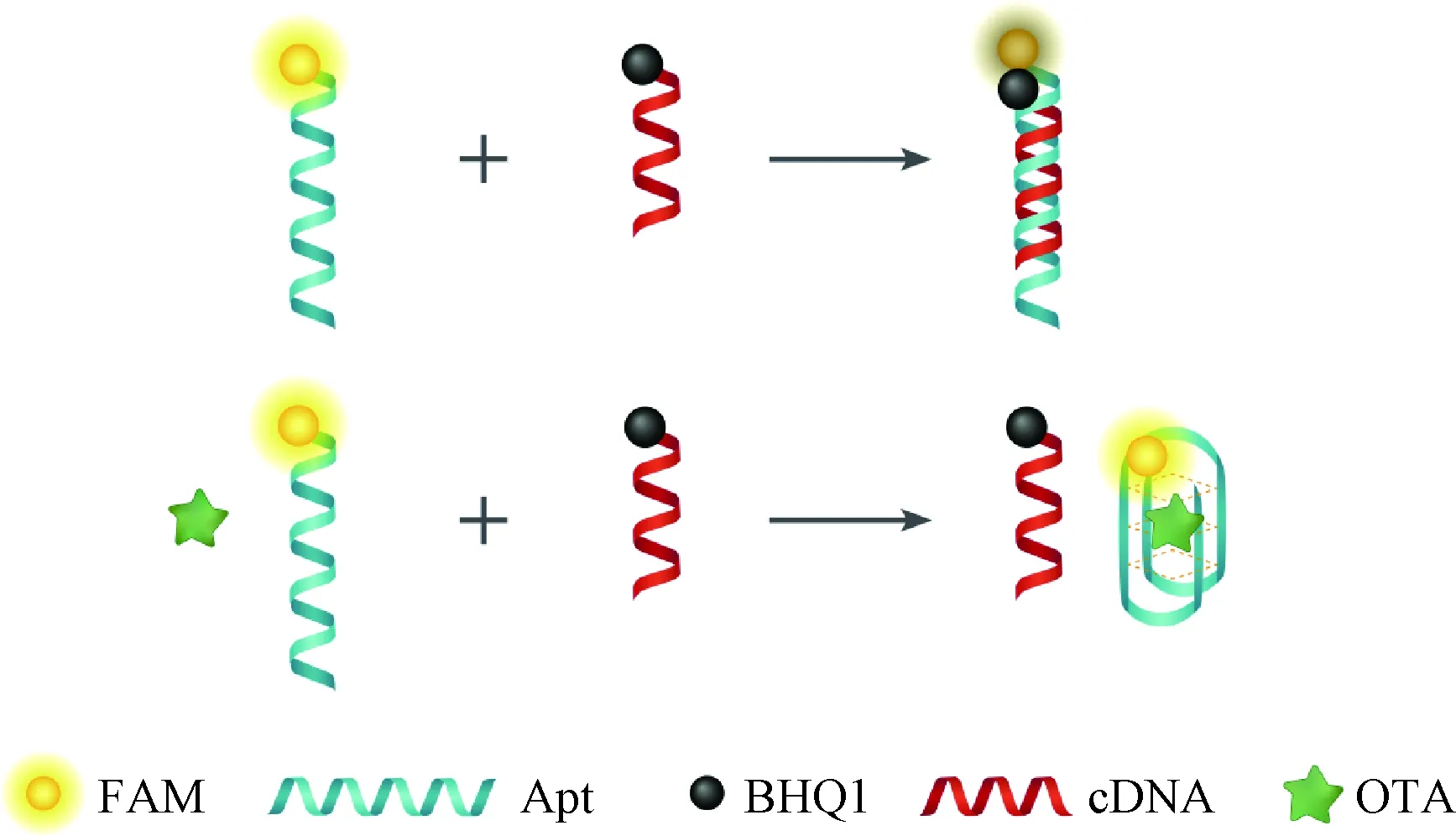
图1 荧光传感器检测OTA的原理Fig.1 Principle of OTA detection by fluorescence sensor
2.2 荧光传感器用于OTA检测

图2 传感器的荧光光谱图Fig.2 Fluorescence spectra of the sensor
利用所制备的荧光传感器对OTA进行检测,结果如图2所示。当反应体系中没有OTA存在时,测得的荧光信号值较低(曲线a),最高为80.97 a.u.。这说明Apt-FAM与cDNA1-BHQ1成功形成双链结构,FAM的荧光信号成功被BHQ1猝灭。当OTA存在时,荧光信号值(曲线b)明显升高至182.91 a.u.,与不含OTA的情况相比,响应信号值增加了1.3倍。这说明了Apt-FAM适配体链能够与OTA特异性结合,带有FAM荧光基团的适配体链远离cDNA-BHQ1,FAM荧光基团不会被BHQ1猝灭,因而荧光信号较高。结果表明本试验所构建的荧光传感器能够成功检测OTA。
2.3 核酸适配体互补DNA序列的优化
依据NUPACK软件模拟结果(图3),选取了3条不同长度、位置的互补序列cDNA1-BHQ1、cDNA2-BHQ1、cDNA3-BHQ1。cDNA1-BHQ1和cDNA2-BHQ1均从Apt-FAM的3′端与其互补,分别互补了18、12个碱基,其吉布斯自由能分别为-105.60 kJ/mol和-74.06 kJ/mol。cDNA3-BHQ1与Apt-FAM从距其3′端第13个碱基开始互补(即中间互补),互补了12个碱基,其吉布斯自由能为-74.43 kJ/mol。按照1.3.1试验步骤分别构建相应的传感器,对OTA进行荧光检测,依据背景信号荧光强度和整体相对荧光强度的差值(ΔF),选取了最适互补序列,结果如图4和图5所示。由图4可知,与cDNA2-BHQ1和cDNA3-BHQ1相比,cDNA1-BHQ1参与反应时,背景信号荧光强度最低,说明互补链与适配体互补18个碱基时,两条链能够更好地结合,使FAM的荧光信号被BHQ1猝灭。试验结果与NUPACK软件模拟结果相一致,即两条DNA链结合时,吉布斯自由能越小,亲和力越高,结合越稳定[20]。图5显示了有无目标物存在时的ΔF,当cDNA1-BHQ1参与反应时,ΔF最大。因此,在3条DNA序列中,选择cDNA1-BHQ1作为互补链参与反应,进行后续试验。

图3 Apt与不同cDNA形成的二级结构Fig.3 Secondary structure diagram of Apt and different cDNA formation

图4 不同cDNA对应的荧光光谱Fig.4 Fluorescence spectra corresponding to the different cDNA

图5 不同cDNA对传感器ΔF的影响Fig.5 Effect of different cDNA on the ΔF of the sensor
2.4 传感器结合方式的优化
选取了两种不同的结合方式对传感器进行优化。方式1是将Apt-FAM与OTA、cDNA1-BHQ1同时加入,孵育60 min后进行荧光测定;方式2是将Apt-FAM与OTA先孵育30 min,再加入cDNA1-BHQ1孵育30 min后进行荧光测定。图6为两种不同结合方式对应的荧光光谱图,由图6可知,方式1和方式2的背景信号基本相同,但加入OTA后,方式2的荧光信号最大值上升幅度明显高于方式1,是其1.30倍,说明OTA先与Apt-FAM结合时,结合效果更好,其阻碍了Apt-FAM与cDNA-BHQ1结合,使荧光共振能量转移效应减弱,从而获得了更高的荧光信号。因此,选择方式2进行后续试验。

图6 不同结合方式对应的荧光光谱Fig.6 Fluorescence spectra corresponding to the different binding methods
2.5 孵育时间的优化
对传感器的孵育时间进行了优化,其他试验条件与1.3.1一致,将Apt-FAM与OTA先孵育10、15、30、45、60 min,再加入cDNA1-BHQ1孵育10、15、30、45、60 min,即传感器的总孵育时间分别为20、30、60、90、120 min。孵育完成后进行荧光测定,比较ΔF,选取最适孵育时间。由图7可知,随着反应的进行,ΔF逐渐增大,将Apt-FAM与OTA先孵育30 min,再加入cDNA1-BHQ1孵育30 min后,ΔF达到最大,为107.43 a.u.。之后,随着孵育时间的延长,ΔF无明显变化。因此,总孵育时间为60 min为最佳孵育时间继续进行后续试验。

图7 不同孵育时间对传感器ΔF的影响Fig.7 Effect of different incubation time on the ΔF of the sensor
2.6 cDNA与Apt用量比的优化

图8 不同cDNA与Apt用量比对传感器ΔF的影响Fig.8 Effects of different dosage ratios of cDNA and Apt on the ΔF of the sensor
为了获得传感器的最佳性能,对cDNA与Apt的用量比进行了优化,结果如图8所示。当OTA存在时,保持Apt用量不变,随着cDNA用量的增加,ΔF逐渐增大,并在cDNA与Apt用量比为1.0(1∶1)的情况下达到最大值;当cDNA的用量继续增大时,ΔF略有下降。因此,选择cDNA与Apt用量比为1∶1进行后续试验。
2.7 反应体系pH值的优化
反应体系的pH值会影响DNA链的稳定性,因此对体系的pH值进行了优化。由图9可知:当OTA存在时,随着Tris-HCl缓冲溶液的pH值从6.6开始增大,ΔF也逐渐增加,并在pH 7.4时达到最大值;随着Tris-HCl缓冲溶液的pH值继续增大,ΔF略有下降,因此选择pH 7.4作为整个试验的最优pH值。

图9 不同pH值对传感器ΔF的影响Fig.9 Effects of different pH values on the ΔF of the sensor
2.8 建立标准曲线
在最佳检测条件下,测定OTA不同质量浓度( 0、0.05、0.5、1、5、10、50、100、200 ng/mL)荧光传感器的荧光强度,研究ΔF与OTA质量浓度之间的关系,并根据相关性建立了标准曲线。由图10可知,在0.5~100 ng/mL的线性范围内,随着OTA质量浓度的增加,ΔF也随之增加,并且在对OTA质量浓度取对数后,两者具有良好的线性相关关系,线性方程为y=31.934 98+41.714 94lg(COTA),决定系数R2=0.997,检出限为0.13 ng/mL。本试验所制备的传感器与其他文献的线性范围和检出限比较如表2所示。由表2可知,本试验所制备的传感器的线性范围更广,检出限更低,所制备的传感器检出限虽不及电化学方法,但检测范围优于电化学方法。此外,传感器的制备时间较短,优于表2中的其他传感器,可以达到更快速检测OTA的目的。

图10 不同质量浓度OTA与ΔF的关系Fig.10 Different mass concentrations of OTA with ΔF
2.9 传感器特异性研究
选取黄曲霉毒素B1(AFB1)、伏马菌素B1(FB1)、T-2毒素、玉米赤霉烯酮(ZEN)、呕吐毒素(DON)作为干扰物质,进行传感器的特异性研究,所用OTA的质量浓度为50 ng/mL,其他干扰毒素的质量浓度均为500 ng/mL,结果如图11所示。由图11可知:单一的其他干扰毒素对ΔF影响很小;当其他干扰毒素与OTA共存(Mix)时,ΔF与空白相比明显上升,且与OTA单独存在时的ΔF无明显差异。说明该传感器对检测OTA有良好的特异性。

表2 本方法与其他检测OTA的方法比较Table 2 Comparison of this method with other methods for detecting OTA

注:Mix是含有AFB1、FB1、T-2、ZEN、DON、OTA的样品。图11 不同毒素对传感器特异性的影响Fig.11 Effects of different toxins on sensor specificity
2.10 实际样品检测
为了验证传感器在实际样品中的检测效果,对玉米粉、葡萄酒样品进行了加标检测,结果如表3所示。玉米粉样品和葡萄酒样品的平均回收率分别为100.0%~102.0%和98.0%~102.2%,RSD均低于10%,表明该传感器对实际样品的检测具有较高的准确性。

表3 玉米粉和葡萄酒中OTA的加标检测 (n=3)Table 3 Spike detection of OTA in corn flour and wine (n=3)
2.11 传感器的重现性和稳定性
为了验证传感器的重现性,选择OTA的质量浓度为50 ng/mL,在最佳检测条件下,进行了6次平行试验,记录荧光强度,其相对标准偏差(RSD)为2.9%。由此可知,该传感器具有良好的重现性。将传感器在4 ℃下储存,分别测试了第1天、第4天、第7天、第10天、第14天的稳定性,结果如图12所示。可以看出,随着储存时间延长,荧光强度稍有下降,第14天的荧光强度下降了9.32%,保留率为90.68%,表明该传感器具有可接受的稳定性。

图12 传感器的稳定性Fig.12 Stability of the sensor
3 结论
本试验利用核酸适配体作为特异性识别元件,FAM作为荧光探针,cDNA1-BHQ1为最佳互补链,成功制备了用于检测OTA的荧光传感器,该传感器制备简单、特异性好,具有可接受的重现性,能实现对OTA的快速检测。对玉米粉和葡萄酒进行加标检测,具有较好的回收率,说明该传感策略可被成功应用于食品中OTA的检测。此外,本试验所构建的传感器还具有潜在的通用性,可以将识别元件更换为其他真菌毒素的适配体,从而实现对其他真菌毒素的快速检测,为快速检测食品中真菌毒素提供了一种新的思路。

