单双手术间清创模式治疗脊柱内固定术后早期深部感染的比较研究
施美蓉 陈素平 董琼虹 林秀华 裴彬宏 苏增标 曹杰
(中国人民解放军联勤保障部队第910医院,福建 泉州 362000)
脊柱内固定术后深部感染是脊柱外科的严重并发症之一,发生率约为2%~20%[1]。而脊柱内固定术后早期感染是指脊柱内固定术后30 d内的感染,该时期多采用清创、引流及保留内固定的方式治疗[2-3]。随着手术抗感染护理理论的发展,清创术中已从单一手术台,发展到清创前与清创后隔离开的双手术台模式,感染复发率有所降低[4]。但目前该类型手术仍是在同一间手术内进行,虽然清创后更换手术台,但清创过程中的污染物或细菌随气溶胶的漂浮扩散,可能导致更换手术台后的器械污染及感染伤口术后复发[5]。为了比较单双手术间清创模式治疗脊柱内固定术后早期深部感染的疗效和安全性,本文回顾性分析了2004年5月-2021年7月我院收治的126例脊柱内固定术后早期深部感染患者的临床资料,现报告如下。
1 资料与方法
1.1一般资料 回顾性分析2004年5月-2021年7月中国人民解放军联勤保障部队第910医院脊柱外科收治的脊柱内固定术后早期深部感染患者的临床资料,术后根据临床表现、实验室检查、影像学资料、病原学检查诊断为脊柱内固定术后早期深部感染,并采取相应治疗的患者。本组共126例,术前均完成分泌物培养及药敏试验,病原菌:金黄色葡萄球菌(staphylococcus aureus,SA)42例,耐甲氧西林金黄色葡萄球菌(methicillin resistant staphylococcus aureus,MRSA)12例,粪肠球菌(enterococcus faecalis,EF)9例,凝固酶阴性葡萄球菌(coagulase negative staphylococcus,CNS)21例,大肠杆菌(bacillus coli,BC)27例,鲍曼不动杆菌(acinetobacter baumannii,AB)9例,铜绿假单胞菌(pseudomonas aeruginosa,PA)6例。根据手术护理记录单中的手术配合方法,所有患者分为双手术间组、双手术台组和对照组3组,其中双手术间组36例,采用双手术间清创模式;双手术台组30例,采用单手术间内双手术台清创模式;对照组60例,采用单手术间内单手术台清创模式。各组间一般资料及营养状态比较,差异无统计学意义(P>0.05),具有可比性。见表1和表2。

表1 3组患者一般资料比较

表2 3组患者营养状态比较
1.2方法 所有患者均采用气管插管全身麻醉,俯卧位,术野常规消毒铺无菌巾。拆除伤口缝线或原切口入路,切除窦道周围皮肤和软组织,大量生理盐水洗净伤口内脓液,彻底刮除内固定表面脓苔及脓腔内壁。碘伏浸泡伤口后,大量生理盐水冲洗,保留内固定物,放置冲洗管和引流管,接冲洗液持续伤口冲洗。
1.2.1双手术间组 脊柱伤口清创结束后,助手更换手套,伤口内填塞无菌纱布,切口保护膜密封伤口。麻醉医生将气管插管接便携式呼吸机,并整理各种心电监护及管道。手术室转运车紧贴手术床,高度与床面齐平,将患者保持俯卧位平移至转运车上,并迅速转移至提前消毒好的手术间。同样方法将患者呈俯卧位平移至手术床上后,按流程检查管道、主要器官及皮肤摆放位置,避免管道脱落松动或压力性损伤[7],麻醉医生恢复麻醉机工作方式,并整理各种监护及管道。手术医生重新洗手消毒,更换无菌手术服,助手揭除伤口保护膜、取出纱布后,术者按开放性伤口原则重新伤口消毒、铺巾。护士重新开手术台,全部使用新消毒的手术器械及物品。术者使用碘伏、大量生理盐水冲洗切口,放置冲洗管及引流管,逐层缝合关闭伤口,无菌敷料覆盖。
1.2.2双手术台组 脊柱伤口清创结束后,助手更换手套,伤口内填塞无菌纱布,切口保护膜密封伤口。护士撤除手术台、所有手术器械及手术铺巾。手术医生重新洗手消毒,更换无菌手术服,助手揭除伤口保护膜、取出纱布后,术者按开放性伤口原则重新伤口消毒、铺巾。护士重新开手术台,全部使用新消毒的手术器械及物品。术者使用碘伏、大量生理盐水冲洗切口,放置冲洗管及引流管,逐层缝合关闭伤口,无菌敷料覆盖。
1.2.3对照组 清创手术开始前,将缝合手术器械与清创器械分开放置在手术台一边,无菌巾覆盖。整个清创过程避免接触缝合器械。清创结束后,手术医生重新洗手消毒,更换无菌手术服,助手将伤口重新消毒铺无菌单。术者用无菌巾覆盖清创器械,使用缝合器械。术者使用碘伏、大量生理盐水冲洗切口,放置冲洗管及引流管,逐层缝合关闭伤口,无菌敷料覆盖。
1.3术后处理
1.3.1抗感染治疗 所有患者均静脉应用敏感抗生素治疗,抗生素停药标准为体温正常、伤口无红肿或渗出、局部疼痛明显改善,且连续3次复查血常规、C反应蛋白及降钙素原正常。静脉抗生素停药后,选择适宜的敏感口服抗生素继续治疗1个月;MRSA感染者口服抗生素疗程延长至3个月。治疗期间每周监测肝、肾功能变化,观察药物不良反应。
1.3.2冲洗引流管理 术后以庆大霉素生理盐水(8万单位:500 mL)持续冲洗,冲洗量为100 mL/h,每3天行引流液细菌培养。待引流液清亮、细菌培养连续2次阴性后可停止冲洗,改为单纯引流。24 h引流量<30 mL时予拔除引流管。
1.4观察指标 (1)一般情况:记录手术时间、住院时间、出血量、手术费用。(2)感染控制情况:记录缝合前器械表面细菌附着例数、细菌菌种与术前的相似例数、术后感染复发例数、伤口愈合等级。其中缝合前器械表面细菌附着例数是指开始伤口缝合前由巡回护士对3个手术器械表面进行细菌采样,记录的细菌培养阳性例数。(3)安全性:记录术中麻醉不良事件(包括气管插管松脱、呼吸机松脱或故障、监护仪松脱或故障)、护理不良事件(包括静脉导管松脱或失效、导尿管松脱或失效、压疮、颜面部压力性损伤)。
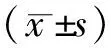
2 结果
3组患者各项观察指标比较 见表3-表5。

表3 3组患者手术一般情况比较

表4 3组患者感染控制情况比较(例)

表5 3组患者安全性比较(例)
3 讨论
3.1传统单手术间清创模式的弊端 由于基层医院清创理念的限制,治疗脊柱内固定术后早期深部感染时仍是以单手术台模式为主,甚至仅仅隔离清创术前与术后的手术器械,或更换手套而已,这种模式导致伤口缝合过程中极易受到清创前细菌的再次污染,导致感染复发[8]。Dharan等[9]研究发现术中细菌污染途径包括接触污染、喷溅污染和气溶胶污染。Lener等[10]在单手术台清创术中,发现虽然手术器械被隔离,但在部分病例中仍可在器械表面培养出与术前相同的细菌菌种。Boekel等[11]发现污染区域边缘外直径22.7 cm都是细菌微粒播散的危险区域。Mazurek等[12]进行50例头颈部感染清创术时,发现开台2 h后81%的病例在无菌巾隔离的器械和铺巾上可培养出阳性细菌附着,且这些细菌与术前相同。所以有学者[13]认为虽然已严格遵循无菌操作,但污染部位周围的气溶胶仍可能导致邻近物品的细菌污染,气溶胶是导致细菌播散和感染复发的重要因素[13]。本研究中,对照组使用单手术台,经历清创手术后,26.67%(16/60)的病例在开始缝合前的器械表面培养出细菌,而这些细菌有93.75%(15/16)与术前细菌菌种相同,而双手术台组虽然缝合时重新开台并更换手术器械,但细菌培养阳性率仍达到(10/33),且均与术前细菌菌种相同,2组间差异无统计学意义(P>0.05)。这也说明术中细菌播散并非主要由接触传播导致,接触传播通过严格的无菌操作可以很好得到控制,所以更换手术台和手术器械并不能完全控制细菌附着。那么,导致两种手术配合方式细菌附着率相似的原因就只能是空气中的细菌气溶胶了,这也与He等[13]的观点相似。
另一方面,虽然脊柱深部感染术后复发与手术技术、无菌操作、感染菌种、术后抗感染及个人抵抗力有关,但器械表面的细菌附着无疑会增加感染复发的机率。De Simone等[14]对过去20余年腹部感染手术的调查中发现,使用接触感染伤口的器械进行缝合时,虽然器械经过酒精等消毒剂擦拭消毒,但仍会增加8%~32%的感染复发率。本研究中双手术台组和对照组虽然并非所有检出细菌附着的病例均会导致术后感染复发,但对照组中13例、双手术台组中5例术后感染复发的病例在缝合前均检出相同菌种,而未检出细菌附着的病例均未出现术后感染复发,这也从侧面说明了通过气溶胶传播导致手术台细菌附着是增加术后感染复发的重要因素之一。所以在脊柱深部感染手术中,如何减少细菌通过气溶胶的播散对减少术后感染有重要的意义,应当引起重视,但显然单手术间方式无论是否更换手术台均无法有效控制该传播途径。
3.2双手术间清创模式的优点 双手术间清创模式是指感染患者清创过程与伤口闭合过程在不同手术间进行,该模式可以尽可能减少细菌在手术空间的播散,最早由Carvalho等[15]提出,但在国内尚未见应用的报道。泉州地区部分医院自2018年开始逐渐在手术室尝试使用该模式进行脊柱内固定术后早期深部感染,笔者回顾分析这些病例时发现双手术间模式虽然无法对患者与术者的所有随行物品进行完全隔离,但所有患者从清创手术间转移至缝合手术间后,从开台后的手术器械表面均未检出细菌,这可能与空气中细菌气溶胶数量明显下降,单位空间内的细菌数量不足以形成附着有关。Dong等[16]研究认为空气中飘浮的细菌菌落总数需达到200 cuf/m3才可能形成附着并致病。本研究中由于脊柱内固定术后感染是一种严重的感染类型,所以清创手术一般在Ⅲ级或Ⅱ级手术室进行,手术室内的飘浮物可能增加携带细菌的机率,但检索的病例中该组内的脊柱感染在缝合时均转移到I级手术室进行,显然飘浮尘粒数量的显著减少可以减弱细菌的播散能力,所以这也导致器械表面附着的细菌获得有效控制。值得注意的是,巡回护士对手术台器械采样的时间并未在检索的病例中体现,无法明确随着缝合时间的延长是否会影响器械表面附着的细菌数量。
脊柱内固定术后早期深部感染清创术后最主要目的就是控制感染、减少术后感染复发,而双手术间模式很好地实现了这个目标。双手术间组的术后感染复发率仅为2.78%(1/36),远远低于双手术台组16.67%(5/30)和对照组21.67%(13/60)的复发率,而低感染复发率也会增加伤口的愈合率,伤口甲级愈合率达到了97.22%(35/36),也远高于其余2组。同时,双手术间组的住院时间虽然与双手术台组类似,但明显低于对照组,这与优异的感染控制效果和伤口愈合率有助于患者早日痊愈出院有关,具有良好的社会效益。
3.3双手术间清创模式执行过程中的注意事项 双手术台和单手术台模式均属于单手术间模式,患者始终保持俯卧位,无需更换体位,手术前均细致检查确保无误,术中一般对身体各种管道的影响较小。但双手术间模式则不同,它需要将患者转运至另一个手术间,转运方法较繁琐,存在患者生命体征变化或辅助管道松脱的隐患。但笔者发现3组患者之间各种常见的麻醉或护理不良事件比较,差异无统计学意义,并未发现双手术间模式会增加这些不良事件的机率。这可能与该过程中的特殊转运方法有关,患者保持俯卧位平移至转运车,再呈俯卧位平移至另一手术床,这就避免患者转运时翻身可能导致的气管插管、静脉导管或导尿管脱位或松动等不良事件的发生,所以只要足够细心,该转运方式的安全性是可以保证的。
另外,双手术间转换势必会增加整个手术时间,双手术间组的手术时间达到(177.08±39.41)min,相比其余两组,需额外增加40~60 min,这可能与开展的数量较为有限有关,随着经验的积累和规范,可能会大大缩短转运时间,提高转运的安全性。另外众所周知,手术时间的延长必然会相应增加出血量,但本研究中,不同手术间转运时伤口预先进行纱布填塞及手术无菌膜密封,这可以减少该时间段内的伤口渗血量,与其余2组比较,出血量并无显著增加。
3.4双手术间清创模式的不足 首先,双手术间模式需增加转运过程中的物品使用及麻醉与手术时间,这必然会导致手术费用的增加,该组中手术费用(8 718.75±1 716.34)元,高于其余2组。其次,脊柱内固定术后早期深部感染控制除与手术技术和术中配合有关,尚与菌种类型、感染时间及术后抗感染处理有关,限于纳入的病例有限无法对其余影响因素进行阐述,需后期进一步研究。
综上所述,双手术间清创模式治疗脊柱内固定术后早期深部感染,虽然可能会增加手术配合的难度,但可以减少手术室内细菌气溶胶的传播,继而控制术后感染复发率,相比单手术间清创模式具有优势。

