枸杞真空冷冻干燥动力学的数值模拟及分析
曾 涛,刘 斌,石胜强,毕丽森,胡恒祥,李 睿
枸杞真空冷冻干燥动力学的数值模拟及分析
曾 涛,刘 斌※,石胜强,毕丽森,胡恒祥,李 睿
(天津商业大学机械工程学院,天津市制冷技术重点实验室,天津 300134)
为探究枸杞真空冷冻干燥过程中的热质迁移,克服应力应变现象不能直观获取的问题,该研究通过对鲜枸杞切片试验图像二值化处理,建立了鲜枸杞真空冷冻干燥的热-质-结构耦合的物理模型,对真空冷冻干燥过程中枸杞温度变化、水分变化以及其内部的应力应变进行了热-质-力耦合分析,并对分析结果进行试验验证。模拟分析结果表明,预冻结过程中,细胞始终在膨胀,当细胞完全冻结时细胞所受应力达到最大,而干燥阶段热质传递对应力影响较小。提高真空冷冻干燥过程中的升温速率,在一定程度上能够缩短冻干所需时间,并且真空冷冻干燥过程中的枸杞样本的含水率下降速率随干燥时间的增大而减小,该变化趋势与Wang and Singh模型更加贴合(2为0.983)。试验验证结果表明,该研究建立的模型能够较好反映并预测真空冷冻干燥过程枸杞样本的温度及应力应变的变化趋势(2为0.857)。研究结果可为真空冷冻干燥系统优化和工艺参数的科学制定提供参考。
动力学;数值模拟;真空冷冻干燥;传热传质;应力应变
0 引 言
对于干燥而言,诸如自然太阳干燥、机械热风干燥等方式已经无法满足消费者对于产品更高品质的需求,真空冷冻干燥技术逐渐吸引研究人员的关注[1-4],但由于真空冷冻干燥过程中传热传质的复杂性以及样品细胞变化的不确定性,通过试验分析很难提取和获得更多关于真空冷冻干燥过程的信息[5],而通过建立物理模型和数学模型对真空冷冻干燥过程进行数值模拟可以获得干燥样本的温度[6]、水分[7]和应力分布[8],以此来更好地理解真空冷冻干燥过程中样本细胞的变化以及样本中水分的输运过程。
目前,已经有学者采用数值模拟方法对真空冷冻干燥动力学开展了研究,段智英等[9]运用格子 Boltzmann 方法和动力学能量守恒定律,模拟分析了果蔬冻干水分扩散速率变化分布情况,建立了孔隙度线性变化的多孔介质模型,结果表明多孔介质类果蔬孔隙度变化越大冻干速率就越大。陈彩胜[10]通过采用COMSOL Multiphysics软件对低温低压下多孔性物料内的传热传质过程进行了数值模拟研究,其基于广义Carnot热机模型分析了前、后处理以及干燥环境对于真空冷冻干燥过程中物料的干燥程度的影响。牛利娇等[11]构建了一种局部质量非平衡的多孔介质真空冷冻干燥的热质耦合模型,并将该模型的求解结果与试验结果进行比较后发现,求解结果与试验结果高度吻合,模型具有很好的预测性。WANG等[12]在试验的基础上推导出了一种传热传质耦合的二维数学模型,并测试了蒸汽压与饱和值之间的三种吸附-解吸平衡关系,他们发现当指数形式的开尔文吸附平衡方程的参数为5 000时,该方程作用下的模型预测和试验测量之间具有很好的一致性。此外他们模型模拟的结果表明,同时增强真空冷冻干燥过程中的质量和热传递有望实现真空冷冻干燥的强化。WARNING 等[13]建立了一个具有分布式升华前沿的多孔介质传输模型,该模型可用于通过表面辐射加热和体积微波加热对牛肉进行低压冷冻干燥的过程中。模型中升华前沿的宽度随着冰饱和度的降低而增加。他们通过升华前沿的缓慢移动观察到了孔隙中气体部分的绝缘效果,这在一定程度上证明了这种分布式升华表述的重要性,并与文献中普遍采用的尖锐的升华前沿形成对比。
尽管对于真空冷冻干燥过程中的传热传质问题,目前已有不少数值模拟研究,但以枸杞为干燥样本,建立热-质-力耦合模型的研究较少,尤其是对于预冻结阶段的应力应变研究甚少。真空冷冻干燥是提高枸杞保质期的前沿技术之一,干燥过程中枸杞内部发生的热-质-应力的耦合是决定高品质的关键。因此,本文围绕真空冷冻干燥过程中枸杞样本的传热传质、应力应变展开研究,建立了枸杞真空冷冻干燥的热-质-结构耦合的物理模型,探讨枸杞真空冷冻干燥过程的干燥机制和内部结构变化,为真空冷冻干燥装置的设计优化和真空冷冻干燥工艺的强化提供理论指导。
1 材料与方法
1.1 模拟方法
图1展示了从试验观察到的枸杞显微图像中获取多孔介质物理模型的整个流程。在该流程中,首先将新鲜枸杞切成2 mm厚的薄片,并通过奥林巴斯-51显微镜对切片样本进行放大100倍观察以获得枸杞样本细胞的显微图像,1 000 μm×900 μm的方形图像(图1c),在获得显微图像的基础上,采用Image-Pro Plus对图像进行处理[14-15]以便于后续对得到的原始图像进行测量和分析,所获得图片如图1d、1e、1f,最后对二值显微图像进行锐化处理并将其导入到COMSOL 5.6软件中,构建枸杞样本多孔介质物理模型(图1g),模型中多孔介质的骨架为样本细胞的细胞壁,多孔介质的孔隙为样本细胞的间隙。
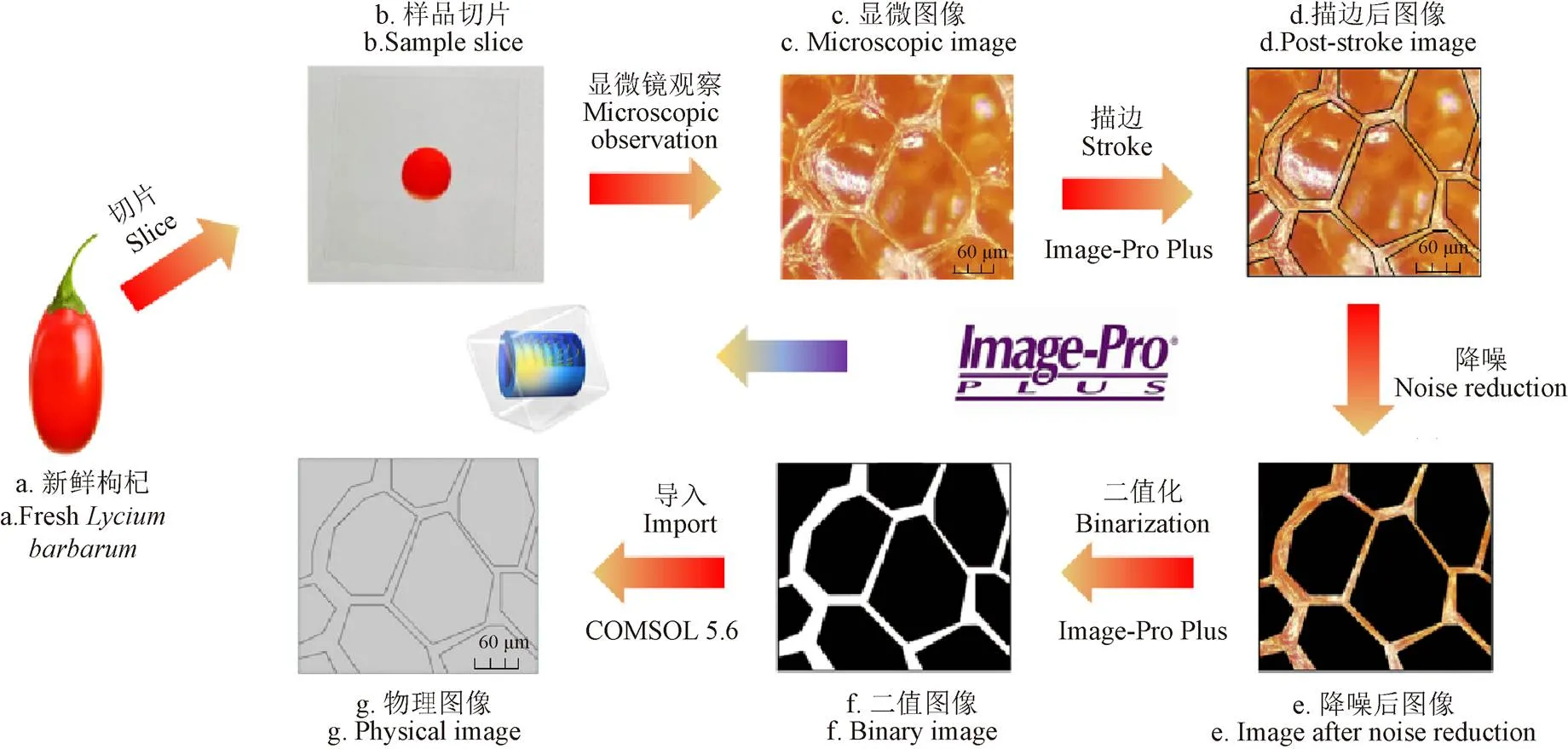
图1 获取枸杞样本物理模型的系统流程图
在本研究的物理场选择中,温度-水分传输分析和应力-应变分析分别采用传热模块和结构力学模块。温度-水分传输的结果可以直接耦合到应力-应变模型(固体结构力学)中,以获得应力-应变分布结果。通过这种方式,将热质传递和应力应变模型纳入COMSOL Multiphysics 5.6软件,以获得温度-湿度分布和应力-应变分布结果。PARDISO直接求解器用于求解所有相的温度、应力应变以及弹性位移。
模拟计算网格的独立性计算如表1和图2。为了确认所采用的网格可以获得独立于网格的解决方案,本文采用ROACHE等[16]提出的网格收敛指数(grid convergence index,CI)方法,CI为网格相对最优解收敛误差的无量纲指标,以样本1为例,计算干燥21 h后的枸杞平均温度以及模型网格的CI,如表1所示。从表1中可以看出,方案2和3的CI均小于5%,且二者的渐近分布都约为1,表明方案2和3都可以得到独立于网格的解[17]。由于计算时间又会随着网格数量的增加而显著增加,因此,本文模拟采用方案2对模型进行求解,如图2所示。网格单元质量为0.892 6,网格单元数为11 564个。在计算离散区域时,采用三角形网格并在边界处进行细化处理。求解过程中,输出步长设置为1 h,当相对容差小于0.01时,认为解在当前时间步长内收敛,并开始计算下一时间步长。
1.2 控制方程
真空冷冻干燥过程包含预冻结、升华干燥和解析干燥3个阶段,为简化各阶段的控制方程,本研究作如下假设:1)预冻结阶段枸杞样本内部为各向同性且各物性参数恒定,样本内部的传质忽略不计;2)升华干燥阶段枸杞样本升华界面上水蒸气和冰无热量交换,冻结区域内无不凝性气体且无传质现象发生,惰性气体对干燥区域的影响忽略不计;3)整个干燥(升华干燥和解析干燥)阶段样本孔隙中的气体可看作理想气体且与枸杞固体骨架无热量交换,物料的各物性参数恒定。

表1 模型网格独立性分析

图2 模型不同计算区域网格划分
基于上述假设,真空冷冻干燥模拟过程中各阶段的控制方程如下所述:
1.2.1 预冻结阶段
枸杞样本预冻结阶段的控制方程包括导热微分方程以及热质耦合的能量平衡方程。
根据Fourier[18-19]定律,导热微分方程可表述为

式中1(,,,)为时刻枸杞内部点(,,)处的温度,℃;为热扩散率,m2/s;为枸杞样本所占据的空间区域。
由于预冻过程,鲜枸杞表面水蒸气分压力与干燥腔体内水蒸气分压力差较小,枸杞样本冻结界面上仅有能量传递[20],根据能量守恒定律,冻结界面上的能量平衡方程可表述为

式中为水的凝固潜热,J/kg;M为枸杞样本的含水率,%;为枸杞样本的导热系数,W/(m·K);1为干燥区的温度,℃;2为冻结区的温度,℃;为界面的单位法向量。
预冻结过程中发生热湿弹性形变,以-平面为例,应力应变方程表述为


式中ε为因温度改变导致的应变;ε为因含水率改变导致的应变;为热膨胀系数;为湿膨胀系数;为任意时刻温度,K;为任意时刻干基含水率,kg/kg;0为初始时刻温度,K;0为初始时刻干基含水率,kg/kg。

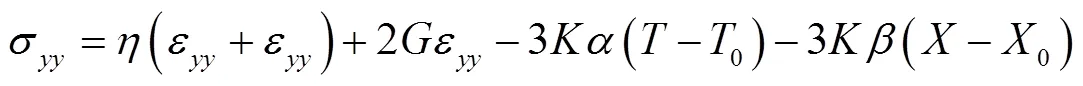

式中σ、σ和τ分别表示方向正应力、方向正应力和切应力,Pa;、为拉梅常数,Pa;ε、ε和ε分别表示方向正应变、方向正应变和切应变;为体积弹性模量,Pa。
1.2.2 升华干燥阶段
枸杞样本升华干燥阶段的控制方程[21]主要包括干燥区的传质方程、干燥区的传热方程以及升华界面的能量平衡方程。
干燥区的传质方程为

式中N为方向水蒸气通量,kg/(m2·s);N为方向水蒸气通量,kg/(m2·s);N为方向水蒸气通量,kg/(m2·s);为枸杞样本干燥区的孔隙率;C为枸杞样本干燥区水蒸气浓度,kg/m3;C为枸杞样本干燥区结合水含量,kg/m3。
干燥区的传热方程为



界面的能量平衡方程为

式中∆H为冰的蒸发潜热,J/kg;1为枸杞样本干燥区的密度,kg/m3;2为枸杞样本冻结区的密度,kg/m3;()为升华界面的面积,m2;2为冻结区的导热系数,W/(m·K)。
1.2.3 解析干燥阶段
枸杞样本解析干燥阶段的控制方程[22]包括传质以及传热方程。
传质方程为


式中P为枸杞样本的水蒸气分压,Pa;1e为水蒸气的有效扩散系数,m2/s;1e=1+2w;1为水蒸气的主体扩散系数,m2/s;2为水蒸气的自身扩散系数,m2/s;为枸杞样本干燥区的孔隙率;T1为枸杞样本的温度,K;为理想气体常数,即8.314 J/(K·mol);M为水蒸气的摩尔质量,即18 g/mol;为时刻温度,℃。
传热方程为


式中T1为枸杞样本的温度,K;1为枸杞样本的热扩散率,m2/s;C为水蒸气的比热容,J/(kg·K);1e为水蒸气的有效扩散系数,m2/s;1e为水蒸气的密度,kg/m3;∆H为水的蒸发潜热,J/kg;C为枸杞样本固体骨架的比热容,J/(kg·K)。
1.3 模拟设定参数
表2为模拟设定的真空冷冻干燥工艺参数,由试验结果可知,枸杞共晶点温度在-19.2℃左右,一般预冻温度要比共晶点温度低10~20℃,同时,考虑到热损失,本文选择预冻结温度为-40℃。为更清晰了解真空冷冻干燥过程的传热机制,本模拟对样本1和样本2采用两种不同升温策略(5、10 ℃/h),研究不同升温速率对枸杞干燥时间的影响及提高试验验证准确性。当两个样本的温度升至40 ℃后保持恒温。表3为模拟设定的样本物性参数,这其中枸杞样本的密度通过称量样本质量和样本体积获得,样本的导热系数以及样本的蓄热系数采用C-THERM TCi导热系数分析仪(C-THERM公司,加拿大)得到。样本的比热容以及扩散率具体如式(13)~(14)所示。


式中为枸杞样本比热容,J/(kg·K);为枸杞样本蓄热系数,W·s1/2/(m·K),为枸杞样本导热系数,W/(m·K);为枸杞样本密度,kg/m3;为枸杞样本热扩散率,m2/s。
细胞内液态水视为不可压缩流体,因而细胞内液态水泊松比ν为0.5。细胞壁杨氏模量以及细胞壁泊松比采用SMS质构分析仪获取,具体如式(15)~(16)所示。


式中为回弹时应力应变比值,为杨氏模量,kPa,为细胞壁泊松比。

表2 数值模拟参数

表3 真空冷冻干燥数值模拟输入参数
1.4 试验装置
LGJ-20F真空冷冻干燥机(北京松源华兴科技有限公司);BCD-118TMPA低温冰箱(德国西门子股份公司);DSCQ1000差式扫描热量仪(美国TA INSTRUMENTS公司);AB135-S型分析天平(梅特勒-托利多仪器(上海)有限公司,精度:0.01 mg);FDCS196冷热台(英国林曼克有限公司,工作温度范围-196~125 ℃);奥林巴斯-51显微镜(奥林巴斯株式会社);VT1000S振动切片机(德国徕卡微系统有限公司);PT100热电偶(德国工业标准A级0.1 ℃,探头直径1.5 mm)。
1.5 试验材料和方法
1.5.1 共晶点测量
将枸杞样品切块,并使用分析天平确保样品质量在15~20 mg,再用镊子将其平整放于坩埚内,然后使用压片机进行压片,最后放入差式扫描热量仪DSCQ1000中设置冻结速率进行共晶点温度测定。通过选取不同的枸杞切块进行3组试验,每组试验重复2次,从而获得DSC测量的枸杞热流曲线图。
1.5.2 温度变化
选用置于5 ℃冰箱中宁夏当地生产的新鲜无损伤的枸杞。将枸杞样品放入干燥室,关紧密封装置并启动装置;当预冻结阶段温度恒定在-40 ℃左右时抽真空;设置真空度为50 Pa,设定两种不同的升温速率(5、10 ℃/h)并当加热板温度达到40 ℃后保持恒温。如图3所示,整个过程中通过将干燥室内置的热电偶插入枸杞内部从而实时监测枸杞样品内部的温度。

图3 干燥室内枸杞温度测量示意图
1.5.3 细胞形态观察
真空冷冻干燥显微镜系统如图4所示。使用振动切片机将新鲜枸杞切成3 mm的薄片并将待测样品放入载物台拧紧密封盖,通过Linkam软件精确控制冷热台温度快速降温到-40 ℃,设置真空度为50 Pa,使用显微镜以及CCD照相机获得枸杞细胞的实时图像。

1.泄压阀 2.冷热台温度控制系统 3.CCD照相机 4.计算机 5.真空泵 6.真空规 7.液氮罐 8.显微镜 9.FDCS196冷热台
使用Excel 2015软件和Origin 2018软件进行试验数据处理、分析与绘图。
2 结果与分析
2.1 模型温度变化分析
真空冷冻干燥模拟过程中样本1和样本2温度随干燥时间的变化如图5所示。从图5中可以看出,样本1的整个干燥过程持续时间约为21.0 h,其中预冻结阶段持续时间约为4.2 h,升华干燥阶段持续时间约为10 h,解析干燥阶段持续时间约为5.9 h。样本2的整个干燥过程持续时间约为14.1 h,其中预冻结阶段持续时间约为5 h,升华干燥阶段持续时间约为5.9 h,解析干燥阶段持续时间约为3.5 h。尽管干燥过程中样本1和样本2的温度变化趋势较为相似,但两者完成干燥所需的时间差异明显。样本2完成干燥所需时间(14.1 h)明显小于样本1(21.0 h)。提高升温速率能够有效降低干燥时间,与前人的研究[23-25]结果一致。

图5 真空冷冻干燥模拟过程中样本1和样本2温度随干燥时间的变化
图6和图7分别为真空冷冻干燥模拟过程中样本1、样本2内部温度随干燥时间变化的云图(以-平面为例)。图6中,4 h时样本1处于降温阶段,此时样本1四周边缘的温度低于中心细胞的温度,热量从组织细胞中心向样本组织细胞外边缘迁移。5 h后,样本1处于干燥阶段,其温度迅速上升(5 ℃/h),且四周边缘的温度高于中心温度,热量从样本组织细胞外边缘向组织细胞中心迁移。

图6 真空冷冻干燥模拟过程中样本1内部温度云图
对于样本2而言,降温阶段和干燥阶段中,样本2的温度分布(图7)以及热量迁移与样本1类似,这里不再作详细描述。需特别指出的是,当干燥时间为12 h时,样本2的平均温度约为10 ℃,而此时样本1的平均温度约为-0.4 ℃,这是由于样本2干燥升温速率的提升(10 ℃/h)所引起的。14 h后,由于样本2的平均温度约为35.7 ℃且保持恒定,可认为样本2的干燥过程结束,而此时样本1的干燥过程还在继续(样本平均温度继续上升),说明干燥升温速率的提升可以在一定程度上缩短干燥完成所需时间,这一点也可以从样本内部温度云图(图6,图7)中得到验证。

图7 真空冷冻干燥模拟过程中样本2内部温度云图
2.2 模型应力应变分析
在真空冷冻干燥过程中,样本细胞组织2次受到外部因素的影响产生应力应变。第一次是预冻结过程中,随着温度的下降,样本内部的水分结晶使得样本细胞组织膨胀。第二次是升华干燥前的抽真空过程中,样本细胞组织受真空度的影响而产生形变。然而由于抽真空的时间过短,模型受到的应力快速增大且难以维持恒定,同时模型网格极易发生扭转使得模拟难以收敛。因此本模拟仅讨论预冻结过程样本细胞组织的应力应变。预冻结过程样本2和样本1的应力应变相似,因此仅以样本1为例对预冻结过程样本细胞组织的应力应变进行分析。
图8为预冻结过程中样本1内细胞组织的应力应变云图(以-平面为例)。从图中可以发现,当预冻结时间为14 min时,细胞内的水分大多以游离水的形式存在,此时由于细胞间隙以及细胞壁支撑组织的原因,细胞边缘所受的应力比细胞内部更大。20 min时,细胞组织内开始有少量冰晶形成,样本的整体应力逐渐增大,同时可以发现部分细胞发生形变(黑线描绘轮廓为细胞初始所在位置及形状)。26 min时,可以清晰看出绝大多数细胞发生形变并且样本的整体形态发生变化。32 min时,样本细胞组织中的水完全结晶,所有细胞均发生形变并且样本整体形态发生进一步改变,此时样本的整体应力达到最大。




注:0和0分别为新鲜枸杞细胞的等效长度和等效直径,μm;L和D分别为干燥后枸杞细胞的等效长度和等效直径,μm。
Note:0and0are the equivalent length and diameter of freshcells, μm;LandDare the equivalent length and diameter of driedcells, μm.
图8 预冻结过程中样本1内细胞组织的应力应变云图
Fig.8 Nephogram of stress-strain of cell tissues in sample 1 during the process of pre-freezing




注:A为细胞横截面面积,μm2;P为细胞横截面周长,μm。
需重点指出的是,图10中S、S为负值表明预冻结过程中细胞的长度与等效直径是在增大的,这是因为预冻结过程中,随着温度的下降,细胞中水分结晶使得细胞的体积膨胀,因此图中S为正值,细胞表现出增长的趋势。从图中可以看出,在冻结时间小于32 min时,细胞的长度,等效直径以及形状系数随着冻结时间的增加而增加且增长速率逐渐提高,这与上述细胞应力应变分析相一致。当冻结时间为32 min时,由于细胞中的水分完全结晶,样本组织细胞体积几乎不再发生变化,此时形状系数增长率达到最大值,约为6.8%。

图10 预冻结过程中样本1内组织细胞的收缩率和形状系数增长率
2.3 模型含水率分析
目前无法通过试验获得真空冷冻干燥过程中枸杞内部的水分,其只能通过数学模型来模拟预测。因此,本研究在模拟的基础上,对真空冷冻干燥过程中枸杞样本内部的含水率进行了分析,结果如图11所示。同时为验证模拟数值的准确性,本研究将模拟数值与Henderson and Pabis和Wang and Singh[28-29]两种不同干燥模型进行比较,比较的统计分析结果如表4所示。由于真空冷冻干燥过程中样本2与样本1的含水率变化趋势基本一致,这里仅以样本1为例展开分析。对于样本1而言,0~4 h 为预冻结阶段(图5),该阶段样本中含水率几乎保持不变,因此这里仅分析含水率变化大的干燥阶段(4 h~21 h)。从图11中可知,样本含水率随着干燥时间的增长而逐渐下降,且4~14 h时间段的下降速率(9.15%/h)明显快于14~21 h时间段的下降速率(5.5%/h)。4~14 h时,样本内部大量的自由水快速升华使得样本的含水率快速下降至10%以下。14~21 h时,样本组织细胞内部仅剩结合水。由于结合水吸附在枸杞物料的纤维壁、纤维毛细管、细胞及极性基团上,其难以被解析脱附而逸出,因此该阶段含水率的下降速率迅速下降[30]。

图11 真空冷冻干燥模拟过程中样本1的含水率变化
两种干燥动力学模型的干燥常数以及其与模拟数值比较的统计分析结果如表4所示。从表中可以看出两种模型与模拟值都均有良好的贴合性,即二者与都有极高的决定系数(0.983和0.991),以及较低的均方根误差(0.105和0.028)。相对而言,Wang and Singh模型更加贴合本文的模拟。

表4 两种干燥动力学模型与模拟比较的统计分析结果
3 试验验证
3.1 样本温度变化分析
图12所示为DSC测量的枸杞热流曲线图,从图中可以看出随着温度的下降,热流起初保持不变,但当温度低于-15 ℃时,热流陡然发生突变,并在-18~-20 ℃时达到峰值。因此枸杞的共晶点温度在-19.2 ℃左右,试验中枸杞样品在低于-20 ℃后水分完全冻结成冰晶,形成共晶体后只存在温度变化。
图13为真空冷冻干燥过程中样本1、样本2内部温度变化的试验值与模拟值的比较,可以看出样本1和样本2温度的试验与模拟结果的决定系数(2)分别为0.857以及0.669,这说明模拟样本1的温度变化与试验拟合度高,模拟样本2的温度变化与试验较为吻合,说明模拟结果能够较好反映并预测试验温度的变化趋势。同时,从图中可以看出预冻结阶段模拟样本的温度变化稍滞后于试验,这主要是因为试验中隔板温度设定在-40 ℃上下波动,枸杞样品的温度迅速降低至目标值,且由于抽真空的影响温度在降至目标值后还将持续波动约2~3 h,而进行模拟时,预冻结降温过程中温度设定为线性下降,且无法模拟抽真空过程,因此模拟与试验的降温过程稍有差距[31]。

图12 DSC测量的枸杞热流曲线图
3.2 样本应力应变分析
图14为预冻结试验过程中样本1内细胞组织形态变化图,为清晰地表现细胞随着温度降低的变化,用实线描绘出了显微镜视野内一个完整的细胞轮廓。从图中可以看出,随着样本温度的下降,细胞形状逐渐变圆,且其位置也随之发生变化,这与预冻结过程中样本细胞应力应变模拟的结果一致。当温度达到共晶点附近时,细胞内部开始有树枝状冰晶形成,如图14c所示。此后,随着温度的继续下降,细胞内树枝状冰晶不断扩散,且相邻冰晶不断连接直到细胞内的水全部结冰,如图14d所示,此时细胞所受应力达到最大。此外,由于光的散射,样本细胞被完全冻结时,显微视野瞬间变暗,这与张哲等[32]研究结果一致。

图13 样本1、样本2内部温度的试验和模拟结果的比较

注:实线为完整细胞轮廓变化;虚线为冰晶产生区域。
4 结 论
本研究采用了数值模拟的方法探究了真空冷冻干燥过程中下枸杞的传热传质以及应力应变,并通过试验进行验证,得到的结论如下:
1)真空冷冻干燥模拟过程中样本的温度变化与试验拟合度较好,样本1和样本2的试验与模拟结果的决定系数分别为0.857及0.669,表明此模型能够较好反映并预测真空冷冻干燥过程枸杞样本的温度的变化趋势。
2)模拟预冻结过程中,枸杞样本组织细胞的长度收缩率(S)与等效直径收缩率(S)一直为负值,表明细胞始终在膨胀,细胞的形状系数(S)一直在增大,当细胞完全冻结时细胞的形状系数增长率达到最大为6.8%,同时细胞所受应力达到最大。试验过程中,随着样本温度的下降,细胞形状逐渐变圆,且其位置也随之发生变化,这与模拟过程中样本细胞应力应变的分析结果一致。
3)真空冷冻干燥模拟过程中的枸杞样本的含水率的下降速率随干燥时间的增大而减小。Wang and Singh模型以及Henderson and Pabis模型都与模拟结果有非常良好的贴合性,但相对而言,Wang and Singh模型更加贴合,其具有更大的决定系数(0.991)及更小均方根误差(0.028)。
4)本文建立的模型可以对真空冷冻干燥过程预测,根据模拟结果制定枸杞干燥最佳工艺参数。
对于真空冷冻干燥,升华阶段水分逐渐蒸发一直到解析阶段体积又要逐渐变小,这对细胞结构的应力应变有着重要影响,关于升华干燥阶段的模拟以及时间步长选择与网格尺寸间的匹配选择仍需要更深入和全面的研究。结论可为真空冷冻干燥系统优化和工艺参数的科学制定提供参考。
[1] 马有川,毕金峰,易建勇,等. 预冻对苹果片真空冷冻干燥特性及品质的影响[J]. 农业工程学报,2020,36(18):241-250. MA Youchuan, BI Jinfeng, YI Jianyong, et al. Effect of pre-freezing on vacuum freeze-drying characteristics and quality of apple slices[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(18): 241-250. (in Chinese with English abstract)
[2] 谢焕雄,胡志超,王海鸥,等. 真空冷冻干燥对柠檬挥发性风味化合物保留的影响[J]. 农业工程学报,2018,34(22):282-290. XIE Huanxiong, HU Zhichao, WANG Haiou, et al. Effect of vacuum freeze drying on the retention of volatile flavor compounds in lemon[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(22): 282-290. (in Chinese with English abstract)
[3] YUAN L, LAO F, SHI X, et al. Effects of cold plasma, high hydrostatic pressure, ultrasound, and high-pressure carbon dioxide pretreatments on the quality characteristics of vacuum freeze-dried jujube slices[J]. Ultrasonics Sonochemistry, 2022, 90: 106219-106219
[4] 颜建春,胡志超,吴朋来,等. 热板-微波联合真空冷冻干燥茭白工艺优化[J]. 农业工程学报,2017,33(1):262-270. YAN Jianchun, HU Zhichao, WU Penglai, et al. Optimization of vacuum freeze drying of Zizania caduciflora with hot plate and microwave[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(1): 262-270. (in Chinese with English abstract)
[5] CASTRO A M, MAYORGA E Y, MORENO F L. Mathematical modelling of convective drying of fruits: A review[J]. Journal of Food Engineering, 2018, 223: 152-167.
[6] 张彤,余克志,张得正. 火龙果真空冷冻干燥的模拟分析和实验研究[J]. 制冷学报,2022,43(2):142-150. ZHANG Tong, YU Kezhi, ZHANG Dezheng. Simulation analysis and experimental study on vacuum freeze drying of dragon fruit[J]. Journal of Refrigeration, 2022, 43(2): 142-150. (in Chinese with English abstract)
[7] 李晓斌,郭玉明,崔清亮,等. 用图像法分析茄子在冻干过程中的水分动态运移规律[J]. 农业工程学报,2016,32(1):304-311. LI Xiaobin, GUO Yuming, CUI Qingliang, et al. The dynamic movement of water in eggplant during freeze-drying was analyzed by image method[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(1): 304-311. (in Chinese with English abstract)
[8] ALEXANDER D, WARNING J M R, ASHIM K D. A multiphase porous medium transport model with distributed sublimation front to simulate vacuum freeze drying[J]. Food and Bioproducts Processing, 2015, 94: 637-648
[9] 段智英,郭玉明,王福贵. 基于格子Boltzmann方法分析果蔬真空冷冻干燥冻干速率[J]. 农业工程学报,2016,32(14):258-264. DUAN Zhiying, GUO Yuming, WANG Fugui. Analysis of vacuum freeze drying rate of fruits and vegetables based on lattice boltzmann method[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(14): 258-264. (in Chinese with English abstract)
[10] 陈彩胜. 多孔物料真空冷冻干燥过程热力学分析[D]. 兰州:兰州理工大学,2019. CHEN Caisheng. Thermodynamic Analysis of Vacuum Freeze Drying Process of Porous Materials[D]. Lanzhou: Lanzhou University of Technology, 2019. (in Chinese with English abstract)
[11] 牛利娇,王维,潘思麒,等. 具有预制孔隙多孔介质冷冻干燥的多相传递模型[J]. 化工学报,2017,68(5):1833-1844. NIU Lijiao, WANG Wei, PAN Siqi, et al. Multiphase transfer model for freeze drying of prefabricated porous media[J]. Journal of Chemical Engineering, 2017, 68(5): 1833-1844. (in Chinese with English abstract)
[12] WANG W, HU D, PAN Y, et al. Numerical investigation on freeze-drying of aqueous material frozen with pre-built pores[J]. Chinese Journal of Chemical Engineering, 2016, 24(1): 116-125.
[13] WARNING A D, ARQUIZA J M R, DATTA A K. A multiphase porous medium transport model with distributed sublimation front to simulate vacuum freeze drying[J]. Food and Bioproducts Processing, 2015, 94: 637-648.
[14] 张西龙. 低温真空环境下生命材料种子水分迁移微观结构研究[D]. 天津:天津商业大学,2020. ZHANG Xilong. Study on Microstructure of Water Transport of Living Materials Seeds in Low Temperature and Vacuum Environment[D]. Tianjin: Tianjin University of Commerce, 2020. (in Chinese with English abstract)
[15] 王美霞. 弱势差下含湿多孔介质的水分迁移分形研究[D]. 天津:天津商业大学,2018. WANG Meixia. Fractal Study of Water Migration in Wet Porous Media under Weak Difference[D]. Tianjin: Tianjin University of Commerce, 2018. (in Chinese with English abstract)
[16] ROACHE P J. Quantification of uncertainty in computational fluid dynamics[J]. Annual Review of Fluid Mechanics, 1997, 29(1): 123-160.
[17] SELIMEFENDIGIL F, COBAN S O, ÖZTOP H F. Numerical analysis of heat and mass transfer of a moving porous moist object in a two dimensional channel[J]. International Communications in Heat and Mass Transfer, 2021, 121: 105093.
[18] 郝新生,郭玉明,崔清亮. 茄子冷冻干燥冻结过程模型的建立与求解[J]. 农业工程学报,2010,26(5):335-341. HAO Xinsheng, GUO Yuming, CUI Qingliang. Establishment and solution of freezing process model of eggplant freeze-drying[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2010, 26(5): 335-341. (in Chinese with English abstract)
[19] 王明新. 数学物理方程[M]. 北京:清华大学出版社,2006.
[20] 郝新生,郭玉明,崔清亮. 球形果蔬物料冷冻干燥过程冻结模型的建立与求解[C]// 纪念中国农业工程学会成立30周年暨中国农业工程学会2009年学术年会(CSAE 2009)论文集,太古,2009:1466-1470.
[21] TRELEA I C, FONSECA F, PASSOT S. Dynamic modeling of the secondary drying stage of freeze drying reveals distinct desorption kinetics for bound water[J]. Drying Technology, 2016, 34(3): 335-345.
[22] WEAL M E, ABD El-Rahman Bedir, MOHAMED Elhelw, et al. Freeze-drying modeling via multi-phase porous media transport model[J]. International Journal of Thermal Sciences, 2019, 135: 509-522
[23] XIE L, MUJUNDAR A S, FANG X M, et al. Far-infrared radiation heating assisted pulsed vacuum drying (FIR-PVD) of wolfberry (): Effects on drying kinetics and quality attributes[J]. Food and Bioproducts Processing, 2017, 102: 320-331.
[24] 史德芳,范秀芝,殷朝敏,等. 基于能耗分析的真空冷冻干燥食用菌汤块制备中试[J]. 农业工程学报,2021,37(10):253-260. SHI Defang, FAN Xiuzhi, YIN Chaomin, et al. Pilot-scale preparation of vacuum freeze-dried edible mushroom soup based on energy consumption analysis[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(10): 253-260. (in Chinese with English abstract)
[25] RUSSO P, ADILETTA G, di MATTEO MARISA, et al. The effect of abrasive pretreatment on the drying kinetics and phenolic compounds in goji berries[J]. Journal of Food Processing and Preservation, 2020, 44(12): 14933
[26] GRUBER S, THOMIK M, NICOLE V H, et al. The influence of local microstructure inhomogeneities on local drying kinetics during freeze-drying[J]. Pharmaceutics, 2022, 14(10): 2132
[27] EREAN K, SENCER B. Modeling and predicting the drying kinetics of apple and pear: Application of the weibull model[J]. Chemical Engineering Communications, 2017, 204(5): 573-579.
[28] GHODAKE H M, GOSWAMI T K, CHAKRAVERTY A. Mathematical modeling of withering characteristics of tea leaves[J]. Drying Technology, 2006, 24(2): 159-164.
[29] DOYMAZ I. Convective drying kinetics of strawberry[J]. Chemical Engineering and Processing: Process Intensification, 2008, 47(5): 914-919.
[30] JOARDDER M U H, MOURSHED M, MASUD M H. State of Bound Water: Measurement and Significance in Food Processing[M]. Germany: Springer International Publishing, 2019.
[31] MOKHOVA E, GORDIENKO M, MENSHUTINA N. Mathematical model of freeze drying taking into account uneven heat and mass transfer over the volume of the working chamber[J]. Drying Technology, 2022, 40(12): 2470-2493
[32] 张哲,赵静,田津津,等. 冷冻-复温过程中葡萄细胞结晶变化研究[J]. 农业机械学报,2016,47(5):211-217. ZHANG Zhe, ZHAO Jing, TIAN Jinjin, et al. Study on the crystallization changes of grape cells during freezing-rewarming[J]. Transactions of the Chinese Society of Agricultural Machinery, 2016. 47(5): 211-217. (in Chinese with English abstract)
Numerical simulation and analysis of the vacuum freeze drying kinetics of
ZENG Tao, LIU Bin※, SHI Shengqiang, BI Lisen, HU Hengxiang, LI Rui
(,,300134,)
is one of the most popular herbs in China. The high medicinal value can serve as a functional food rich in nutrients (such as polysaccharides, plant flavonoids, and carotenoids), further promoting glucose and lipid metabolism for better immune system, and mental efficiency, and even preventing neurodegeneration. The berry fruits with high water content can be dried to improve their shelf life using vacuum freeze drying. In this study, a numerical simulation was carried out to explore the heat and mass transfer, stress, and strain ofduring freeze-vacuum drying. Among them, the heat and mass transfer was a benefit to exploring the drying mechanism offreeze during vacuum drying. The stress and strain was to explore the cellular changes offreeze-vacuum during drying. The temperature experiment was carried out by vacuum freeze dryer. The pre-freezing stage was set at -40 ℃ for about 4 hours, then the vacuum was drawn at two heating rates (5, and 10 ℃/h). The constant temperature was maintained when the heating plate temperature reached 40 ℃. The cell change experiment was carried out by FDCS196 hot and cold table. The whole process was combined with the microscope and CCD camera, in order to obtain the real-time image of berry cells. The heat-mass-stress coupling of the drying was dominated by the high quality of the products. The heat-mass-structure coupling model during vacuum freeze drying was established to use binarization processing using the experimental image of fresh berry slices. The temperature, moisture, as well as internal stress, and strain of the fresh berry sample, were analyzed and then verified by experiments during vacuum freeze drying. The results showed that the length shrinkage (S) and equivalent diameter contraction (S) of berry tissue cells were always negative during the pre-freezing process, indicating the ever-expanding cells. By contrast, the cell shape coefficient (S) was increasing all the time. At the same time, the maximum stress was found on the cells, when the cells were completely frozen. The moisture of the sample during the simulation was fitted better with the WangandSingh and HendersonandPabis models, indicating the more suitable WangandSingh model(2= 0.983). The experimental results show that the temperature of samples during the simulation was highly consistent with the experiment, indicating the better performance of the model. In addition, the cell shape was gradually altered around in the varying position with the decrease of sample temperature in the process of the pre-freezing experiment(2= 0.857). A better consistency was found with the analysis data of stress and strain of sample cells during simulation.The research results can provide reference for the optimization of vacuum freeze drying system and the scientific formulation of process parameters.
kinetics; numerical simulation; vacuum freeze drying; heat and mass transfer; stress and strain
10.11975/j.issn.1002-6819.202212013
TQ028
A
1002-6819(2023)-06-0259-10
曾涛,刘斌,石胜强,等. 枸杞真空冷冻干燥动力学的数值模拟及分析[J]. 农业工程学报,2023,39(6):259-268.doi:10.11975/j.issn.1002-6819.202212013 http://www.tcsae.org
ZENG Tao, LIU Bin, SHI Shengqiang, et al. Numerical simulation and analysis of the vacuum freeze drying kinetics of[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2023, 39(6): 259-268. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.202212013 http://www.tcsae.org
2022-12-02
2023-01-13
天津市科技计划项目(20YFZCSN980)资助
曾涛,研究方向为冷链相关技术,Email:13718637604@163.com
刘斌,博士,教授,研究方向为冷链相关技术,Email:lbtjcu@tjcu.edu.cn

